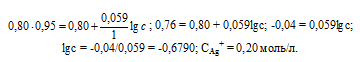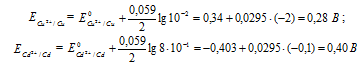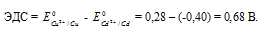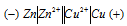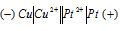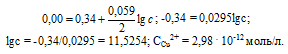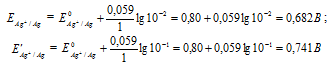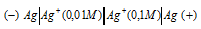Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Решение задач с использованием уравнения Нернста (Nernst)
Решение задач по химии с использованием уравнениея Нернста
Задание 246.
Потенциал серебряного электрода в растворе АgNO3 составил 95% от значения его стандартного электронного потенциала. Чему равна концентрация ионов Аg+ (моль/л). Ответ: 0,20 моль/л.
Решение:
Электродный потенциал металла (Е)зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Используя уравнение Нернста, получим выражение для расчета концентрации ионов Ag + в растворе:
Ответ: 0,20 моль/л.
Задание 247.
Составьте схему, напишите электронные уравнения электродных процессов, и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Сd 2+ ] = 0,8 моль/л, а [Сu 2+ ] = 0,01 моль/л. Ответ: 0,68 В.
Решение:
Схема данного гальванического элемента:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Кадмий имеет меньший потенциал (—0,403 В) и является анодом, на котором протекает окислительный процесс:
Cd 0 — 2 
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu 2+ + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Cd 0 + Cu 2+ = Cd 2+ + Cu 0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1 молы/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
Ответ: 0,68 В.
Задание 248.
Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором медь является катодом:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn 0 — 2 
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu 2+ + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Zn 0 + Cu 2+ = Zn 2+ + Cu 0
б) Схема гальванического элемента, в котором медь является анодом:
Медь имеет меньший потенциал (+0,34 В) и является анодом, на котором протекает окислительный процесс:
Cu 0 — 2 
Платина, потенциал которой +1,19 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Pt 2+ + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Сu 0 + Pt 2+ = Cu 2+ + Pt 0
Задание 249.
При какой концентрации ионов Сu 2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 2,98 . 10 -12 моль/л..
Решение:
Определим концентрацию ионов Cu 2+ , при которой потенциал медного электрода равен 0,00 В, получим:
Ответ: 2,98 . 10 -12 моль/л.
Задание 250.
Какой гальванический элемент называют концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3. Ответ: 0,059 В.
Решение:
Гальванический элемент, работа которого основана на различных концентрациях ионов металла у катода и у анода, называется концентрационным. Обычно катод и анод сделаны из одного и того же металла, опущенных в растворы своей соли разной концентрации. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы серебряных электродов при разных концентрациях ионов серебра Ag+, получим:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Уравнение Нернста.
Уравнение было получено немецким физико-химиком В. Нернстом. Оно связывает электродный потенциал с природой металла, концентрацией его ионов в растворе и абсолютной температурой. Вывод уравнения основан на применении второго начала термодинамики к процессу (6). Для вывода уравнения рассмотрим металл, который представляет собой металлическую пластинку, опущенную в раствор своей соли. Такая система носит название металлический электрод.
Электрическая работа по переносу 1 моль катионов с поверхности металла в раствор или обратно равна произведению суммарного перенесенного заряда Z∙F на разность потенциалов φM Z + /M
где Z – зарядовое число катиона или число электронов, принимающих участие в процессе; F- постоянная Фарадея, равная 96500 Кл/моль; φM Z + /M – электродный потенциал, В.
Согласно второму закону термодинамики, максимальная работа, совершаемая закрытой системой в изобарно-изотермическом процессе (то есть при Р, Т = const), равна убыли её энергии Гиббса
Можно получить, используя уравнение изотермы химической реакции, что изменение энергии Гиббса в ходе процесса (6) равно
где aM – относительная (отнесенная к стандартной) активность металла в кристалле;
aM Z + — относительная активность ионов металла в растворе.
Из выражений (9) и (10) получаем
Приравнивая выражения для электрической работы (8) и (11), получаем после несложных преобразований уравнение Нернста для металлического электрода
Так как К 0 – стандартная термодинамическая константа равновесия реакции, то при Т = const она является постоянной величиной. Поэтому для данного электрода первое слагаемое в выражении (12) является постоянной величиной. Его обозначают через
φ 0 М/M Z + и называют стандартным электродным потенциалом.
Активность металла аМ в его кристалле для индивидуального вещества является стандартной активностью и равна 1, то есть
Тогда получаем выражение для уравнения Нернста, используемое в практических расчетах
В разбавленных растворах электролитов коэффициенты активности ионов равны их концентрациям. Поэтому уравнение Нернста можно представить в следующем виде, если иcпользовать молярные концентрации ионов СМ Z +
Таким образом, потенциал металлического электрода зависит от природы металла и от условий, в которых находится раствор. Зависимость электродного потенциала от природы характеризуется величиной φ 0 M Z + /M , которая представляет собой табличное значение стандартного потенциала. Данное значение обычно берут из справочников. Зависимость от температуры раствора и концентрации ионов в растворе определяется вторым слагаемым уравнения Нернста. Как видно из (15), потенциал металлического электрода увеличивается с ростом температуры и концентрации ионов металла в растворе.
Отметим, что иногда встречается выражение уравнения Нернста, имеющего вид
Данное уравнение получается при условии Т = 298 К; R = 8,31 Дж/(моль∙К); F = 96500 Кл/моль и замене натурального логарифма на десятичный.
В наиболее общем случае уравнение Нернста записывается для электродного процесса
Ox + Ze — ↔ Red (17),
где Ox – окисленная форма частиц, участвующих в реакции; Red – восстановленная форма частиц, участвующих в реакции. Уравнение Нернста для этого процесса записывается следующим образом
φOx/Red = φ 0 Ox/Red + 
Зависимость электродного потенциала от природы окислительно-восстановительной системы характеризуется величиной φ 0 Ox/Red, которую обычно находят из справочных таблиц, зависимость от температуры и активностей окисленной и восстановленной форм определяется вторым слагаемым из (18).
Потенциал окислительно-восстановительной системы увеличивается с ростом температуры и активности окисленной формы и уменьшается с ростом активности восстановленной формы.
Дата добавления: 2015-08-08 ; просмотров: 3374 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://buzani.ru/zadachi/khimiya-shimanovich/939-khimicheskaya-svyaz-i-stroenie-molekul-zadaniya-61-65
http://helpiks.org/4-60989.html