Обратимые электродные потенциалы.
Уравнение Нернста
Как уже сказано выше, в стационарном состоянии на границе раздела металл — электролит устанавливается динамическое равновесие между переносом зарядов в прямом и обратном направлении, т.е. устанавливается так называемый ток обмена, который соответствует равенству катодного и анодного токов:
Если при этом перенос зарядов из металла в раствор и в обратном направлении осуществляется одним и тем же носителем, например, ионом Меn+, то на электроде реализуется не только баланс зарядов, но и баланс вещества, и после достижения равновесия убыль массы металла не происходит. Устанавливающийся в таких условиях потенциал называют равновесным или обратимым.
Рассмотренной схеме соответствует металлический электрод, помещенный в раствор, содержащий одноименные металлу ионы и не содержащий других окислителей (например, в раствор собственной соли). Обратимый потенциал такого электрода характеризует равновесие реакции:
При этом единственными носителями заряда являются ионы Меn++ и коррозия металла не происходит.
В терминах химической термодинамики равновесие в подобной системе может быть описано уравнением:
G = Go — RT ln a(Men+), (3.2)
где G — изменение изобарно-изотермического потенциала в рассматриваемой реакции; Go — изменение стандартного изобарно-изотермического потенциала;
R — универсальная газовая постоянная: R=8,314Дж/(Кмоль); Т — абсолютная температура, К; а(Men+)- активность ионов металла.
Подставляя в это уравнение выведенное ранее (раздел 3.1.2.) выражение G = — nFE и вытекающее из него Go = — nFEo, где Е — э.д.с. гальванического элемента, в котором происходит рассматриваемая реакция, т.е. разность потенциалов между катодными и анодными участками поверхности электрода (Е = к-а), а Еo — э.д.с. аналогичного стандартного гальванического элемента (Еo=кo-аo), для рассматриваемой реакции получим:
Е = Еo + (RT/nF) ln a(Men+) (3.3)
Аналогичным образом могут быть выражены и отдельные составляющие величины Е, т.е. потенциалы прямой и обратной реакций (к и а). Например:
к = ко + (RT/nF) ln a(Men+). (3.4)
А так как, в соответствии с конвенцией IUPAC, потенциалом электрода считается его потенциал при условии, что электродная реакция протекает в сторону восстановления (в нашем случае катодная реакция), то и обратимый потенциал рассматриваемого металлического электрода может быть рассчитан по уравнению:
Me = Meo + (RT/nF) ln a(Men+), (3.5)
где Meo — стандартный электродный потенциал.
Полученное уравнение впервые было выведено Нернстом и имеет фундаментальное значение в теории электрохимической коррозии.
В общем случае уравнение Нернста принимает вид:
= o — (RT/nF) ln Пi (аi)ki , (3.6)
где знак Пi обозначает произведение активностей веществ, участвующих в электродной реакции, аi , причем каждая из активностей возведена в степень, равную стехиометрическому коэффициенту ki в общем уравнении реакции (напомним, что в терминах химической термодинамики стехиометрические коэффициенты исходных веществ являются отрицательными числами, а продуктов реакции — положительными).
Отметим, что = o при условии, что активности всех компонентов равны 1 (аi = 1), так как в этом случае и их произведение равно 1, а ln1 = 0. Полученный вывод полностью соответствует определению стандартного электродного потенциала.
За стандартный электродный потенциал (eo) принята величина э.д.с., которая возникла бы в гальваническом элементе, составленном из нормального водородного электрода и исследуемого металлического электрода, опущенного в раствор собственной соли, при условии, что активности всех участвующих в реакции веществ равны единице.
3.1.4. Необратимые электродные потенциалы.
Диаграммы Пурбе.
В рассмотренном выше случае при установлении равновесного обратимого потенциала перенос заряда через границу металл — раствор осуществляется только одним сортом ионов — ионами металла, и при этом растворение металла не происходит.
В реальных условиях коррозии протекание анодного процесса обеспечивается, главным образом, за счет переноса ионов металла (с электрода в раствор), а протекание катодного процесса — за счет восстановления каких-либо других ионов, например Н+. Устанавливающийся на таком электроде при достижении равновесия постоянный во времени потенциал называется необратимым , стационарным или компромиссным.
При этом значении потенциала, как и на обратимом электроде, выполняется равенство суммарных анодных и катодных токов:
Iа = Iк (условие электронейтральности)
или, переходя к понятию плотность тока i = I/S, A/м2, где S — площадь поверхности электрода, можно записать:
iа = iк.
Подчеркнем, что в рассматриваемых условиях и анодный, и катодный токи являются результатом переноса зарядов двумя видами ионов — ионами металла Меn+ и ионами деполяризатора (окислителя), например, Н+. Однако, большая часть анодного тока обеспечивается ионами Меn+, а большая часть катодного тока — ионами деполяризатора:
iа = iаМе + iаН = iк = iкН + iкМе, но iаМе >> iаН и iкН >> iкМе
и, следовательно, iаМе >> iкМе.
Последнее неравенство означает, что количество ионов металла, переходящих в раствор, значительно больше, чем количество восстанавливающихся на электроде («возвращающихся») ионов Меn+, т.е. в результате описанных явлений происходит убыль массы металла — коррозионный процесс. Именно поэтому стационарные необратимые потенциалы металлов часто называют потенциалами коррозии.
Таким образом, одной из основных характеристик коррозионного процесса может служить стационарный электродный потенциал, при котором на электроде одновременно протекают анодная реакция ионизации металла (реакция (3.3)) и катодная реакция восстановления окислителя (реакция (3.4)).
Отметим, что уравнение Нернста ((3.5) и (3.6)) было получено для равновесного обратимого электрода и использовать его для вычисления необратимых потенциалов нельзя. Величины потенциалов коррозии определяются только экспериментально и зависят от множества факторов: от химической природы металла, от состояния его поверхности и химической природы и концентрации компонентов коррозионной среды, от присутствия поверхностноактивных веществ (ПАВ) и наличия явлений специфической адсорбции, а также от напряженного состояния металла и температуры.
Наиболее наглядной формой представления термодинамических данных о коррозионном и электрохимическом поведении металлов при контакте с водными средами являются предложенные бельгийским коррозионистом М. Пурбе термодинамические диаграммы в координатах потенциал — рН.
Напомним, что величина рН введена для упрощения формализации физикохимических закономерностей : рН = -lg aН+ , — и служит характеристикой кислотности среды, причем, так как ионное произведение воды Кв есть величина постоянная:
Кв = аН+ аОН-= 1,0810-14, то
lg аОН- = lg Kв — lg aН+ = -14 + pH,
и следовательно, нейтральной среде (аН+ = аОН-)соответствует значение рН = 7, кислой (аН+ > аОН-) — 0
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Обратимые потенциалы металлов, уравнение Нернста.
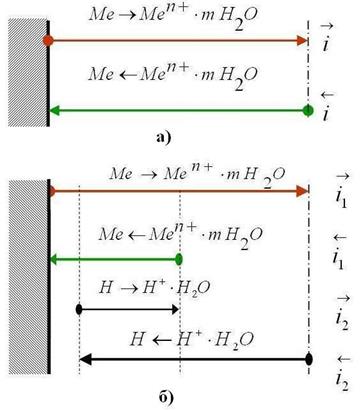
Исходя из предположения, что, если при взаимодействии металла с водным раствором электролита фазовую границу пересекают только ионы металла, то протекают два сопряженных процесса (А. Н. Фрумкин):
1) анодный (окислительный) процесс – переход ионов металла в раствор с образованием гидратированных ионов:
Ме + Н2О = Ме n+ ·mH2O + ne, (4.5) скорость которого, измеряемая числом ионов, переходящих из твердой фазы в жидкую фазу в единицу времени, может быть выражена через плотность соответствующего тока прямого процесса 
2) катодный (восстановительный) процесс – разряд гидратированных ионов из раствора с выделением их на поверхности металла в виде нейтральных атомов:
Ме n+ ·mH2O + ne = Ме + Н2О, (4.6) скорость обратного процесса определяется соответствующей плотностью тока 
Рис. 4.4. Схема установления электродных потенциалов металлов:
а) – обратимого (равновесного), б) – необратимого.
Какой из этих процессов преобладает, определяется уровнем потенциальной энергии катионов в узлах кристаллической решетки металла ПMe и в растворе Пp. Если ПMe>Пр, то 
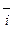
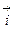
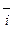
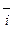
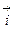
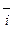
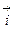
Образующийся ДЭС затрудняет протекание прямого процесса и облегчает протекание обратного. Когда потенциал в нем достигает значения, при котором энергетический уровень ионов в металле и растворе становится одинаковым, ПМе = Пр, устанавливается динамическое равновесие, при котором скорости анодного и катодного процессов равны:
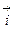
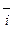
Этому равновесному состоянию соответствует некоторый скачок потенциала металла между металлом и раствором электролита, абсолютная величина которого неизвестна, поскольку разность потенциалов между двумя фазами нельзя измерить непосредственно. Для её определения измеряется э.д.с. элемента, составленного из исследуемого электрода (металла в электролите) и электрода сравнения. Эта э.д.с. и называется электродным потенциалом металла.
Обратимый (равновесный) электродный потенциал металла (ЕMe)o6p или ( 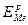
В случае установления обратимого потенциала скорости анодного и катодного процессов равны ( 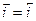
Обратимый (равновесный) электродный потенциал металла рассчитывается по уравнению Нернста, его величина количественно характеризует способность металла посылать свои ионы в раствор электролита.
Уравнение Нернста может получено на основе термодинамических соотношений. Т.к. знак потенциала зависит от направления реакции, обратимо протекающие реакции записываются в восстановительной форме:
Ме n+. mH2O+ ne 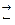
Для этой реакции уравнение изотермы Вант-Гофффа записывается как:
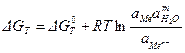
Поскольку, работа по созданию двойного электрического слоя (аналогично соотношению 4.2) равна убыли энергии Гиббса:
де Eдс – потенциал двойного электрического слоя (потенциал гальванического элемента металл-раствор или обратимый потенциал металла Еобр); n – заряд иона металла; F – постоянная Фарадея.
Подставляя (4.9) в уравнение 4.9, поскольку aMe =1, 
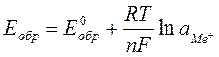
где 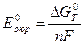
В общем случае, при протекании на поверхности металла, находящегося в контакте с электролитом, окислительно–восстановительной реакции с участием окисленной Ох и восстановленной Red форм вещества:
mOx + ke 
обратимый потенциал этой (катодной) реакции равен:
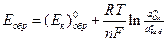
где 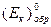
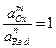
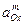
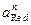
Стандартные потенциалы приведены в таблице 4.1.
Стандартные электродные потенциалы некоторых металлов и
окислительно-восстановительных реакций при 25 0 С.
| Реакция | Потенциал, В | Реакция | Потенциал, В |
| Li + +e=Li | –3,01 | H + + e = ½H2 | 0,000 |
| K + +e=K | –2,925 | Sn 4+ +4e=Sn | 0,007 |
| Na 2+ +2e=Na | –2,900 | Cu 2+ +2e=Cu | 0,337 |
| Mg 2+ +2e=Mg | –2,370 | Cu + +e=Cu | 0,521 |
| Al 3+ +3e=Al | –1,660 | Fe 3+ +e=Fe 2+ | 0,77 |
| Ti 2+ +2e=Ti | –1,630 | Ag + +e=Ag | 0,799 |
| Ti 3+ +3e=Ti | –1,210 | Hg 2+ +2e=Hg | 0,854 |
| Mn 2+ +2e=Mn | –1,180 | Pd 2+ +2e=Pd | 0,987 |
| Cr 2+ +2e=Cr | –0,913 | Ir 3+ +3e=Ir | 1,150 |
| Zn 2+ +2e=Zn | –0,762 | Pt 2+ +2e=Pt | 1,190 |
| Cr 3+ +3e=Cr | –0,740 | Au 3+ +3e=Au | 1,500 |
| Fe 2+ +2e=Fe | –0,440 | Au + +e=Au | 1,690 |
| Cd 2+ +2e=Cd | –0,402 | 2H2O+2e=H2+OH – (щелочные среды) | –0,828 |
| Mn 3+ +3e=Mn | –0,283 | O2+2H2O+4e=4OH – (нейтральные и щелочные среды) | 0,401 |
| Ni 2+ +2e=Ni | –0,250 | 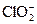 +H2O+2e=ClO – +2OH – (щелочные среды) +H2O+2e=ClO – +2OH – (щелочные среды) | 0,66 |
| Mo 3+ +3e=Mo | –0,200 | NO 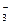 +4H + +3e=NO+2H2O +4H + +3e=NO+2H2O | 0,96 |
| Sn 2+ +2e=Sn | –0,136 | O2+4H + +4e=2H2O (кислоты) | 1,23 |
| Pb 2+ +2e=Pb | –0,126 | Cl2+2e=2Cl – | 1,36 |
| Fe 3+ +3e=Fe | –0,037 | H2O2+2H + +2e=2H2O | 1,78 |
Активность ионов в реакции диссоциации:
определяется как произведение концентрации данного иона на средний коэффициент активности:
где С+, С– – моляльные концентрации соответствующих ионов в растворе, m и n – число катионов и анионов, на которые распадается молекула при диссоциации, f± — средний ионный коэффициент активности.
Для труднорастворимых веществ, например гидрооксидов металлов:
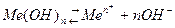
активность ионов металла:
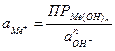
Пример 4.1. Рассчитать обратимый потенциал меди в 0,1 моляльном водном растворе СuSO4 при 298 К (средний ионный коэффициент активности ионов меди в данных условиях, 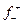
Решение. 1) Окислительно-восстановительная электродная реакция меди: Сu 2+ + 2е 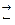
2) Обратимый потенциал меди находим по уравнению Hepнcтa: 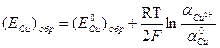
3) Активность ионов меди: 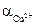
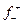
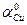
4) Стандартный обратимый потенциал для реакции берем из справочных данных (табл.4.1). Подставляем полученные данные и определяем: 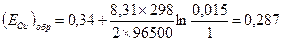
Пример 4.2. Найти обратимый потенциал кислородного электрода в нейтральном 1 m растворе Na2SO4 при 298 К в атмосфере воздуха.
Решение. 1) Кислород восстанавливается в катодном процессе по реакции: 2Н2О+О2+4е=4ОН 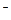
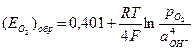
2) Активность газа определяется его парциальным давлением. Парциальное давление кислорода в воздухе 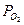
3) Активность гидрооксил-ионов в нейтральном растворе определяется через ионное произведение воды, КВ= 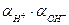
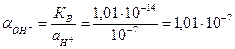
4) Подставляем полученные значения в уравнение Нернста: 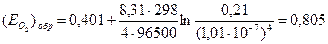
Дата добавления: 2017-02-13 ; просмотров: 3823 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta
http://poznayka.org/s84432t1.html