СВОЙСТВА РАСТВОРОВ ВМС
Истинные растворы ВМС по своим свойствам резко отличаются от растворов низкомолекулярных соединений:
1) Осмотическое давление растворов ВМС не подчиняется закону Вант-Гоффа.
Обычно экспериментально определенное значение осмотического давления растворов ВМС значительно выше значения, рассчитанного по уравнению Вант-Гоффа. Объясняется это тем, что макромолекула благодаря своей гибкости ведет себя в растворе как несколько более коротких молекул. При повышении концентрации возрастает число сегментов макромолекулы, которые ведут себя независимо друг от друга. Для вычисления осмотического давления π растворов ВМС предложено следующее уравнение:

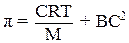
где С – массовая концентрация раствора;
М – молярная масса полимера;
Т – абсолютная температура;
где B – константа, зависящая от природы растворителя.
2) Скорость диффузии макромолекул полимера невелика, она сопоставима со скоростью диффузии типичных коллоидных частиц.
Для расчета коэффициента диффузии ВМС применимо уравнение Эйнштейна:
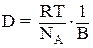
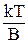
где В – коэффициент трения диффундирующих частиц данной формы.
Для сферических частиц В = 6πηr. Однако макромолекулы ВМС редко имеют форму, близкую к сферической.
3) Растворы ВМС способны рассеивать свет, хотя и в меньшей степени, чем типичные коллоидные системы. В растворах ВМС эффект Тиндаля обнаруживается не совсем четко вследствие того, что показатель преломления сольватированных частиц растворенного вещества n мало отличается от показателя преломления растворителя n0, поэтому разность (n – n0) > 0, но интенсивность рассеяния света растворами ВМС незначительна. По этой же причине макромолекулы невозможно обнаружить под ультрамикроскопом. Кроме того, макромолекулы соизмеримы с коллоидными частицами только по длине, а в других направлениях соответствуют размерам обычных молекул
4) Растворы ВМС обладают высокой вязкостью. Только очень разбавленные растворы подчиняются законам Ньютона и Пуазейля (см. «Вязкость ВМС»).
5) Растворы ВМС являются истинными растворами, агрегативно устойчивыми системами. Однако при добавлении электролитов наблюдается выделение высокомолекулярных соединений из раствора. Это явление называется высаливанием (см. «Устойчивость растворов ВМС»).
6) Для растворов ВМС характерно явление коацервации. Коацервация – это разделение системы на две фазы, из которых одна представляет собой раствор ВМС в растворителе, а другая – раствор растворителя в ВМС, при изменении температуры или рН или при введении низкомолекулярных веществ (см. «Устойчивость растворов ВМС»).
7) Для растворов ВМС характерно явление спонтанного, самопроизвольного изменения вязкости при длительном хранении растворов. Это явление носит название старение раствора. Старение происходит либо в результате деструкции макромолекул полимера, либо в результате связывания макромолекул. Старение происходит под влиянием кислорода и некоторых других примесей.
8) При увеличении концентрации растворов ВМС, изменения температуры или при добавлении электролита возможно образование пространственной сетки, приводящей к образованию студня(см. «Устойчивость растворов ВМС»).
ВЯЗКОСТЬ ВМС
Основными факторами, определяющими структуру и реологические свойства дисперсной системы, является концентрация частиц дисперсной фазы и энергия взаимодействия частиц. В разбавленных агрегативно устойчивых дисперсных системах частицы сохраняют полную свободу взаимного перемещения, или, как говорят, определенная структура отсутствует. Такие системы относятся к ньютоновским.
Их вязкость описывается законом Эйнштейна: вязкость дисперсной системы (золя, суспензии) увеличивается с ростом содержания дисперсной фазы.
Эта связь выражается уравнением:
где η и η0 − вязкости коллоидного раствора и дисперсионной среды соответственно;
φ = Vd/V − объемная доля дисперсной фазы (Vd) в общем объеме системы (V);
k − константа, зависящая от формы частиц.
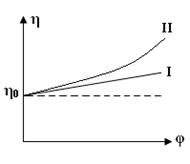
Физический смысл этого закона заключается в том, что относительное приращение вязкости прямо пропорционально относительному содержанию в системе дисперсной фазы. Чем больше объемная доля дисперсной фазы в системе, тем сильнее выражено тормозящее влияние части на поток жидкости (прямая I на рис.5).
Рис.5 – Зависимость вязкости от объемной доли дисперсной фазы для:
I – бесструктурной (ньютоновcкой) дисперсной системы; II – структурированной (неньютоновской) дисперсной системы.
Структурированные коллоидные системы не подчиняются закону Эйнштейна. Для них значение вязкости увеличивается с ростом содержания дисперсной фазы значительно сильнее, чем следует из уравнения Эйнштейна (кривая II на рис.5).
Согласно современным представлениям, достаточно гибкие молекулы ВМС в растворе находятся в виде статистических клубков, пропитанных растворителем. Наличие таких клубков, а также образование структур в растворе обусловливает аномальную зависимость вязкости растворов полимеров от их концентрации, не подчиняющуюся уравнению Эйнштейна. Растворы ВМС – неньтоновские жидкости.
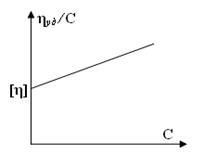
Зависимость удельной вязкости не слишком концентрированных растворов полимеров от концентрации обычно удовлетворительно описывается уравнением, предложенным Хаггинсом:
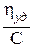
где [η] − характеристическая вязкость (см. табл.1);
С − концентрация раствора, г/100 мл;
k1 − коэффициент, называемый константой Хаггинса.
Коэффициент k1 служит характеристикой взаимодействия макромолекул в системе полимер − растворитель. Его значение практически не зависит от молярной массы полимера и меняется лишь в зависимости от природы растворителя. Во взаимодействующих с ВМС растворителях, значение константы Хаггинса составляет 0,2 − 0,3.
Таблица 1 − Обозначения и названия величин, принятые в вискозиметрии растворов полимеров
| Обозначение величины | Название |
| ηотн = η/η0 | Относительная вязкость |
| ηуд = (η − η0)/η0 = ηотн− 1 | Удельная вязкость |
| ηпр = ηуд/С | Приведенная вязкость |
| ln ηотн /С | Логарифмическая приведенная вязкость |
| [η] = (ηуд/С)С→0 == (ln ηотн /С) С→0 | Характеристическая вязкость |
Характеристическая вязкость, отражающая гидродинамическое сопротивление молекул полимера потоку жидкости, может быть определена для разбавленных растворов полимеров, в которых взаимодействием макромолекул можно пренебречь. Для нахождения характеристической вязкости устанавливают зависимость приведенной вязкости от концентрации в узком интервале малых концентраций и полученные результаты экстраполируют к нулевой концентрации (рис.6).
Рис. 6 − График для определения характеристической вязкости раствора ВМС
Связь между характеристической вязкостью раствора ВМС и молярной массой полимера удовлетворительно описывается эмпирическим уравнением Марка –Хаувинка:
где α – постоянная (как и «К») для данного полимергомологического ряда в конкретном растворителе при определенной температуре. Постоянная «α» отражает степень свертывания молекул полимера и гибкость цепи. Для жестких палочкообразных молекул α ≈ 1, для гибких молекул, свернутых в глобулу α ≈ 0,5.
Зная характеристическую вязкость раствора ВМС, по уравнению Марка –Хаувинка можно определить молярную массу полимера:
М α = [η]/ К или lgM = 
Следует отметить, что полученное значение молярной массы является среднестатистическим, поскольку любой реальный полимер представляет собой полидисперсную смесь макромолекул.
Дата добавления: 2016-04-22 ; просмотров: 5796 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Тема: Понятие о ВМС, классификаций. Свойства ВМС. Молекулярные коллоидные системы (растворы ВМС). Набухание и растворение ВМС. Лиотропные ряды ионов. Вязкость и осмотические свойства растворов ВМС
Тема: Понятие о ВМС, классификаций. Свойства ВМС.
Молекулярные коллоидные системы (растворы ВМС). Набухание и растворение ВМС. Лиотропные ряды ионов. Вязкость и осмотические свойства растворов ВМС.
Высокомолекулярные вещества (ВМВ).
Высокомолекулярные соединения (ВМС) – это вещества, молекулы которых состоят из большого числа химически связанных атомов. Такие молекулы называют макромолекулами. К высокомолекулярным веществам относятся вещества, состоящие из макромолекул с молекулярной массой порядка 104-106 и выше.
— природные полимеры (например, белки, нуклеиновые кислоты, полисахариды, натуральный каучук);
— синтетические полимеры, которые получаются в результате реакции полимеризации или поликонденсации (например, полиэтилен, синтетический каучук, фенолформальдегидные пластмассы);
— полусинтетические («искусственные»), которые получаются в результате химической обработки природных ВМВ (например, ацетилцеллюлоза, нитроцеллюлоза).
По строению макромолекул:
— линейные полимеры, макромолекулы, которых представляют собой открытую линейную цепь (например, натуральных каучук, целлюлоза, полиэтилен, пропилен);
— разветвленные макромолекулы ВМВ, имеющие цепи с разветвлениями (например, гликоген, амилопектин, крахмал);
— пространственные ВМВ, молекулы, которых представляют собой трехмерные сетки, образованные отрезками цепного строения (например, фенолформальдегидные смолы).
Из пространственных полимеров в особую группу выделяют полимеры:
— сетчатые, у которых фрагменты макромолекул, образующие сетки (пространственные ячейки), приблизительно равны (например, полистирол);
— сшитые, цепи которых сшиты короткими мостиками (обычно состоящими из одного или нескольких атомов, например, серы в резине) (рис.1).
Практически все важные свойства ВМВ тесно связаны с их строением. Так линейной формой макромолекул определяются: способность ВМВ образовывать прочные пленки, нити, набухать, давать при растворении вязкие растворы, быть эластичными.
Полимеры с пространственной структурой, обычно, не растворимы в воде. Форма макромолекулы, имеющей линейную цепь, может приближаться к палочке (полифенилены, полиацетилены), свертываться в спираль (амилоза, пептиды, нуклеиновые кислоты) или в клубок (глобулярные белки).
От формы макромолекулы зависят их свойства.
Линейные полимеры легко переводятся в раствор, обладающий даже при небольших концентрациях высокой вязкостью. Такие полимеры прочны и эластичны.
У разветвленных полимеров, за счет меньшей степени асимметрии молекул вязкость растворов не высока, и они обладают низкой прочностью.
Сетчатые полимеры, в которых прочные химические связи между макромолекулами, не могут быть переведены в раствор. Они тверды, и приближаются по свойствам к кристаллам (например, кристаллический полимер с правильной пространственной решеткой — алмаз).
Рис.1. Схемы строения макромолекул полимеров:
А – линейного; Б – разветвленного; В – пространственного; Г – сшитого.
Возможна классификация ВМВ и по:
а) химическому составу:
— гомополимеры, которые содержат одинаковые мономерные звенья (например, полиэтилен, полипропилен);
— сополимеры, которые содержат два или более различных мономеров (например, белки, нуклеиновые кислоты);
б) физическому состоянию:
— аморфные, у которых отдельные макромолекулы или их сегменты расположены хаотично относительно друг друга (например, каучук, поли-, изо-бутелен);
— кристаллические, у которых отдельные макромолекулы или их сегменты расположены по отношению друг к другу упорядоченно (например, полиамиды, полиэтилен).
Возможны и другие подходы к классификации.
Получение синтетических ВМВ основано на реакциях – полимеризации и поликонденсации. При полимеризации побочных продуктов не образуется. При поликонденсации в качестве побочного продукта образуется низкомолекулярное вещество (часто вода).
Специфические свойства полимеров обусловлены главным образом двумя особенностями: 1) существованием двух типов связей – химических и межмолекулярных, удерживающих макромолекулярные цепи друг около друга; 2) гибкостью цепей, связанной с внутренним вращеньем звеньев. В результате чего макромолекула может изменять пространственную форму путем перехода из одной конформации к другой. В результате конформационных изменений макромолекулы могут либо свертываться, образуя глобулы и клубки или выпрямляться и укладываться в ориентированные структуры – пачки. Наиболее вероятной конформацией молекулы ВМС является клубок, или глобула. Гибкость цепей полимеров зависит от химического строения цепи, природы заместителей, их числа и распределения по длине цепи, числа звеньев в цепи.
Свойства растворов ВМС
Растворы ВМС, как и растворы низкомолекулярных соединений (НМС), являются гомогенными, термодинамически равновесными и агрегативно устойчивыми системами. Это истинные растворы.
Однако свойства растворов ВМС (табл. 1) существенно отличаются от свойств растворов НМС. Отличия заключается в том, что растворы ВМС обладают малой скоростью диффузии, малым осмотическим давлением, значительной вязкостью, чем соответствующие им по концентрации растворы НМС. Растворы ВМС имеют также свойства. Не присущие растворам НМС: светорассеивание, тиксотропия.
Тиксотропия– способность в изотермических условиях самопроизвольно восстанавливать свою структуру после механического разрушения.
Таблица 1
Характеристики и свойства различных дисперсных систем
Характеристики и свойства
1. Дисперсологическая характеристика
Гомогенная система
1.1. Дисперсионная среда
1.2. Дисперсная фаза
1.3. Поверхность раздела фаз
1.4. Размер частиц дисперсной фазы, нм
3. Физические свойства
3.3. Осмотическое давление
3.4. Броуновское движение
3.5. Конус Тиндаля
3.7. Возможность ультрафильтрации (диаметр пор фильтра менее 1 нм)
3.8. Возможность фильтрации через бумажный фильтр
Есть для невязких растворов
3.9. Возможные явления под действием электролитов, спирта, сиропов, глицерина
Растворение ВМС происходит самопроизвольно, но имеет характерную особенность, растворению предшествует набухание, которое заключается в увеличении объема и массы полимера за счет поглощения им какого-то количества растворителя. Количественной мерой набухания является степень набухания б, которая может иметь объемное или массовое выражение:
б – степень набухания;
V0 и V, m0 и m – соответственно объемы и массы исходного и набухавшего полимера.
Причина набухания заключается в различии свойств двух компонентов – ВМС и НМС. Скорость этого процесса определяется подвижностью молекул, коэффициентом их диффузии. Специфика набухания полимеров заключается в том, что взаимодействуют и смешиваются молекулы, различающиеся между собой на много порядков по своим размерам и подвижности. Поэтому переход макромолекул в фазу растворителя происходит очень медленно, тогда как молекулы НМС быстро проникают в сетку полимера, раздвигая цепи и увеличивая его объем.
Гибкость цепей облегчает проникновение малых молекул в сетку полимера. То есть, процесс набухания представляет собой одностороннее смещение, обусловленное большим различием в размерах молекул.
Способность к набуханию есть свойство полимера, определяемое его составом и строением, как и структурно-механические его свойства. Поэтому процесс набухания всегда специфичен. Полимер набухает ни в любом, а лишь в «хорошем» растворителе, с которым он взаимодействует. Это взаимодействие связано с полярностью. Поэтому полярные полимеры набухают в полярных жидкостях, например, белки в воде, неполярные – в неполярных (каучук в бензоле).
Набухание может быть ограниченным и неограниченным. В первом случае б достигает постоянной предельной величины (например, набухание желатина в воде при комнатной температуре), во втором – значения m и б проходят через максимум, после которого полимер постепенно растворяется (например, желатин в горячей воде). В этом случае набухание является начальной стадией растворения.
Процесс набухания можно разделить на 2 стадии. На первой стадии происходит выделение теплоты ∆Н, наблюдается контракция системы (уменьшение общего объема). Вторая стадия почти не сопровождается контракцией и выделением теплоты, но характеризуется увеличением б и объема набухающего полимера.
Ограниченное набухание обычно заканчивается на второй стадии, неограниченное приводит к растворению полимера. Ограниченно набухший полимер называется студнем.
Одним из факторов, влияющим на процесс набухания и растворения полимеров, является степень полярности звеньев полимера и молекул растворителя. Если полярности звеньев цепи и молекул растворителя близки между собой, то набухание и растворение таких полимеров происходит относительно легко.
Вторым фактором, способствующим этим процессам, является гибкость цепей полимера, так как процесс растворения связан с отделением цепей друг от друга и диффузией их в растворителе.
Определенное значение в процессах набухания и растворения ВМС имеет молярная масса полимера, поскольку с удлинением цепей энергия взаимодействия между ними возрастает и для отделения их друга от друга требуется больше энергии. Чем выше молярная масса полимера, тем труднее он растворяется. На процесс набухания влияет также температура, рН среды, присутствие электролитов.
Растворы высокомолекулярных веществ.
Растворение ВМВ – процесс самопроизвольный. Для него можно записать: 
Первая стадия определяется в основном сольватационным фактором, а вторая – энтропийным.
Благодаря специфическим свойствам макромолекул (их размерам и способности принимать различные конформации) растворы ВМВ имеют:
— общее свойства сходные с истинными раствораминизкомолекулярных
— общие свойства сходные с коллоидными растворами;
— специфические свойства, свойственные только ВМВ.
Свойства растворов ВМВ.
Свойства растворов ВМВ, сближающие их с истинными растворами:
— обратимость (возможность перевода из раствора в полимер, например, при высушивании и обратно).
Свойства растворов ВМВ, сближающие их с коллоидными растворами:
— малое осмотическое давление;
— малая скорость диффузии;
— способность к электрофорезу.
Специфические свойства растворов полимеров:
— способность к набуханию;
— способность к застудневанию;
— способность к высаливанию;
Фазовые состояния ВМВ.
ВМВ вследствие их большой молекулярной массы нелетучи и не способны перегоняться, и не могут быть переведены в газообразное состояние. При нагревании и достижении определенной температуры происходит термическое разложение веществ с разрывом химических связей.
ВМВ могут существовать только в двух агрегатных состояниях – твердом и жидком.
Аморфные полимеры плавятся и отвердевают не при фиксированной температуре, а в некотором температурном интервале.
В зависимости от температуры ВМВ имеет 3 физических состояния:
Температуры перехода одного физического состояния в другое называют температурами фазового перехода.
При низких температурах (Тс – температура стеклования) ВМВ находятся в стеклообразном состоянии (твердое, хрупкое – пластмасса, органические стекла). Тс – характеризуется морозостойкостью материала, сохраняющего эластичность и при низких температурах, например, Тс натурального каучука -73 0С, найлона — 47 0С.
При таком состоянии отсутствует перемещение, вращение как макромолекул, так и их сегментов. Звенья макромолекул проявляют лишь колебательное движение около положения равновесия.
При нагревании выше Тс аморфный полимер переходит в высокоэластичное состояние, цепи становятся гибкими, в них начинает проявляться микроброуновское движение, появляется способность к обратной деформации, которую имеют, например, резина, каучук.
Высокоэластичное состояние характеризуется способностью отдельных сегментов макромолекул перемещаться (вращаться) относительно друг друга.
Температура (Тт — температура текучести), при которой полимер переходит в вязкотекучее состояние, представляет собой широкий интервал.
Вязкотекучее состояние характеризуется способностью перемещаться друг относительно друга как отдельных сегментов, так и макромолекулы в целом.
Такое состояние полимера называют пластичностью (пластическим течением) – способностью его к необратимой деформации. Необратимую деформацию, заключающуюся в перемещении цепи отельными участками, относительно друг друга, называют пластическим течением.
Температуры фазовых переходов зависят от гибкости и длины цепи.
— полимеры с сетчатой структурой существуют в стеклообразном состоянии;
— полимерам с короткими цепями присущи только 2 состояния: стеклообразное и вязкотекучее.
По мере роста длины цепи увеличивается интервал температур Тс-Тт, усиливаются эластические свойства полимера.
Набуханием называют процесс увеличения объема (массы) образца ВМВ в результате поглощения растворителя.
Количественной мерой набухания служит степень набухания (α),которая может иметь объемное или массовое выражение:
или 
V и V0 ,m и m0 – соответственно объемы и массы набухшего и исходного полимера.
Различают виды набухания:
— ограниченное набухание, при котором степень набухания (α) достигает предельного значения, после чего набухание не зависит от времени (например, желатин в холодной воде), синтетические полимеры для контактных линз глаза.
— неограниченное набухание – заканчивается растворением полимера (например, желатин в горячей воде).
Кривые ограниченного (1) и неограниченного (2) набухания имеют вид (рис.2)
Рис. 2. Кинетические кривые набухания (V0,Vmax – j, — объемы исходного и набухающего примера).
Факторы, влияющие на набухание: добавление электролитов. Это влияние обусловлено, в основном, природой анионов и связано сихгидратируемостью.
По влиянию на набухание анионы располагаются в лиотропный ряд:
SO42- CH3COO-Cl- NO3- Br- I- NCS-
— природа растворителя и полимера. Процесс набухания всегда специфичен. Полярные полимеры набухают в полярных жидкостях (например, белки в воде), а неполярные – в неполярных (например, каучук в бензоле);
- температура и давление (по принципу Ле-Шателье); рН среды; степень измельченности полимера. Повышение степени измельченности увеличивает скорость набухания. Увеличивается общая поверхность вещества, благодаря чему ускоряется проникновение молекул растворителя внутрь ВМВ. возраст (свежесть) полимера, чем моложе ВМВ, тем больше степень и скорость набухания.
Процесс набухания протекает самопроизвольно и включает две стадии. 1-я стадия – диффузия молекул растворителя внутрь полимера. 2-я стадия разрыхление сетки с частичным освобождением отдельных молекул и увеличением энтропии системы (∆Н≈0, ∆S>0).
В основе процесса набухания лежит:
- сольватация макромолекулы – об этом свидетельствует выделение теплоты набухания (∆Н
Уравнение описывает свойства растворов вмс
Первые попытки описания свойства ВМС на основе представлений классической химии привели к коллоидной теории строения ВМС . Наибольшее значение для последующего развития химии ВМС имели мицеллярная теория К. Мейера и Г. Марка и особенно макромолекулярная теория Г. Штаудингера.
Согласно мицелярной теории строения ВМС построены из мицелл, которые представляют собой пучки жестких макромолекул. В каждую мицеллу, образующую поверхностно-органическую структурную единицу, входит 40-60 параллельно расположенных макромолекул полимера. Поведением этих структурных единиц определяются все свойства ВМС.
Штаудингер, наблюдая очень высокую вязкость даже низкоконцентрированных растворов ВМС, высказал предположение о существовании очень длинных, неассоциированных между собой молекул, размеры которых обусловливают все особенности ВМС. Штаудингер показал, что высшие и низшие члены полимергомологических рядов построены одинаково и различная способность к набуханию, растворению и другие физические свойства обусловлены различием молекулярных масс. Он отрицал возможность ассоциации молекул не только в разбавленных, но и концентрированных растворах полимеров ; полагал, что молекулы полимеров представляют собой жесткие палочки, которые не могут заметно менять свою форму.
Теория Штаудингера имела много недостатков. Но не смотря на это она имела прогрессивную роль. Эта теория впервые дала представления о полимерах как о веществах, размер молекул которых на несколько порядков отличается от размера молекул НМС, что приводит к резким качественным различиям в свойствах соединений этих двух классов .
Решающее значение в создании современной теории строения ВМС имел синтез целого ряда полимеров , этому способствовало развитие органической химии. Благодаря применению новых методов исследования, было показано, что природные синтетические полимеры состоят из длинных нитевидных молекул, молекулярная масса которых достигает десятков и сотен тысях.
На основе результатов дальнейших исследований структуры ВМС и их физических свойств сформировались современные представления о строении ВМС. Согласно им, ВМС — это вещества , молекулы которых состоят из весьма большого числа повторяющихся одинаковых звеньев . Они имеют молекулярную массу от нескольких тысяч до миллиона . Молекулы ВМС принято называть макромолекулми . Свойство ВМС зависят от величин молекул и формы молекул. ВМС представляют собой гигантские цепочкообразные молекулы , которые имеют дифильный характер . К числу полярных групп принадлежат -COOH , -NH2 , -OH и др . Эти радикалы хорошо взаимодействуют с полярными растворителями и гидратируются . О них говорят , что они гидрофильны . Молекула может содержать наряду с полярнымии и неполярные радикалы : -СН3 , -СН2 , -С6Н5 , которые могут сольватироваться неполярными жидкостями , но не могут гидратироваться . В этом случаи говорят , что они гидрофобны .
http://pandia.ru/text/80/619/80941.php
http://www.sites.google.com/site/kolloidnaahimia/tiksotropia-sinerezis-i-drugie-krasivye-slovau-liofilnye-i-strukturirovannye-sistemy/rastvory-vysokomolekularnyh-soedinenij