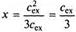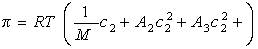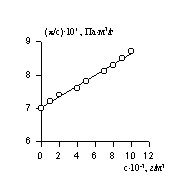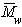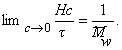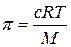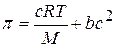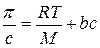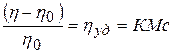Осмотическое давление растворов биополимеров
Осмотическое давление разбавленных растворов ВМС подчиняется закону Вант-Гоффа. При увеличении концентрации ВМС наблюдаются отклонения от этого закона: реальное осмотическое давление становится выше теоретического, рассчитанного по уравнению (рис. 5).
Это явление связано с тем, что в растворах ВМС кинетически самостоятельными единицами являются не только сами макромолекулы, но и их отдельные сегменты, обладающие относительной подвижностью. Тепловое движение сегментов макромолекул называют микроброуновским движением. Число подвижных сегментов увеличивается с ростом концентрации ВМС нелинейно. Для расчета осмотического давления растворов ВМС используют уравнение Галлера: 
Рис. 5. Зависимость осмотического давления от концентрации раствора: 1 — раствор ВМС; 2 — раствор низкомолекулярного неэлектролита
В сложных биологических системах суммарное осмотическое давление создается как низкомолекулярными электролитами и неэлектролитами, так и биополимерами. Составляющая суммарного осмотического давления, которая обусловлена наличием белков и других частиц коллоидного размера, называется онкотическим давлением. Доля онкотического давления относительно невелика: она составляет примерно 0,5% от суммарного осмотического давления (около 3,1 кПа), однако отклонение этой величины от нормы приводит к серьезным нарушениям в функционировании организма. Известно, что в артериальной части капилляров гидростатическое давление больше онкотического, а в венозной — меньше. Это обеспечивает перемещение безбелковой части плазмы в первом случае в межклеточную жидкость, а во втором — в обратном направлении (рис. 6).
Таким образом, устанавливается динамическое равновесие между кровью и тканевыми жидкостями, за счет чего осуществляется транспорт питательных веществ и конечных продуктов обмена. Важная роль белков в поддержании осмотического равновесия объясняется тем, что стенки капилляров обладают ультрафильтрационными свойствами: они проницаемы для большинства низкомолекулярных веществ и непроницаемы для белков, других макромолекул и коллоидно-дисперсных частиц. Понижение онкотического давления, вызванное гипопротеинемией (пониженным содержанием белков в плазме), затрудняет обратный ток жидкости из тканей в капилляры, вследствие чего возникают отеки. Гипопротеинемия может быть различной этиологии (голодание, нарушение пищеварения, выделение белка с мочой при болезнях почек и др.)
Рис. 6. Осмотическое равновесие между плазмой и межклеточной жидкостью
Мембранное равновесие
Теория мембранного равновесия была создана в 1911 г. английским физикохимиком Ф. Доннаном. Избирательная проницаемость клеточных мембран обусловливает особое перераспределение электролитов по разные ее стороны, известное под названием равновесие Доннана. Описывается оно с помощью следующего уравнения: 
где х — количество ионов, перешедших внутрь при контакте мембраны с межклеточной жидкостью; сех — концентрация иона в межклеточной жидкости (от англ. external — внешний); ст — концентрация иона во внутриклеточной жидкости (от англ. internal — внутренний).
Если до контакта мембраны с внешним раствором сех > cin, то уравнение (3) можно преобразовать следующим образом:
Анализ данного выражения показывает, что при этом условии электролит распределится поровну по разные стороны мембраны. При сех = cin уравнение (3) преобразуется иным образом:
В этом случае внутрь клетки перемещается 1/3 часть ионов, тогда как в отсутствии белка во внутриклеточной жидкости при сех = схп направленного переноса иона не наблюдалось бы. Даже при сех
5.2.2. Методы определения молекулярной массы полимеров по свойствам растворов
Свойства растворов
Наиболее часто среднечисленную молекулярную массу 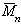
Молекулярная масса определяется как коэффициент, связывающий весовую и частичную концентрации
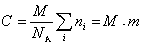
где С – весовая концентрация, г/см 3 ; 
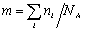
Таким образом, задача сводится к определению мольной концентрации раствора известной весовой концентрации.
Стремление молекул растворителя к самопроизвольному проникновению через мембрану определяется разностью химических потенциалов растворителя в частях системы, разделенных перегородкой, причем 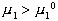
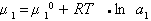
где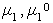
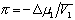
где 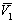
Связь между осмотическим давлением и весовой концентрацией растворов описывается следующими уравнениями:
(уравнение Вант-Гоффа) для растворов низкомолекулярных веществ
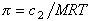
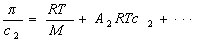
где А2 – второй вириальный коэффициент, характеризующий взаимодействие полимера с растворителем и форму макромолекул в растворе, обычно А3®0.
Величина p /c2 носит название приведенного осмотического давления. На рис. 2.50 показан пример зависимости приведенного осмотического давления для растворов полимера в различных растворителях. Чем больше наклон прямых, тем сильнее проявляется взаимодействие между компонентами раствора и тем больше величина
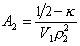
где k- параметр взаимодействия, r2 – плотность полимера в растворе, V1 – мольный объём растворителя.
При k = 0,5 А2 =0 и раствор ведет себя как идеальный. Таким образом, определяя наклон зависимости p /c2 = fc2 , можно охарактеризовать сродство компонентов раствора. Величина молекулярной массы определяется как
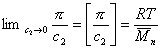
Найденная из измерений осмотического давления молекулярная масса характеризует 
Метод светорассеяния. Среднемассовая молекулярная масса
Явление светорассеяния в растворах полимеров наблюдается в том случае, если размер макромолекул менее l/2 — половины длины волны проходящего света. Существуют различные теории рассеяния света, положенные в основу расчетных уравнений экспериментальных методов определения молекулярной массы. При условии, что размер молекул полимера меньше l/2, для растворов полимеров справедлива теория рассеяния света Эйнштейна.
Если рассеяние света происходит на сферических частицах, то интенсивность рассеяния будет одинаковой во всех направлениях. Обозначим угол, под которым по отношению к падающему лучу определяется интенсивность рассеянного света, Q. Рассеивающая способность характеризуется коэффициентом рассеяния R:
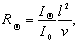
где IQ, I0— интенсивность рассеянного и падающего света; l– расстояние, на котором наблюдается рассеянный свет от рассеивающего объёма; v – рассеивающий объём.
В практике определения интенсивности рассеянного света наиболее часто определяется R90, т.е. рассеяние света под углом 90 o , хотя с помощью современных приборов, особенно использующих в качестве источника света лазер, можно определять интенсивность рассеянного света от Q = 4 o .
Для расчета молекулярной массы полимеров используется уравнение Дебая:
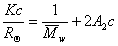
где с – весовая концентрация, г/см 3 ; K – оптическая постоянная, зависящая от коэффициента преломления среды (n0), концентрационного инкремента коэффициента преломления раствора (dn/dc) и длины волны света l,
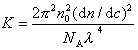
Таким образом для определения молекулярной массы следует измерять угловое рассеяние света, коэффициент преломления среды. Особенно тщательно следует определять (dn/dc), так как эта величина обычно чрезвычайно мала. Следует привлекать приборы, позволяющие определить коэффициент преломления с точностью до 6-го знака.
По аналогии с поглощением света можем записать для интенсивности рассеяния
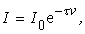
гдеt – мутность 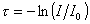
Мутность связана с коэффициентом рассеяния соотношением
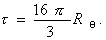
Поэтому, с учетом уравнения (2.5.19), можно проводить расчет молекулярной массы по уравнению
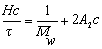
где Н – оптическая постоянная, Н = 16p K/3.
Для расчета молекулярной массы определяется величина
По углу наклона можно определить значение А2 и охарактеризовать взаимодействие компонентов раствора. Изменение температуры, замена растворителя могут вызвать изменение межмолекулярного взаимодействия компонентов раствора и формы макромолекул в растворе.
Молекулы могут приобретать и асимметрическую форму. В этом случае рассеяние света под разными углами к падающему лучу будет неравномерным и найденное значение молекулярной массы содержит погрешность. Поэтому необходимо вводить поправку на внутреннюю интерференцию света, появляющуюся в результате рассеяния света с некоторой разностью фаз от различных участков молекул. Для введения поправок существуют два основных метода: метод Дебая и метод Зимма.
Метод Дебая основан на измерении интенсивности рассеянного света при значении углов рассеяния, равных 135 и 45 o , соответственно R45 и R135. Отношение интенсивности равно отношению поправок Р и называется коэффициентом асимметрии
Величина z зависит от концентрации раствора, так как форма макромолекул в растворе может изменяться с увеличением концентрации. Для определения истинного значения z строят зависимость 1/(z-1)=fс и определяют 1/([z]-1) = limс®0 1/(z-1).
Зная z,по существующим таблицам находят величину Р, которую вводят в расчетное уравнение
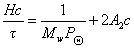
Метод Зимма основан на построении специальной диаграммы, на которой по оси абсцисс откладывается и концентрация, и угол рассеяния света. Линии на диаграмме образуют два семейства параллельных (практически прямых) линий. Более крутые линии представляют собой зависимость рассеяния света от концентрации растворов. Более пологие – зависимость рассеяния света от угла определения. Нижняя линия соответствует рассеянию света при с = 0, крайняя левая — дает совокупность точек при sin Q/2 =0. Обе прямые пересекаются с осью ординат в точке, характеризующей 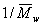
Для определения молекулярной массы полимеров можно измерять коэффициент диффузии растворенного вещества. Если представить, что макромолекулы имеют узкое распределение по молекулярной массе и каждая молекула не взаимодействует с другими молекулами полимера, то для молекулы, перемещающейся вдали от стенки сосуда, сила трения со средой может быть описана выражением
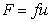
где F- сила трения; u – скорость перемещения молекулы; f =6ph0r- коэффициент трения сферических частиц; h0 – вязкость растворителя; r – радиус макромолекулы в растворе.
Уравнение (2.5.26) справедливо при скорости перемещения макромолекул 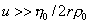
Предполагая применимость уравнения Эйнштейна для диффузии полимерных молекул в растворе, запишем
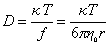
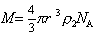
Сочетание (2.5.27) и (2.5.28) дает
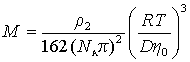
Cущественную ошибку может внести в расчет использование в качестве r2 значения плотности полимера, так как в растворе плотность макромолекул может значительно отличаться от плотности “сухого” полимера. Поэтому следует использовать значение 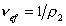
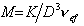
где vef— это тот удельный объём, который занимают макромолекулы в растворе, см 3 /г, учитывающий взаимодействие макромолекул в растворителе.
Вискозиметрический метод определенияvef и 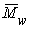
Существуют несколько уравнений, связывающих вязкость растворов полимеров с их концентрацией. Уравнение Симха для сферических частиц связывает удельную вязкость с объёмной концентрацией полимера:
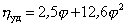
где j – объёмная доля, занимаемая полимером, 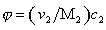
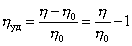
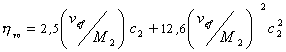
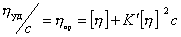
где 
Уравнение (2.5.33) носит название уравнения Хаггинса, K’ – постоянная Хаггинса, характеризующая форму макромолекул в растворе. Для сферических макромолекул K’ = 2, для эллипсоид-
ных K’ = 2¸10; для игольчатых форм K’ 2 x – ускорение центробежного поля, w – угловая скорость вращения; x – расстояние от молекулы до центра вращения; mh – масса одной сольватированной молекулы; vh – объем одной молекулы, r0 — плотность растворителя, vhr0 – поправка на выталкивающую силу.
Масса одной сольватированной молекулы, в соответствии с концепцией сольватированной частицы Онслея, определяется как
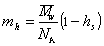
Объем одной сольватированной макромолекулы
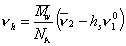
где v2— парциальный удельный объем макромолекул, см 3 /г; hsv1 0 — поправка на объем связанного растворителя; v1 0 = 1/r0 – — удельный объем растворителя, см 3 /г.
С учетом (2.5.36) и (2.5.37) запишем уравнение (2.5.35) в виде
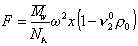
Можно видеть, что величина сольватации hs исключается из расчетного уравнения. Сила трения, уравновешивающая центробежную силу в стационарном режиме,
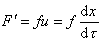
Из условия стационарности F= F’, следовательно,
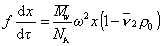
Для перехода от дифференциальной формы уравнения к интегральной Сведберг предложил использовать понятие постоянной седиментации
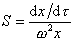
характеризующей скорость осаждения макромолекул под действием единицы центробежного поля. Эта постоянная зависит только от свойств макромолекул.
Коэффициент трения может быть определен из измерения коэффициента диффузии по уравнению Эйнштейна
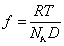

Уравнение (2.5.42) носит название уравнения Сведберга. Коэффициент диффузии D и коэффициент седиментации s определяются независимо. Для исключения эффекта взаимодействия макромолекул значение s экстраполируют к бесконечно малой концентрации и в расчетах используют значение s0.
Метод седиментации позволяет наиболее точно определить значение молекулярной массы полимера, так как здесь не надо определять или предполагать форму макромолекул, а величина сольватации исключается из расчетного уравнения. Экспериментально установлено, что
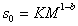
гдеK и b – постоянные, для многих полимеров приведенные в таблицах. Поэтому после калибровки постоянных уравнение (2.5.43) можно использовать для определения молекулярной массы без привлечения диффузионных измерений.
Определение средней молекулярной массы методом
По этому методу не проводят осаждения полимера, а ведут процесс только до установления равновесия между седиментацией и диффузией.
Для седиментационного потока
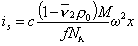
Для диффузионного потока
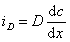
При седиментационно-диффузионном равновесии iD= is, следовательно,
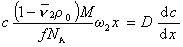
После преобразования с учетом D = kT/f и kNА=R получаем
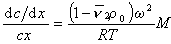
Откуда после интегрирования
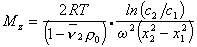
Таким образом достаточно определить значения концентрации раствора в двух точках кюветы чтобы рассчитать значение Mz . Этот метод носит название метода Арчибальда. Можно проводить расчет и по неустановившемуся равновесию, что значительно сокращает время эксперимента, но усложняет расчет.
Кроме определения молекулярной массы метод седиментационного ультрацентрифугирования в сочетании с вискозиметрией позволяет охарактеризовать форму макромолекул в растворе, определяя фактор Шераги — Манделькерна b, который для сферических частиц равен b = 2,12×10 6 .
Расчет проводится по формуле
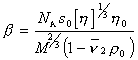
где s0 – коэффициент седиментации, экстраполированный к бесконечному разбавлению; [h] – характеристическая вязкость;h0 – вязкость растворителя.
Осмотическое давление и вязкость растворов полимеров
Наличие в растворах высокомолекулярных соединений вытянутых гибких макромолекул влияет на такие свойства растворов, как осмотическое давление и вязкость.
Осмотическое давление растворов низкомолекулярных веществ подчиняется закону Вант-Гоффа, который может быть записан в такой форме:
где 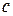
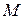
Уравнение для осмотического давления растворов высокомолекулярных соединений содержит дополнительный член, учитывающий взаимодействие гибких макромолекул в растворе друг с другом и с растворителем:
где 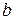
Разделив правую и левую часть уравнения на 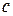
Графическая зависимость величины 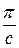
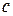
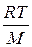
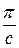
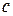
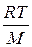
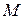
По вязкости растворы высокомолекулярных веществ резко отличаются от растворов низкомолекулярных веществ и золей. При одной и той же концентрации вязкость растворов полимеров значительно больше вязкости растворов низкомолекулярных веществ, и, с увеличением концентрации, она быстро возрастает (рис. 8.3).
Рис. 8.2. Зависимость 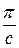
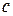
Рис. 8.3. Зависимость вязкости раствора от его
1 — для раствора низкомолекулярного вещества;
2 — для золя; 3 — для раствора полимера.
Такая высокая вязкость растворов высокомолекулярных соединений, даже при низкой концентрации, объясняется наличием в системе длинных гибких макромолекул. Вязкость жидкости можно определить как сопротивление жидкости передвижению одного ее слоя относительно другого. Громадные, вытянутые и гибкие макромолекулы увеличивают силу трения между слоями, т.е. увеличивают вязкость.
Для характеристики вязкости очень разбавленных растворов полимеров, в которых макромолекулы не взаимодействуют друг с другом, Штаудингером предложено следующее уравнение:
где 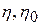
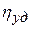
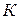
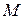
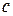
Согласно уравнению Штаудингера вязкость раствора прямо пропорциональна молекулярной массе растворенного полимера и концентрации раствора. На этой зависимости основан один из методов определения молекулярной массы полимеров.
Вязкость раствора полимера зависит от природы растворителя.
Чем лучше полимер растворяется в данном растворителе, тем более вытянуты макромолекулы и тем больше вязкость раствора.
С увеличением концентрации вязкость растворов полимеров возрастает непропорционально, и течение концентрированных растворов уже не подчиняется законам Ньютона и Пуазейля. Это проявляется в том, что вязкость этих растворов не является постоянной, а уменьшается с увеличением скорости течения растворов.
При увеличении скорости течения разбавленных растворов полимеров гибкие макромолекулы распрямляются и ориентируются по направлению течения. В результате снижается гидродинамическое сопротивление движущейся жидкости и уменьшается вязкость раствора.
В растворах достаточно высокой концентрации появляются ассоциаты макромолекул, также имеющие вытянутую форму. Эти ассоциаты и макромолекулы, взаимодействуя друг с другом, могут образовывать пространственные структуры, затрудняющие течение. При увеличении скорости течения эти структуры разрушаются и вязкость растворов полимеров снижается. Разрушение сравнительно непрочных полимерных структур можно вызвать и чисто механическим путем – встряхиванием, перемешиванием.
Увеличение концентрации полимера в растворе может привести к образованию настолько прочной структуры, что раствор потеряет текучесть, т. е. превратится в студень.
Повышение температуры увеличивает интенсивность молекулярного движения, препятствует образованию ассоциатов и структур и, следовательно, снижает вязкость растворов полимеров.
http://xumuk.ru/colloidchem/154.html
http://helpiks.org/4-59199.html