Первый закон термодинамики, закон Гесса
Первый закон термодинамики, закон Гесса
Первый закон (начало) термодинамики – это закон сохранения и превращения энергии (ЗСПЭ) в применении к тепловым процессам, т. е. процессам, связанным с превращением теплоты в работу. ЗСПЭ, открытый Лейбницем и Ломоносовым – это универсальный закон природы, применимый к явлениям в макросистемах и системах с малым числом молекул. Первоначально был установлен в механике, затем распространен в теории электричества.
Пусть к закрытой термодинамической системе подведено некоторое количество теплоты Q, которая идет на увеличение внутренней энергии U и на совершение системой работы расширения А. Тогда первый закон может формулироваться так: в любом термодинамическом процессе приращение внутренней энергии системы ΔU = U2 – U1 равно количеству сообщаемой системе теплоты минус количество работы А, совершаемой системой:
Изменение внутренней энергии ΔU не зависит от пути проведения процесса, а определяется только начальным и конечным состоянием системы.
Внутренняя энергия – это функция состояния, т. к. она удовлетворяет двум условиям:
В отличие от внутренней энергии теплота и работа не являются функциями состояния системы, поскольку они зависят от пути проведения процесса. Математическая запись первого закона термодинамики в дифференциальной форме для элементарного процесса имеет вид:
Другие формулировки первого закона термодинамики гласят:
1. В любой изолированной термодинамической системе общее количество энергии постоянно. Для изолированных термодинамических систем δQ = 0 и δA = 0, тогда dU = 0 и U = const, т. е. внутренняя энергия в изолированной системе величина постоянная.
2. Разные формы энергии переходят друг в друга в строго эквивалентных количествах.
3. Вечный двигатель первого рода невозможен.
Первый закон термодинамики был сформулирован в середине XIX в. Р. Майером и независимо от него Д. Джоулем. Гельмгольц включил в уравнение наряду с механической другие виды работ. Если в термодинамической системе имеет место только работа расширения, тогда
Математическое выражение первого закона термодинамики в дифференциальной форме иногда представляют так:
Последнее выражение включает A′ – «полезную» работу, т. е. все виды работы, не связанные с изменением объема. Например, «полезная» работа за счет электрических сил, химических превращений и т. д.
Для открытых термодинамических систем математическое выражение первого закона имеет вид
где Em – энергия, связанная с изменением массы термодинамической системы.
Закон Гесса и его сущность
Тепловым эффектом химической реакции называется теплота, выделяемая (поглощаемая) в результате реакции при соблюдении определенных условий:
1. Давление или объем постоянны (р = const или V = const)
2. Не совершается никакой работы, кроме работы расширения (А’ = 0)
3. Температуры исходных веществ и продуктов реакции одинаковы (Т1 = Т2)
В основе термохимии лежит закон Гесса (закон постоянства сумм теплот реакций), открытый русским ученым, академиком Гессом, на основе анализа экспериментальных данных, в 1836-1840 гг. Закон Гесса гласит:
тепловой эффект химической реакции не зависит от пути и числа промежуточных стадий, а определяется лишь природой и состоянием исходных веществ и конечных продуктов.
Закон Гесса является следствием первого закона термодинамики в применении к химическим процессам при соблюдении первых двух вышеуказанных условий. Третье условие введено для удобства сопоставления тепловых эффектов.
Закон Гесса удобно иллюстрировать термохимическими схемами с использованием замкнутых циклов.
Процесс получения СО2 (из С и О2) можно изобразить схемой
Рис. 2.1 Схема возможных путей образования СО2
С1О2 
С1О2 









Следствия из закона Гесса, их роль в термохимических расчетах
Из закона Гесса вытекает несколько следствий. Следствие первое, позволяющее определить ΔН любых химических реакций через теплоты образования. Теплота образования − это тепловой эффект реакции образования 1 моля сложного вещества из простых веществ. Могут быть со знаком плюс и минус, для простых веществ равны нулю.
В термохимии для каждого элемента в качестве стандартного выбирается состояние простого вещества, устойчивого при стандартных условиях, теплота образования которого условно принимается за нуль (например газы Н2, О2, N2, графит и ромбическая S, белое олово и др.). Теплота образования ΔНº298 при стандартных условиях имеет размерность кДж/моль, ккал/моль.
Согласно первому следствию из закона Гесса: тепловой эффект любой химической реакции равен разности между суммами теплот образования конечных и исходных веществ, умноженных на соответствующие стехиометрические коэффициенты в уравнении реакции.
В общем случае для любой химической реакции при р = const (изобарный процесс)
Во многих случаях теплоту образования экспериментально определить нельзя. Тогда её рассчитывают по тепловым эффектам других термохимических реакций.
Теплота сгорания – это тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов или это количество теплоты, которое выделяется при полном сгорании одного моля вещества в потоке кислорода.
За нуль принимаются теплоты сгорания кислорода и продуктов сгорания в их устойчивом состоянии при стандартных условиях, т. е. считают нулевой энергию сгорания газообразных веществ О2, N2, CO2, SO2, H2O(ж) и др. негорючих веществ.
Согласно второму следствию из закона Гесса: тепловой эффект любой химической реакции равен разности между суммами теплот сгорания исходных веществ и конечных продуктов, умноженных на соответствующие стехиометрические коэффициенты.
Особенно большое значение теплоты сгорания имеют для определения тепловых эффектов химических реакций, в которых участвуют органические соединения. Теплота сгорания пищевых продуктов в живом организме является источником энергии, за счет которых осуществляются жизнедеятельность. Химические превращения пищевых веществ в организме, как и химические реакции вне организма, подчиняются одним и тем же термохимическим законам. Например, при сжигании одного моля глюкозы в калометрической бомбе выделяется ≈673 ккал тепла, причем точно такое же количество тепла освобождает организм человека при окислении одного моля глюкозы.
Другие следствия из закона Гесса:
3) Тепловой эффект химического соединения равен и противоположен по знаку тепловому эффекту его образования (Закон Лавуазье-Лапласа). Следствие – тепловой эффект кругового процесса должен быть равен 0
4) Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между их тепловыми эффектами представляет тепловой эффект перехода из одного начального состояния в другое.
С(гр.) + О2 → СО2 + 393,51 кДж
С(ал.) + О2 → СО2 + 395,34 кДж
С(гр.) → С(ал.) = – 1,83 кДж
5) Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между их тепловыми эффектами представляет процесс перехода из одного конечного состояния в другие.
Н2 + ½ О2 = Н2О (г) + 241,83 кДж (1)
Н2 + ½ О2 = Н2О (ж) + 285,84 кДж (2)
Н2 + ½ О2 = Н2О (т) + 291,67 кДж (3)
(3) – (2) Н2О (т) = Н2О (ж) – 5,83 кДж
(2) – (1) Н2О (ж) = Н2О (г) – 44,01 кДж
(3) – (1) Н2О (т) = Н2О (г) – 49,84 кДж
1 Горшков, химия / В. И Горшков, И. А Кузнецов. – М.: МГУ, 1986.
2 Кнорре, химия / Д. Г Кнорре, Л. Ф Крылова, . – М.:Высшая школа, 1990.
3 Малахова, и коллоидная химия / А. Я Малахова. – Мн.: Вышэйшая школа, 1981.
4 Никольский, и коллоидная химия / Б. П Никольский. – Л.: Химия, 1987, 879 с.
5 Хмельницкий, и коллоидная химия / Р. А Хмельницкий. – М.: Высшая школа, 1988.
6 Чанг, Р. Физическая химия с приложениями к биологическим системам / Р. Чанг. – М.: Мир, 1980.
7 Балезин, физической и коллоидной химии / С. А Балезин, Б. В Ерофеев, Н. И Подобаев. – М: Просвещение, 1975.
8 Уильяме, В. Физическая химия для биологов / В. Уильяме, Х. Уильяме. – М: Мир, 1976.
9 Карапетьянц, в теорию химического процесса /
М. Х Карапетьянц. – М: Высшая школа, 1983, 231 с.
10 Шершавина, А. X. Физическая и коллоидная химия / А. Х Шер-
шавина. – Мн.: Университетское, 1995.
11 Киреев, физической химии / В. А Киреев. – М.:
Химия, 1975, 775 с.
12 Стромберг, химия / А. Г Стромберг, Д. П Семченко. – М.: Высшая школа, 1975, 775 с.
Первый закон термодинамики
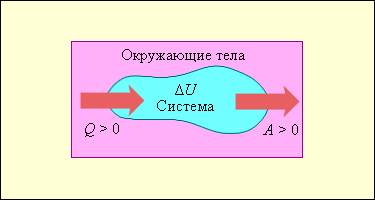
На рисунке 3 . 9 . 1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q > 0 , если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A > 0 .
Рисунок 3 . 9 . 1 . Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы Δ U .
Определение 1 -го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q , переданной системе, и работой A , совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В изохорном процессе, то есть в условиях неизменного объема ( V = c o n s t ) , газ не совершает работы, A = 0 .
В этом случае справедливой будет формула внутренней энергии газа:
Q = ∆ U = U ( T 2 ) — U ( T 1 ) .
В данном выражении U ( T 1 ) и U ( T 2 ) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло ( Q > 0 ) , чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам ( Q 0 ) .
В изобарном процессе, предполагающем постоянность значения давления ( p = c o n s t ) , работа, совершаемая газом, выражается в виде соотношения:
A = p ( V 2 — V 1 ) = p ∆ V .
Первый закон термодинамики для изобарного процесса дает:
Q = U ( T 2 ) — U ( T 1 ) + p ( V 2 — V 1 ) = ∆ U + p ∆ V .
При изобарном расширении Q > 0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q 0 тепло переходит внешним телам. В таком случае A 0 . При изобарном сжатии уменьшаются температура газа T 2 T 1 и значение внутренней энергии Δ U 0 .
В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0 .
Первый закон термодинамики для изотермического процесса выражается соотношением
Теплота Q , приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Рисунок 3 . 9 . 2 . Модель адиабатического процесса.
В адиабатическом процессе Q = 0 . По данной причине первый закон термодинамики принимает вид:
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
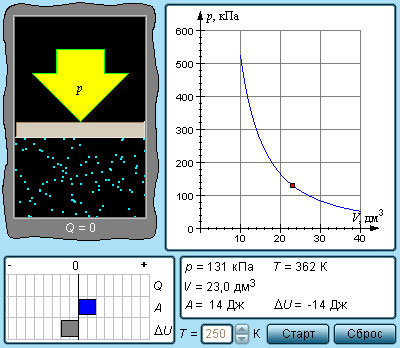
Расширение или сжатие газа на плоскости p , V проиллюстрирована кривой, называемой адиабатой.
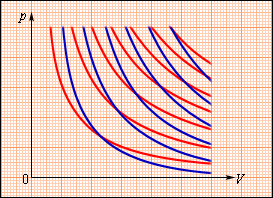
В процессе адиабатического расширения газом совершается положительная работа A > 0 , что является причиной понижения значения внутренней энергии Δ U 0 . Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3 . 9 . 3 ).
Рисунок 3 . 9 . 3 . Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
В условиях координат ( p , V ) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
p V γ = c o n s t .
Данное выражение, в котором γ = C p C V – показатель адиабаты, C p и C V – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ = 5 3 = 1 , 67 , двухатомного γ = 7 5 = 1 , 4 , многоатомного γ = 1 , 33 .
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
A = C V ( T 2 — T 1 )
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу Δ Q T . Так как на каждом участке адиабатического процесса Δ Q = 0 , энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
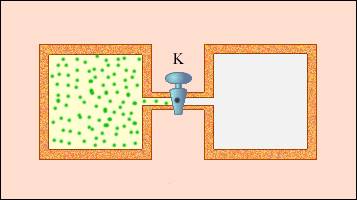
Примером неквазистатического процесса, в котором промежуточные состояния не находятся в состоянии равновесия, служит расширение газа в пустоту. На рисунке 3 . 9 . 3 иллюстрируется жесткая адиабатическая оболочка, состоящая из двух разделенных вентилем K сообщающихся емкостей. В изначальном состоянии газом заполнен один из сосудов, в это же время во втором находится лишь вакуум. Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
В таком процессе Q = 0 , по той причине, что исключен теплообмен с окружающими телами, и A = 0 , так как оболочка недеформируема. Первый закон термодинамики позволяет сказать, что Δ U = 0 , то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости ( p , V ) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Рисунок 3 . 9 . 4 . Расширение газа в пустоту.
Первый закон термодинамики.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

где A’ — работа, совершаемая системой (A’ = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Действительно, если к телу не поступает теплота (Q — 0), то работа A’, согласно уравнению 
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Применение первого закона термодинамики к различным процессам .
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики 
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
http://zaochnik.com/spravochnik/fizika/termodinamika/pervyj-zakon-termodinamiki/
http://www.calc.ru/Perviy-Zakon-Termodinamiki.html