Уравнение первого закона термодинамики для открытых систем
Внутренняя энергия – не единственный вид энергии, которым может обладать термодинамическая система. Рассмотрим небольшой объем жидкости, движущейся вместе с окружающим ее потоком. Такая жидкая частица обладает кинетической энергией, потенциальной энергией в поле сил тяжести и, наконец, внутренней энергией. Сумма этих трех энергий есть полная энергия системы. Из сказанного ясно, что к внутренней энергии относится та часть полной энергии термодинамической системы, которая не связана с движением системы как целого и с положением системы в поле сил тяжести.
В этой связи открытые системы имеют ряд особенностей, отличающих их от закрытых систем.
1. В общем балансе энергии дополнительно к изменению внутренней энергии необходимо учитывать изменение кинетической энергии, которой обладает рабочее тело, двигающееся относительно границ системы.
2. При вводе рабочего тела необходимо преодолевать действие внутреннего давления в системе, то есть совершать работу проталкивания.
3. Рабочее тело, находясь в пределах системы, может производить работу, не связанную с деформацией системы, то есть с изменением ее объема. Это работа, например, совершаемая газом при вращении ротора турбины. Работа рабочего тела в проточной системе, не связанная с деформацией границ, называется технической работой Lт.
4. В некоторых случаях может играть существенную роль изменение потенциальной энергии рабочего тела в поле внешних сил.
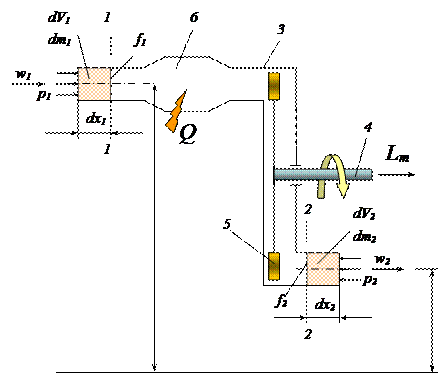
Для учета особенностей открытых термодинамических систем в уравнении первого закона термодинамики рассмотрим схему такой системы (рис. 2.7). Границы системы образованы сечением 1-1 (вход рабочего тела в систему), сечением 2-2 (выход рабочего тела), жесткими стенками 3 и сечением 4 вращающегося вала. Вал передает в окружающую среду (потребителю) техническую работу Lт, совершаемую в системе при взаимодействии потока рабочего тела с лопатками 5 ротора турбины. Рабочее тело может получать некоторое количество теплоты Q, например, за счет сжигания топлива в камере сгорания 6. Потенциальная энергия рабочего тела при его движении изменяется, так как центры тяжести входного и выходного сечений расположены на разной высоте.
Рис. 2.7. Схема открытой термодинамической системы.
Изменение энергии системы за малый промежуток времени dt составит:
где dE – изменение полной энергии системы;
dEп – количество энергии, поступающей в систему из окружающей среды;
dЕр – количество энергии, отдаваемой системой в окружающую среду.
За рассматриваемый промежуток времени в систему через сечение 1-1 со скоростью w1 входит рабочее тело массой dm1, обладающее удельной внутренней энергией u1, и вносит в систему: собственную внутреннюю энергию u1dm1, кинетическую энергию dm1w1 2 /2, потенциальную энергию gz1dm1.
При вводе рабочего тела силы внешнего давления р1 совершают над системой работу ввода dLвв. Давление р1, действуя на сечение площадью f1, создает силу р1f1, точка приложения которой перемещается на расстояние dx1, необходимое для того, чтобы элементарная масса dm1 оказалась введенной в систему через сечение 1-1. Таким образом, работа ввода равна:
Кроме того, находясь в системе, рабочее тело за время dt получит количество теплоты dQ.
В итоге количество энергии, поступающей в систему, выразится суммой:
Аналогично определяется и расход энергии, но с некоторыми отличиями:
— во-первых, будет совершаться не работа ввода, а работа вывода р2dV2;
— во-вторых, место подведенной теплоты займет отводимая техническая работа;
— в-третьих, одновременно с совершением технической работы dLт, может совершаться работа расширения dL = рdV, связанная со смещением границ системы.
Тогда изменение полной энергии системы будет равно:
Если осуществляется стационарный процесс, то поступление массы рабочего тела и энергии в систему равно их расходу, а объем системы постоянен.
При этих условиях деление всех членов уравнения на dm дает удельные величины, отнесенные к 1 кг рабочего тела, прошедшего через систему:
Перепишем это уравнение иначе:
Сумма внутренней энергии и произведения давления на объем рабочего тела, называется энтальпией h:
Так как эта сумма выражена через параметры состояния, то энтальпия также является функцией состояния. Физический смысл энтальпии рассматривается при анализе конкретных явлений.
Тогда, уравнение первого закона термодинамики для конечного изменения состояния рабочего тела в проточной термодинамической системе (интегральная форма) можно представить в виде:
где Dh = h2 – h1 – изменение удельной энтальпии рабочего тела (РТ);
D(w 2 /2) = w2 2 /2 – w1 2 /2 – изменение удельной кинетической энергии РТ;
D(gz) = gz2 – gz1 – изменение удельной потенциальной энергии РТ.
Для бесконечно малого изменения состояния РТ в элементарном процессе первый закон термодинамики в проточной термодинамической системе (дифференциальная форма) имеет вид:
Техническая работа lт, изменение кинетической энергии D(w 2 /2) и изменение потенциальной энергии D(gz) представляют собой величины механической природы. В пределах термодинамической системы эти количества могут претерпевать взаимное преобразование. Так, например, техническая работа в турбине может совершаться за счет уменьшения кинетической энергии потока или уменьшения его потенциальной энергии (при падении с верхнего уровня на нижний). В связи с этим: сумма технической работы, изменения кинетической энергии и изменения потенциальной энергии называется располагаемой работой lо:
Тогда уравнения первого закона термодинамики для стационарной проточной системы могут быть записаны в виде:
Для равновесных термодинамических процессов указанные выражения можно выразить через изменение параметров состояния рабочего тела в процессе. Но в начале установим, как рассчитывается располагаемая работа. Продифференцируем выражение энтальпии:
Изменение внутренней энергии заменим уравнением первого закона термодинамики для закрытых систем: du = dq – dl = dq – рdu. А дифференциал d(рu) представляет собой дифференциал сложной функции: d(рu) = рdu + udр. Тогда,
Заменив левую часть полученного выражения уравнением первого закона термодинамики для открытой системы, получим выражение для расчета располагаемой работы:
Следовательно, элементарная располагаемая работа определяется произведением объема на изменение давления, взятым с обратным знаком.
В конечном процессе располагаемая работа находится интегрированием от начального 1 до конечного 2 состояния рабочего тела в процессе:
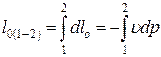
Таким образом, уравнения первого закона термодинамики для проточной системы могут быть записаны так:
Dh = q – lо Þ 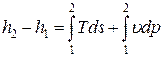
Тема: «ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ»(2 часа)
1. Общие положения второго закона термодинамика.
2. Прямой термодинамический цикл.
3. Обратный термодинамический цикл.
4. Формулировки второго закона термодинамики.
Основная литература
1. Амерханов Р.А., Драганов Б.Х. Теплотехника. — М.: Энергоатомиздат, 2006. – 432 с.
Дополнительная литература
1. Теплотехника. /А.П. Баскаков, Б.В. Берг и др. – М.: Энергатомиздат, 1991. – 224 с.
2. Техническая термодинамика. / Кириллин В.А., Сычев В.В., Шейндлин А.Е. – М.: Издательский дом МЭИ, 2008. – 496 с.
Общие положения второго закона термодинамика
Первый закон термодинамики, закон сохранения и превращения энергии, дают количественную характеристику превращения энергии. Однако первый закон термодинамики не указывает направления процессов и не имеет в этом отношении ограничений. Так, первый закон термодинамики не делает различий между преобразованием работы в теплоту (l ® q) и теплоты в работу (q ® l). Хотя количественные соотношения при том и другом преобразовании одинаковы, между этими преобразованиями имеется существенное различие. Превращение работы в теплоту – положительное превращение энергии, идущее естественным путем. Превращение теплоты в работу – отрицательное превращение энергии, которое осуществляется при особых условиях. Вот об этих условиях и говорит второй закон термодинамики.
Прежде чем непосредственно перейти ко второму закону термодинамики остановимся на понятиях об обратимых и необратимых процессах.
Обратимыми называются процессы, в результате совершения которых в прямом и обратном направлениях термодинамическая система возвращается в исходное состояние. Следовательно, совокупность прямого и обратного процессов не вызывает в окружающей среде никаких изменений.
В случае обратимых процессов обратный процесс представляет собой, так называемое «зеркальное отображение» прямого процесса. Если, например, в прямом процессе к системе подводится какое-то количество теплоты, то в обратном процессе от системы отводится точно такое же количество теплоты. Если в прямом процессе система совершает работу над окружающей средой, то в обратном процессе окружающая среда производит над системой работу, равную по абсолютной величине работе в прямом процессе.
Необратимыми называются процессы, при проведении которых в прямом и затем в обратном направлении система не возвращается в исходное состояние. Из повседневной практики известно, что все естественные самопроизвольные процессы, происходящие в природе, являются необратимыми. Обратимых процессов в природе не существует.
Кроме того, опыт показывает, что реальные процессы имеют определенную направленность передачи энергии. Так известно, что непосредственная самопроизвольная передача энергии между двумя системами в виде работы происходит только тогда, когда давление в системах разное. И энергия передается от системы с большим давлением к системе с меньшим давлением и никогда наоборот. Аналогичная картина наблюдается и при передаче энергии в форме теплоты: теплота сама собой переходит только от тела с большей температурой к телу с меньшей температурой. Процессы эти являются неравновесными и тем больше, чем больше разность давлений или соответственно температур между взаимодействующими телами.
Таким образом, при непосредственном взаимодействии между телами с разными давлениями и температурами энергия передается только необратимо и обязательно в направлении меньшего давления (передача энергии в форме работы) и меньшей температуры (передача энергии в форме теплоты).
Вместе с тем, самопроизвольные процессы окружающей нас действительности идут в направлении перехода системы от менее вероятных состояний к состояниям более вероятным. Наиболее вероятным состоянием является такое, при котором изолированная система находится в полном равновесии. Полное равновесие означает отсутствие условий для протекания какого-либо процесса в системе. Отсутствие разности давлений, температур, т.е. все интенсивные свойства такой системы выравнены.
Можно утверждать и обратное, если в изолированной системе протекают процессы, приводящие систему от менее вероятных состояний к более вероятным, то такие процессы являются естественными, необратимыми.
В рассмотренных положениях заключается наиболее общая сущность второго закона термодинамики:
1. Не все процессы, не противоречащие первому закону термодинамики, протекают в действительности самопроизвольно с положительным превращением энергии. Есть процессы с отрицательным превращением энергии (q ® l), которые самопроизвольно идти не могут.
2. Все реальные процессы протекают в определенном направлении, задаваемом условиями равновесия. Все они идут в одном направлении – направлении достижения равновесия системы, как наиболее вероятного состояния.
3. Процессы идут до установления равновесия системы, т.е. до момента выравнивания интенсивных свойств системы (температуры, давлений).
Первый закон термодинамики. Как рассказать просто о сложном?
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях.
1. Определение первого закона термодинамики
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях. Собственно, именно с анализа принципов первых тепловых машин, паровых двигателей и их эффективности и зародилась термодинамика. Можно сказать, что этот раздел физики начинается с небольшой, но очень важно работы молодого французского физика Николя Сади Карно.
Самым важным законом, лежащим в основе термодинамики является первый закон или первое начало термодинамики. Чтобы понять суть этого закона, для начала, вспомним что называется внутренней энергией. ВНУТРЕННЯЯ ЭНЕРГИЯ тела — это энергия движения и взаимодействия частиц, из которых оно состоит. Нам хорошо известно, что внутреннюю энергию тела можно изменить, изменив температуру тела. А изменять температуру тела можно двумя способами:
- совершая работу (либо само тело совершает работу, либо над телом совершают работу внешние силы);
- осуществляя теплообмен — передачу внутренней энергии от одного тела к другому без совершения работы.
Нам, также известно, что работа, совершаемая газом, обозначается Аг, а количество переданной или полученной внутренней энергии при теплообмене называется количеством теплоты и обозначается Q. Внутреннюю энергию газа или любого тела принято обозначать буквой U, а её изменение, как и изменение любой физической величины, обозначается с дополнительным знаком Δ, то есть ΔU.
Сформулируем ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ для газа. Но, прежде всего, отметим, что когда газ получает некоторое количество теплоты от какого-либо тела, то его внутренняя энергия увеличивается, а когда газ совершает некоторую работу, то его внутренняя энергия уменьшается. Именно поэтому первый закон термодинамики имеет вид:
Так как работа газа и работа внешних сил над газом равны по модулю и противоположны по знаку, то первый закон термодинамики можно записать в виде:
Понять суть этого закона довольно просто, ведь изменить внутреннюю энергию газа можно двумя способами: либо заставить его совершить работу или совершить над ним работу, либо передать ему некоторое количество теплоты или отвести от него некоторое количество теплоты.
2. Первый закон термодинамики в процессах
Применительно к изопроцессам первый закон термодинамики может быть записан несколько иначе, учитывая особенности этих процессов. Рассмотрим три основных изопроцесса и покажем, как будет выглядеть формула первого закона термодинамики в каждом из них.
- Изотермический процесс — это процесс, происходящий при постоянной температуре. С учётом того, что количество газа также неизменно, становится ясно, что так как внутренняя энергия зависит от температуры и количества газа, то в этом процессе она не изменяется, то есть U = const, а значит ΔU = 0, тогда первый закон термодинамики будет иметь вид: Q = Aг.
- Изохорный процесс — это процесс, происходящий при постоянном объёме. То есть в этом процессе газ не расширяется и не сжимается, а значит не совершается работа ни газом, ни над газом, тогда Аг = 0 и первый закон термодинамики приобретает вид: ΔU = Q.
- Изобарный процесс — это процесс, при котором давление газа неизменно, но и температура, и объём изменяются, поэтому первый закон термодинамики имеет самый общий вид: ΔU = Q — Аг.
- Адиабатный процесс — это процесс, при котором теплообмен газа с окружающей средой отсутствует (либо газ находится в теплоизолированном сосуде, либо процесс его расширения или сжатия происходит очень быстро). То есть в таком процессе газ не получает и не отдаёт количества теплоты и Q = 0. Тогда первый закон термодинамики будет иметь вид: ΔU = —Аг.
3. Применение
Первое начало термодинамики (первый закон) имеет огромное значение в этой науке. Вообще понятие внутренней энергии вывело теоретическую физику 19 века на принципиально новый уровень. Появились такие понятия как термодинамическая система, термодинамическое равновесие, энтропия, энтальпия. Кроме того, появилась возможность количественного определения внутренней энергии и её изменения, что в итоге привело учёных к пониманию самой природы теплоты, как формы энергии.
Ну, а если говорить о применении первого закона термодинамики в каких-либо задачах, то для этого необходимо знать два важных факта. Во-первых, внутренняя энергия идеального одноатомного газа равна: 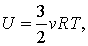
Первый закон термодинамики
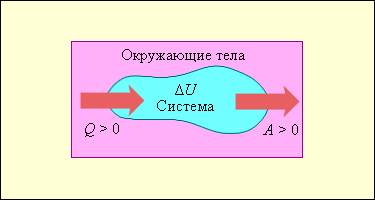
На рисунке 3 . 9 . 1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q > 0 , если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A > 0 .
Рисунок 3 . 9 . 1 . Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы Δ U .
Определение 1 -го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q , переданной системе, и работой A , совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В изохорном процессе, то есть в условиях неизменного объема ( V = c o n s t ) , газ не совершает работы, A = 0 .
В этом случае справедливой будет формула внутренней энергии газа:
Q = ∆ U = U ( T 2 ) — U ( T 1 ) .
В данном выражении U ( T 1 ) и U ( T 2 ) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло ( Q > 0 ) , чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам ( Q 0 ) .
В изобарном процессе, предполагающем постоянность значения давления ( p = c o n s t ) , работа, совершаемая газом, выражается в виде соотношения:
A = p ( V 2 — V 1 ) = p ∆ V .
Первый закон термодинамики для изобарного процесса дает:
Q = U ( T 2 ) — U ( T 1 ) + p ( V 2 — V 1 ) = ∆ U + p ∆ V .
При изобарном расширении Q > 0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q 0 тепло переходит внешним телам. В таком случае A 0 . При изобарном сжатии уменьшаются температура газа T 2 T 1 и значение внутренней энергии Δ U 0 .
В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0 .
Первый закон термодинамики для изотермического процесса выражается соотношением
Теплота Q , приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Рисунок 3 . 9 . 2 . Модель адиабатического процесса.
В адиабатическом процессе Q = 0 . По данной причине первый закон термодинамики принимает вид:
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
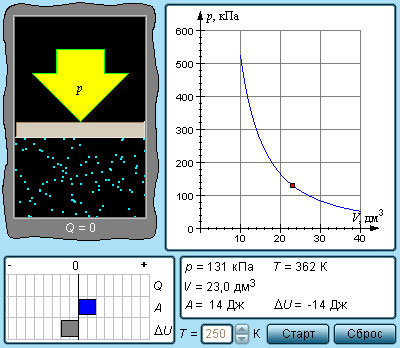
Расширение или сжатие газа на плоскости p , V проиллюстрирована кривой, называемой адиабатой.
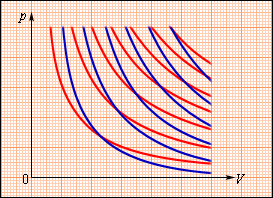
В процессе адиабатического расширения газом совершается положительная работа A > 0 , что является причиной понижения значения внутренней энергии Δ U 0 . Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3 . 9 . 3 ).
Рисунок 3 . 9 . 3 . Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
В условиях координат ( p , V ) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
p V γ = c o n s t .
Данное выражение, в котором γ = C p C V – показатель адиабаты, C p и C V – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ = 5 3 = 1 , 67 , двухатомного γ = 7 5 = 1 , 4 , многоатомного γ = 1 , 33 .
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
A = C V ( T 2 — T 1 )
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу Δ Q T . Так как на каждом участке адиабатического процесса Δ Q = 0 , энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
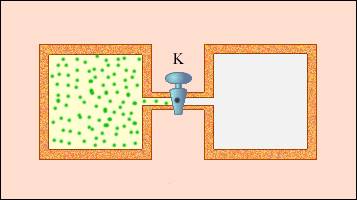
Примером неквазистатического процесса, в котором промежуточные состояния не находятся в состоянии равновесия, служит расширение газа в пустоту. На рисунке 3 . 9 . 3 иллюстрируется жесткая адиабатическая оболочка, состоящая из двух разделенных вентилем K сообщающихся емкостей. В изначальном состоянии газом заполнен один из сосудов, в это же время во втором находится лишь вакуум. Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
В таком процессе Q = 0 , по той причине, что исключен теплообмен с окружающими телами, и A = 0 , так как оболочка недеформируема. Первый закон термодинамики позволяет сказать, что Δ U = 0 , то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости ( p , V ) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Рисунок 3 . 9 . 4 . Расширение газа в пустоту.
http://rosuchebnik.ru/material/pervyy-zakon-termodinamiki/
http://zaochnik.com/spravochnik/fizika/termodinamika/pervyj-zakon-termodinamiki/