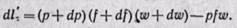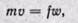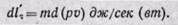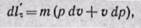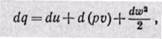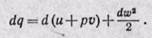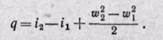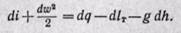Первый закон термодинамики
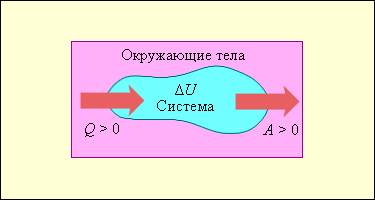
На рисунке 3 . 9 . 1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q > 0 , если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A > 0 .
Рисунок 3 . 9 . 1 . Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы Δ U .
Определение 1 -го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q , переданной системе, и работой A , совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В изохорном процессе, то есть в условиях неизменного объема ( V = c o n s t ) , газ не совершает работы, A = 0 .
В этом случае справедливой будет формула внутренней энергии газа:
Q = ∆ U = U ( T 2 ) — U ( T 1 ) .
В данном выражении U ( T 1 ) и U ( T 2 ) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло ( Q > 0 ) , чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам ( Q 0 ) .
В изобарном процессе, предполагающем постоянность значения давления ( p = c o n s t ) , работа, совершаемая газом, выражается в виде соотношения:
A = p ( V 2 — V 1 ) = p ∆ V .
Первый закон термодинамики для изобарного процесса дает:
Q = U ( T 2 ) — U ( T 1 ) + p ( V 2 — V 1 ) = ∆ U + p ∆ V .
При изобарном расширении Q > 0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q 0 тепло переходит внешним телам. В таком случае A 0 . При изобарном сжатии уменьшаются температура газа T 2 T 1 и значение внутренней энергии Δ U 0 .
В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0 .
Первый закон термодинамики для изотермического процесса выражается соотношением
Теплота Q , приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
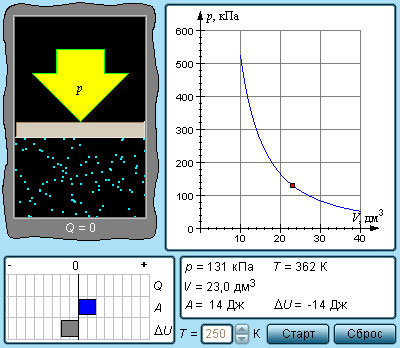
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
Рисунок 3 . 9 . 2 . Модель адиабатического процесса.
В адиабатическом процессе Q = 0 . По данной причине первый закон термодинамики принимает вид:
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Расширение или сжатие газа на плоскости p , V проиллюстрирована кривой, называемой адиабатой.
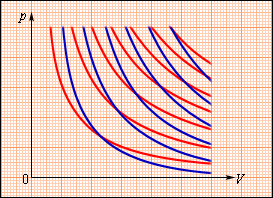
В процессе адиабатического расширения газом совершается положительная работа A > 0 , что является причиной понижения значения внутренней энергии Δ U 0 . Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3 . 9 . 3 ).
Рисунок 3 . 9 . 3 . Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
В условиях координат ( p , V ) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
p V γ = c o n s t .
Данное выражение, в котором γ = C p C V – показатель адиабаты, C p и C V – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ = 5 3 = 1 , 67 , двухатомного γ = 7 5 = 1 , 4 , многоатомного γ = 1 , 33 .
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
A = C V ( T 2 — T 1 )
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу Δ Q T . Так как на каждом участке адиабатического процесса Δ Q = 0 , энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
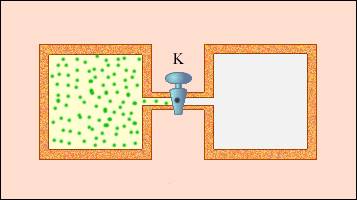
Примером неквазистатического процесса, в котором промежуточные состояния не находятся в состоянии равновесия, служит расширение газа в пустоту. На рисунке 3 . 9 . 3 иллюстрируется жесткая адиабатическая оболочка, состоящая из двух разделенных вентилем K сообщающихся емкостей. В изначальном состоянии газом заполнен один из сосудов, в это же время во втором находится лишь вакуум. Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
В таком процессе Q = 0 , по той причине, что исключен теплообмен с окружающими телами, и A = 0 , так как оболочка недеформируема. Первый закон термодинамики позволяет сказать, что Δ U = 0 , то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости ( p , V ) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Рисунок 3 . 9 . 4 . Расширение газа в пустоту.
Тема 5. Термодинамика потока
5.1. Первый закон термодинамики для потока
На практике при рассмотрении рабочих процессов машин, аппаратов и устройств, встречаются задачи изучении закономерностей движения рабочих тел (газов, пара и жидкостей).
Уравнение 1-го закона термодинамики для потока газа при следующих допущениях:
- движение газа по каналу установившееся и неразрывное;
- скорости по сечению, перпендикулярному оси канала, постоянны;
- пренебрегается трение частичек газа друг другу и о стенки канала;
- изменение параметров по сечению канала мало по сравнению их абсолютными значениями,
q = D u + D e + lпрот. + lтехн. , (5.1)
где D e = (w 2 2 – w 2 1)/2 + g·(z2 –z1) – изменение энергии системы,
состоящий из изменения кинетической и потенциальной энергий;
w1 ,w2 – скорости потока в начале и в конце канала;
z1 , z2 – высота положения начала и конца канала.
- lпрот. = P2· n 2 – P1· n 1– работа проталкивания, затрачиваемая на движения потока;
- lтехн. – техническая (полезная) работа (турбины, компрессора, насоса, вентилятора и т.д.).
Введем понятия энтальпии, который обозначим через величину:
Тогда уравнение 1-го закона термодинамики для потока газа будет иметь вид:
Первый закон термодинамики в применении к потоку движущегося газа
В технике имеется большая группа машин, в которых работа производится за счет внешней кинетической энергии рабочего тела: паровые турбины, газовые турбины, реактивные двигатели, ракеты и др.
В процессах изменения состояния движущегося с конечной скоростью газа теплота расходуется не только на изменение внутренней энергии и на совершение внешней работы (против внешних сил), но и на приращение внешней кинетической энергии газа при его перемещении по каналу. Поэтому уравнение первого закона термодинамики для 1 кг газа в дифференциальной форме получает следующий вид:
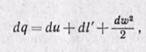
где dq — подведенная теплота от внешних источников тепла; du — изменение внутренней энергии газа; dl’ — работа против внешних сил, называемая работой проталкивания (она не равна работе расширения газа dl);

При выводе этого уравнения не учитывалось влияние гравитационных сил, а также считалось, что газом не совершается так называемая техническая работа (см. § 13-2).
Изменение кинетической энергии рабочего тела может происходить как в трубах постоянного сечения, так и в специальных каналах переменного сечения, называемых соплами и диффузорами.
Если при перемещении газа по каналу происходит его расширение с уменьшением давления и увеличением скорости, то такой канал называют соплом.
Если в канале происходит сжатие рабочего тела с увеличением его давления и уменьшением скорости, то такой канал называют диффузором.
§ 13-2. Работа проталкивания. Дальнейшее развитие уравнения первого закона термодинамики для потока
Определим величину работы против внешних сил, или работу проталкивания. При выводе уравнения принимают следующие условия истечения. Осуществляется неразрывность струи, т. е. через любое поперечное сечение канала в единицу времени протекает одинаковая масса рабочего тела:
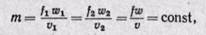
где f1, f2, . f— площади поперечного сечения канала; w1, w2, . w — скорости рабочего тела; v1, v2, . v — удельные объемы.
В каждом поперечном сечении канала скорость w, давление р, температура Т и другие параметры рабочего тела постоянны по сечению канала, т. е. имеют во всех точках плоскости, перпендикулярной к оси трубы, одинаковое значение (осредненные величины).
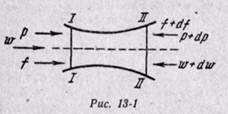 |
Рассматривается установившееся движение, называемое стационарным, т. е. не зависящим от времени. Величины v, w, ρ, Т могут меняться по длине канала, но в каждом сечении, к которому они относятся, не зависят от времени. Все величины являются функцией только координат.
Предположим, что по каналу переменного сечения перемещается газ (рис. 13-1). Выделим сечениями / — / и // — // элементарную массу газа. В сечение / — / действует сила pf, а в сечении II — // — сила (р + dp) (f + df), действующая противоположно силе в сечении / — /. Обе силы в сечениях / — / и // — // совершают работу; алгебраическая сумма этих работ будет работой, затраченной на проталкивание элементарной массы газа. Элементарную работу проталкивания газа на бесконечно малом пути между сечениями / — / и // — II за 1 сек находим из уравнения
Раскрывая скобки и отбрасывая бесконечно малые величины второго и высшего порядка, получаем
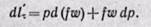
Из уравнения (а) определяем
где т — секундная масса газа, протекающего через любое сечение канала в постоянном количестве.
Заменяя величину fw в уравнении (б) на mv, получаем
Таким образом, элементарная работа проталкивания на единицу массы равна
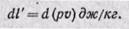
Уравнение первого закона термодинамики в дифференциальной форме для потока газа принимает вид
Величина в скобках (u + pv) является энтальпией, следовательно,
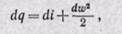
Уравнение (13-3) показывает, что подведенная теплота в процессе при течении газа (или жидкости) расходуется на изменение внутренней энергии, на работу проталкивания и на изменение внешней кинетической энергии рабочего тела, или подведенная теплота при течении газа расходуется на изменение его энтальпии и внешней кинетической энергии.
Когда 1 кг движущегося газа совершает полезную работу lт (техническую) над внешним объектом и в нем изменяется потенциальная энергия положения (пьезометрическая высота), то закон сохранения энергии приводит к следующему уравнению:
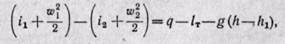
или в дифференциальной форме
Полученное уравнение справедливо как для обратимых, так и для необратимых (происходящих с трением) процессов. Действительно, при наличии трения должна затрачиваться работа трения lтр, которая полностью переходит в теплоту qтр. Вследствие равенства работы трения lтр и теплоты трения qтр обе эти величины, имеющие различный знак, взаимно сокращаются и выпадают из уравнения (13-4). Таким образом, в случае изоэнтропного (ds = 0) течения.
Дата добавления: 2015-04-15 ; просмотров: 2438 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://xumuk.ru/teplotehnika/017.html
http://helpiks.org/3-16554.html