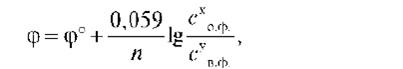Редокс-потенциалов. Уравнения Нернста-Петерса
Мерой окислительно-восстановительной способности веществ служат окислительно-восстановительные потенциалы. Рассмотрим механизм возникновения потенциала. При погружении химически активного металла (Zn, Al) в раствор его соли, например Zn в раствор ZnSO4, происходят дополнительное растворение металла в результате процесса окисления, образование пары, двойного электрического слоя на поверхности металла и возникновение потенциала пары Zn 2+ /Zn ° .
Металл, погруженный в раствор своей соли, например цинк в растворе сульфата цинка, называют электродом первого рода. Это двухфазный электрод, который заряжается отрицательно. Потенциал образуется в результате реакции окисления (рис. 5.1).
Рис. 5.1. Окисление цинка
При погружении в раствор своей соли малоактивных металлов (Cu) наблюдается противоположный процесс. На границе металла с раствором соли происходит осаждение металла в результате процесса восстановления иона, обладающего высокой акцепторной способностью к электрону, что обусловлено высоким зарядом ядра и малым радиусом иона. Электрод заряжается положительно, в приэлектродном пространстве избыточные анионы соли формируют второй слой, возникает электродный потенциал пары Cu 2+ /Cu ° . Потенциал образуется в результате процесса восстановления (рис. 5.2). Механизм, величина и знак электродного потенциала определяются строением атомов участников электродного процесса.
Рис. 5.2. Восстановление меди
Итак, потенциал, который возникает на границе раздела металла с раствором в результате окислительного и восстановительного процессов, протекающих с участием металла (электрода) и образованием двойного электрического слоя называют электродным потенциалом.
Если отводить электроны с цинковой пластины на медную, то равновесие на пластинках нарушается. Для этого соединим цинковую и медную пластины, погруженные в растворы их солей, металлическим проводником, приэлектродные растворы — электролитным мостиком (трубка с раствором K2SO4), чтобы замкнуть цепь. На цинковом электроде протекает полуреакция окисления: Zn 0 (т) — 2ē → Zn 2+ (р-р), а на медном — полуреакция восстановления: Cu 2+ (р-р) + 2ē → Cu 0 (т)
Электрический ток обусловлен суммарной окислительно-восстановительной реакцией:
Zn 0 (т) + Cu 2+ (р-р) → Zn 2+ (р-р) + Cu 0 (т)
Окислительно-восстановительные потенциалы пары зависят от природы участников электродного процесса и соотношения равновесных концентраций окисленной и восстановленной форм участников электродного процесса в растворе, температуры раствора и описываются уравнением Нернста.
Количественной характеристикой окислительно-восстановительной системы является редокс-потенциал, возникающий на границе раздела фаз платина — водный раствор. Величина потенциала в единицах СИ измеряется в вольтах (В) и рассчитывается по уравнению Нернста-Петерса:
где а(Oх) и a(Red) — активность окисленной и восстановленной форм соответственно; R — универсальная газовая постоянная; Т — термодинамическая температура, К; F — постоянная Фарадея (96500 Кл/моль); n — число электронов, принимающих участие в элементарном редокс-процессе; а — активность ионов гидроксония; m — стехиометрический коэффициент перед ионом водорода в полуреакции. Величина φ° — стандартный редокс-потенциал, т.е. потенциал, измеренный при условиях а(Oх) = a(Red) = a(H + ) = 1 и данной температуре.
Стандартный потенциал системы 2Н + /Н2 принят равным 0 В. Стандартные потенциалы являются справочными величинами, табулируются при температуре 298К. Сильнокислая среда не характерна для биологических систем, поэтому для характеристики процессов, протекающих в живых системах, чаще используют формальный потенциал, определяемый при условии а(Oх) = a(Red), pH 7,4 и температуре 310К (физиологический уровень). При записи потенциала пара указывается в виде дроби, причем окислитель записывается в числителе, а восстановитель в знаменателе.
Для 25°С (298К) после подстановки постоянных величин (R = 8,31 Дж/моль×град; F = 96500 Кл/моль) уравнение Нернста принимает следующий вид:
где φ°- стандартный окислительно-восстановительный потенциал пары, В; Со.ф. и Св.ф. — произведение равновесных концентраций окисленной и восстановленной форм соответственно; х и у — стехиометрические коэффициенты в уравнении полуреакций.
Редокс-системы делят на два типа:
1. в системе осуществляется только перенос электронов: Fe 3+ +ē = Fe 2+ , Sn 2+ — 2ē = Sn 4+ . Это изолированное окислительно-восстановительное равновесие;
2. системы, когда перенос электронов дополняется переносом протонов, т.е. наблюдается совмещенное равновесие разных типов: протолитическое (кислотно-основное) и окислительно-восстановительное с возможной конкуренцией двух частиц протонов и электронов. В биологических системах важные редокс-системы относятся к этому типу.
Примером системы второго типа является процесс утилизации перекиси водорода в организме: Н2О2 + 2Н + + 2ē ↔ 2Н2О, а также восстановление в кислой среде многих окислителей, содержащих кислород: CrО4 2- , Cr2О7 2- , MnО4 — . Например, MnО4 — + 8Н + + 5ē = = Mn 2+ + 4Н2О. В данной полуреакции участвуют электроны и протоны.
Итак, окислительно-восстановительный потенциал (ОВП) – это потенциал системы, в которой активности окислительной и восстановительной форм данного вещества равны единице. ОВП измеряется с помощью окислительно-восстановительных электродов в сочетании со стандартными электродами сравнения.
В каждой окислительно-восстановительной реакции есть своя редокс-пара – эта пара имеет вещество в окисленной и восстановленной форме (Fe +3 /Fe +2 ).
Количественной мерой активности редокс-пары является величина ее ОВП.
Уравнение петерса для окислительно восстановительных систем
4.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СИСТЕМЫ
Отличительным признаком окислительно-восстановительных (редокс-) реакций является перенос электронов между реагирующими частицами – ионами, атомами, молекулами, комплексами, в результате чего изменяется степень окисления реагирующих частиц, например,
Поскольку электроны не могут накапливаться в растворе, одновременно должны протекать два процесса – отдача и принятие электронов, т. е. процесс окисления одних и восстановления других частиц. Таким образом, любая окислительно-восстановительная реакция всегда может быть представлена в виде двух полуреакций
где Ox – окисленная форма, Red – восстановленная форма.
Исходная частица и продукт каждой полуреакции составляют сопряженную окислительно-восстановительную пару или систему. Иными словами, в вышеприведенных полуреакциях Red 1 является сопряженным с О x 1, а О x 2 сопряжен с Red 2.
В качестве доноров или акцепторов электронов могут выступать не только частицы, находящиеся в растворе, но и электроды. В этом случае окислительно-восстановительная реакция происходит на границе электрод-раствор и называется электрохимической.
Окислительно-восстановительные реакции, как и все динамические процессы, в той или иной мере обратимы. Направление реакций определяется соотношением электронодонорных свойств компонентов системы одной окислительно-восстановительной полуреакции и электроно-акцепторных свойств второй (при условии постоянства факторов, влияющих на смещение равновесных химических реакций). Перемещение электронов в ходе окислительно-восстановительных реакций приводит к возникновению потенциала. Таким образом, потенциал, измеряемый в вольтах, служит мерой окислительно-восстановительной способности соединения.
Стандартные потенциалы. Для количественной оценки окислительных (восстановительных) свойств системы в раствор погружают электрод из химически инертного (индифферентного) токопроводящего материала. На границе раздела фаз (электрод-раствор) происходит электронообразующий процесс, приводящий к возникновению потенциала, являющегося функцией активности ионов в растворе. Значение потенциала тем больше, чем выше окислительная способность окисленной формы.
Абсолютное значение потенциала системы измерить невозможно. Однако, если выбрать одну из окислительно-восстановительных систем в качестве стандартной, то относительно нее становится возможным измерение потенциала любой другой окислительно-восстановительной системы независимо от выбранного индифферентного электрода. В качестве стандартной выбирают систему 2Н + /Н2, потенциал которой [ при 
Стандартный водородный │Раствор окислительно- │ Pt
электрод восстановительной сис-
определяется составом раствора, содержащего данную окислительно-восстановительную пару.
Потенциал любой окислительно-восстановительной системы, измеренный в стандартных условиях относительно водородного электрода, называют стандартным потенциалом (Е ° ) этой системы.
Стандартный потенциал окислительно – восстановительной системы принято считать положительным, если она выступает в качестве окислителя, а на водородном электроде протекает полуреакция окисления
или отрицательным, если система играет роль восстановителя, а на водородном электроде происходит полуреакция восстановления
Значение стандартного потенциала характеризует «силу» окислителя или восстановителя.
Стандартный потенциал – термодинамическая стандартизованная величина – является очень важным физико-химическим и аналитическим параметром, позволяющим оценить направление соответствующей реакции и рассчитывать активности реагирующих частиц в условиях равновесия.
Реальные потенциалы. Использование стандартных потенциалов применительно к конкретным растворам окислительно-восстановительных систем часто встречает серьезные затруднения. Значение стандартного потенциала характеризует полуреакцию, участниками которой являют частицы одного «вида» без учета всех прочих возможных форм их существования в конкретных условиях (комплексы, полимерные частицы, ассоциаты и т.д.) и без учета межионного взаимодействия.
Для характеристики окислительно-восстановительной системы в конкретных условиях пользуются понятием реального (формального) потенциала Е. Для вычисления реального потенциала полуреакции аО x + n е — → bRed ,
где Е ° — стандартный потенциал, В; R — универсальная газовая постоянная, равная 8,314 Дж . моль -1. К -1 ; Т— абсолютная температура, К; n — число электронов, участвующих в полуреакции; F — постоянная Фарадея 9,6585 . 10 4 Кл × моль -1 ; а – активности окисленной и восстановленной форм.
После подстановки указанных величин ( Т =298 К) и замены натурального логарифма десятичным, а также при замене активностей концентрацями уравнение Нернста приводится к виду:
[ Ox 1 ] , [ Red 1 ] — концентрации Строго говоря, в этом уравнении должны фигурировать активные концентрации (активности). окисленной и восстановленной форм соответственно;
a , b –стехиометрические коэффициенты в уравнении рассматриваемой реакции.
Электрохимические методы исследования. Потенциометрия
Электрохимические методы исследования.
Биомедицинская значимость темы
Методы потенциометрии используются в клиническом анализе и в практике санитарно-гигиенических исследований. С помощью потенциометрических методов возможно определение концентрации физиологически активных ионов (H3O+, K+, Na+, Ca2+,
Изучение механизмов возникновения электродных и окислительно-восстановительных потенциалов (ОВ-потенциалов) позволяет разобраться в закономерностях многих биохимических процессов в организме, в частности, процессов биологического окисления и установить последовательность и энергетические значения ОВ-процессов. Метод регистрации биопотенциалов используется при исследовании деятельности различных органов, например, при диагностике сердечных заболеваний (электрокардиография). Регистрация биопотенциалов мозга (электроэнцефалограмма) в ряде случаев позволяет судить о патологических нарушениях центральной нервной системы. При изучении явлений возбуждения в мышцах и координации мышечной деятельности у спортсменов применяется метод последовательной регистрации ряда отдельных токов действия мышцы (электромиография). Наряду с этим в медицинской практике широко используют материалы, в частности, металлы при эндопротезировании костных тканей, зубов, при введении которых в организм на границе металл – раствор образуется скачок потенциала и развиваются электрохимические процессы.
Потенциометрическое титрование применяется для определения концентрации биологически активных и лекарственных веществ.
Равновесные электродные процессы
и электродвижущие силы
Электрод — это система, состоящая из проводника I рода, контактирующего с проводником II рода, например, металлическая пластинка, опущенная в раствор соли этого металла. В такой системе на границе металл-раствор (твердая фаза – жидкость) возникает двойной электрический слой, которому соответствует скачок потенциала, называемый электродным потенциалом.
Механизм возникновения электродного потенциала
Теоретической основой объяснения возникновения электродных потенциалов является сольватационная теория — . Согласно этой теории при погружении металлической пластинки в раствор собственной соли имеют место два основных процесса. Первый процесс – это ионизация металла пластинки, где в узлах кристаллической решетки находятся ионы – атомы:
Ионизация происходит под действием полярных молекул растворителя (воды). Образующиеся при этом электроны концентрируются на пластинке, заряжая ее отрицательно, а образующиеся катионы металла переходят с пластинки в раствор и концентрируются возле пластинки (рис.1).

При погружении пластинки металла в раствор вначале преобладает процесс ионизации металла:
но со временем скорость прямой реакции уменьшается, а растет скорость обратной реакции:
пока между этими процессами не установится динамическое равновесие:
Ме + mH2O ⇄ Меn+ × mH2O + nē
или упрощенно Ме ⇄ Меn+ + nē
При этом на границе металл – раствор (твердая фаза – жидкость) устанавливается равновесный двойной электрический слой (ДЭС), т. е. упорядоченное распределение противоположно заряженных частиц на границе раздела фаз (рис 1). ДЭС будет соответствовать скачок потенциала называемый электродным потенциалом. Потенциал, возникающий в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Абсолютное значение электродного потенциала экспериментально определить невозможно. Однако можно определить разность электродных потенциалов. Поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимают равным нулю. На величину электродного потенциала влияют природа металла и растворителя. Чем меньше активность металла, тем меньшее количество электронов образуется на пластинке и тем меньший отрицательный заряд возникает на ней. Например, отрицательный заряд медной пластинки в растворе своей соли будет меньше заряда цинковой пластинки, помещенной в раствор собственной соли. Поэтому по отношению к цинковой пластинке (более активный металл) заряд медной пластинки принято считать «положительным». Кроме природы металла электродный потенциал зависит от температуры, активности ионов металла в растворе, а также величины заряда иона металла в растворе. Например, потенциал железного электрода в растворе FeCl3 будет больше потенциала этого же электрода в растворе FeCl2.
Влияние всех перечисленных факторов на величину электродного потенциала металлического электрода выражается уравнением Нернста:
j 


где j0 Меn+/Ме – стандартный электродный потенциал, значение которого определяется природой металла и растворителя, R – универсальная газовая постоянная, равная 8,31 Дж/моль×К; Т – температура в Кельвинах; n – заряд ионов металла; F – число Фарадея, равное 96500 Кл/моль; ln – натуральный логарифм; аМеn+ – активность (концентрация) потенциалопределяющих ионов металла в растворе, моль/л.
Гальванические элементы
Гальванический элемент (химический источник тока) — это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из двух электродов (полуэлементов). Между растворами отдельных электродов устанавливается контакт с помощью электролитического мостика, заполненного насыщенным раствором KCl (солевой мостик) или с помощью мембраны. Они обеспечивают электрическую проводимость между растворами, но препятствуют их взаимной диффузии и являются вместе с электродами внутренней цепью гальванического элемента. Внешняя цепь гальванического элемента – это выводы электродов. По внешней цепи осуществляется переход электронов от одного металла к другому.
Различают гальванические элементы химические (биметаллические) и концентрационные.
Химические гальванические элементы состоят из двух металлов, опущенных в растворы своих солей.
Примером химического гальванического элемента может служить элемент Якоби-Даниэля (рис.2.).
Он состоит из медного электрода (т. е. медной пластинки, погруженной в раствор CuSO4) и цинкового электрода (цинковой пластинки, погруженной в раствор ZnSO4). На поверхности цинковой пластинки возникает ДЭС и устанавливается равновесие Zn ⇄ Zn2+ + 2ē. При этом возникает электродный потенциал цинка. Схема электрода будет иметь вид Zn|ZnSO4 или Zn|Zn2+, где вертикальная черта обозначает границу раздела фаз, на которой возникает ДЭС. Аналогично на медной пластинке также возникает ДЭС и устанавливается равновесие Cu ⇄ Cu2+ + 2ē. Поэтому возникает электродный потенциал меди. А схема электрода будет Cu|CuSO4 или Cu|Cu2+. Соединенные солевым мостиком (мембраной), но разомкнутые во внешней цепи оба электрода (гальванический элемент) могут находится сколько угодно времени не изменяясь. Но при замыкании внешней цепи начинают протекать термодинамически необратимые процессы. На Zn-электроде (как электрохимически более активном), протекает процесс окисления: Zn + 2ē ®Zn2+
Процессы окисления в электрохимии называются анодными процессами, а электроды, на которых идут процессы называются анодами.
На Cu-электроде (электрохимически менее активном) протекает процесс восстановления: Cu2+ + 2ē ®Cu.
Процессы восстановления в электрохимии называются катодными процессами, а электроды, на которых идут процессы восстановления, называются катодами.
При этом электроны, образующиеся на аноде, по внешней цепи двигаются к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммарное уравнение электрохимической реакции : Zn + Cu2+ ®Zn2+ + Cu
или Zn + CuSO4 ® ZnSO4 + Cu
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов по внутренней цепи элемента, т. е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
Схема химического гальванического элемента записывается по правилу «правого плюса». То есть электрод, являющийся катодом (+), пишется справа и его роль играет менее активный металл (в ряду напряжения металлов находящейся правее), Поэтому схема элемента Якоби–Даниэля будет иметь вид:
Двойная черта в схеме обозначает электролитический контакт между электродами, осуществляемый обычно посредством солевого мостика. Он препятствует смешиванию электролитов и обеспечивает протекание электрического тока по внутренней цепи элемента.
В гальваническом элементе между двумя электродами возникает электродвижущая сила, равная разности двух электродных потенциалов. Электродвижущая сила гальванического элемента — величина всегда положительная и рассчитывается по формуле (без учета диффузного потенциала):
Е = j катода – j анода, где j катода > j анода
Отсюда ЭДС медноцинкового гальванического элемента равна:
Е = j Cu2+/Cu – j Zn2+/Zn = j0Cu2+/Cu + 

Гальванический элемент служит источником тока до тех пор, пока весь цинковый электрод (анод) не растворится или не израсходуются из раствора катионы Сu2+, которые разряжаются на катоде.
Концентрационные гальванические элементы состоят из двух одинаковых электродов (например, серебряных), опущенных в растворы одного и того же электролита (например, AgNO3), но разных концентраций. Источником электрического тока в таком элементе служит работа переноса электролита из более концентрированного раствора в более разбавленный. Элемент работает до тех пор, пока сравняются концентрации катионов у анода и катода. Концентрационный гальванический элемент изображают схематически следующим образом:
⊝Ag½AgNO3(C1) ║AgNO3(C2) ½⊕Ag , где С2 > C1
Уравнение для вычисления ЭДС концентрационных гальванических элементов имеет вид: Е = j к – j а = j0Ag+/Ag + 

Е = 
Стандартные электродные потенциалы. Стандартный водородный электрод
Абсолютное значение электродного потенциала в настоящее время измерить или рассчитать невозможно. Но можно определить значение электродного потенциала относительно какого-либо электрода, выбранного в качестве стандарта. Согласно международному соглашению таким стандартом служит стандартный (нормальный) водородный электрод, потенциал которого условно принят за нуль:
j0 

Стандартный электродный потенциал представляет собой электродвижущую силу гальванического элемента, составленного из металла, погруженного в раствор своей соли, и стандартного водородного электрода. Измерения проводят в стандартных условиях: температура – 298К, давление – 101,3 кПа и активность (концентрация) ионов металла в растворе – 1 моль/л.
Если равновесие H2 ⇄ 2Н+ + 2е– смещено вправо и атомы водорода с платиновой пластинки переходят в виде ионов Н+ в раствор, то знак водородного электрода в гальваническом элементе будет отрицательным, а схема гальванической цепи:
ЭДС такой цепи равна: Е= j0 

т. е. для электродов с более высоким значением электродного потенциала, чем у водородного, стандартный электродный потенциал будет величиной положительной (например, j0 Сu2+/Cu= +0,34 В).
Если же в гальваническом элементе к водородному электроду будет направлен поток электронов, то реакция Н2 ⇄ 2Н+ + 2ē будет сдвинута влево, а схема гальванического элемента:
Тогда ЭДС: Е = j0

т. е. для электродов с более низким значением электродного потенциала, чем у водородного, стандартные электродные потенциалы будут отрицательными величинами (например, j0 Zn2+ /Zn = –0,76В).
Если все металлы расположить последовательно по возрастающей величине их стандартных электродных потенциалов, получим ряд напряжений металлов, который широко используется при изучении окислительно-восстановительных свойств металлов и их катионов и в практике составления гальванических элементов.
На величину ЭДС гальванического элемента влияют природа электродов, активность ионов в растворе, температура. Из перечисленных факторов наибольшее влияние на величину ЭДС оказывает природа электродов. Чем дальше друг от друга удалены металлы в ряду напряжений (т. е. чем больше разница между стандартными потенциалами металлов), тем больше ЭДС гальванического элемента, в котором эти металлы использованы.
ЭДС химического гальванического элемента, измеренная при 298К и активной концентрации ионов металла в растворе их солей 1 моль/л называется стандартной ЭДС и равна: Е0 = j0 катода – j0 анода
Например, для медноцинкового элемента стандартная ЭДС будет равна :
Е0 = j0 Cu2+/Cu – j0 Zn2+/Zn = + 0,34 – (–0,76) = 1,1B
Окислительно-восстановительные потенциалы
Электродный потенциал любого металла является окислительно-восстановительным потенциалом (ОВ-потенциал). Однако, в химии принято называть ОВ-потенциалами лишь те, которые возникают на инертных электродах (Рt, Pd и т. д.), помещенных в раствор, содержащий окисленную и восстановленную формы вещества. Например, платиновая пластинка погруженная в раствор содержащий FeCI2 и FeCI3. Схема ОВ-электрода в этом случае будет записывается следующим образом: Pt½ FeCI3, FeCI2 или Pt½Fe3+, Fe2+. Наличие запятой между окисленной и восстановленной формами показывает, что между ними в растворе нет поверхности раздела. Окислитель Fe3+ и восстановитель Fe2+ в растворе непрерывно взаимодействуют друг с другом. Этот обменный процесс описывается уравнениями:
Fe2+ ® Fe3+ + ē и Fe3+ + ē ® Fe2+ .
В присутствии платины, которая в электродном процессе не участвует, обмен электронами между ионами Fe3+ и Fe2+ ускоряется. При этом происходит появление на металле электрического заряда и образование на границе раздела ДЭС. Постепенно происходит выравнивание скоростей окисления и восстановления и в системе инертный металл (Pt) – раствор (Fe3+/Fe2+) устанавливается в ДЭС равновесие, которое характеризуется определенным значением ОВ-потенциала.
Стандартный ОВ-потенциал представляет собой электродвижущую силу гальванического элемента, составленного из ОВ-электрода, в котором активности (концентрации) окисленной и восстановленной форм вещества равны 1 моль/л, и нормального водородного электрода. Значения стандартных ОВ-потенциалов некоторых систем приведены в таблице:
Мn
Мn 
Cr2O 
Cr2O 
Стандартные ОВ-потенциалы являются количественной мерой окислительно-восстановительной способности системы. Чем выше значение j0, тем большей окислительной способностью обладает окисленная форма данной пары. Восстановительные свойства сильнее выражены у восстановленной формы в паре с меньшим значением j0.
Величина ОВ-потенциала в реальных условиях рассчитывается по уравнению Нернста-Петерса (Петерса): j (ок., вос.) = j0 (ок., вос.) + 
где n — число электронов, участвующих в ОВ реакции; аокисл и авосст — активности окисленной и восстановленной форм в растворе. Например, для выше взятого электрода уравнение имеет вид:
j Fе3+/Fе2+ = j0 Fе3+/Fе2+ + 
Если в сопряженную ОВ-систему входят ионы Н+ или ОН— , то потенциал такой системы зависит и от их активности.
Например, для системы МnО





Таким образом, на значение ОВ-потенциала влияет природа сопряженной ОВ-пары, соотношение активностей (концентраций) окисленной и восстановленной форм в растворе, температура и рН раствора. Из уравнения Петерса следует, что чем выше температура, больше концентрация окисленной формы и меньше концентрация восстановленной формы в растворе, тем больше значение ОВ-потенциала и выше окислительная способность системы.
Все используемые в потенциометрии электроды классифицируются по назначению и по механизму возникновения потенциала.
По своему назначению все электроды делятся на электроды сравнения, потенциалы которых не зависят от концентрации исследуемого раствора и электроды определения, на потенциал которых влияет концентрация ионов.
По механизму возникновения электродного потенциала различают обратимые и необратимые электроды.
Обратимыми называются электроды, в которых реакция может идти как в прямом, так и в обратном направлении. Если изменить направление движения тока, то реакция Zn + Cu2+ ⇄ Zn2+ + Cu пойдет в обратном направлении. Металлические электроды (Zn|Zn2+, Cu|Cu2+ и др.) являются обратимыми. Необратимыми электродами являются электроды, на которых при изменении направления тока идет не обратная, а побочная реакция.
Обратимые электроды делят на электроды первого рода, электроды второго рода, окислительно-восстановительные электроды и ионноселективные электроды.
Электроды I рода обратимы только по отношению к одному виду иона — катиона или аниона. К ним относятся, например, рассматриваемые выше металлические электроды, обратимые относительно катиона (Zn|Zn2+, Cu|Cu2+ и др.). Они применимы как электроды определения (индикаторные электроды). Потенциал такого электрода зависит по уравнению Нернста от концентрации (активности) одного иона.
К электродам первого рода относятся также газовые электроды, которые могут быть обратимы по отношению к катиону или аниону. Их создают по схеме
(Ме) газ|раствор. Металл должен быть инертным по отношению в веществам, находящимся в растворе и необходим для создания поверхности, на которой протекает реакция. Типичным примером газового электрода является водородный электрод
(Pt)H2|2H+. Водородный электрод используется как стандартный электрод сравнения, но может служить и электродом определения (когда аН+ ¹ 1 моль/л). Если перейти от натурального логарифма ln к десятичному lg, то уравнение Нернста для водородного электрода примет вид:
j

Так как при 298К сомножитель 

то j 


Отсюда, рН = – 
Электроды II рода обратимы по отношению к двум видам ионов, т. е. их потенциал зависит от активности (концентрации) катиона металла в растворе и аниона труднорастворимой соли этого металла.
Электрод II рода состоит из металла, покрытого слоем его труднорастворимой соли, погруженного в раствор электролита, содержащий анион одноименный с труднорастворимой солью. Примером такого электрода является хлорсеребряный электрод (рис.4), который состоит из серебряной проволоки (1) с нанесенным слоем АgCI (2), погруженной в раствор, содержащий CI–-ионы (HCl, KCl) определенной концентрации, (4) – микрощель для контакта с исследуемым раствором.
Основному химическому процессу
Ag+ + ē ⇄ Ag сопутствует реакция растворения-осаждения труднорастворимого электролита AgCI: AgCI ⇄ Ag++ CI–
В присутствии CI– –ионов растворимость AgCI снижается. При данной температуре и данной концентрации KCI концентрация ионов Ag+ практически постоянна. Потенциал возникает на границе Ag½Ag+ вследствие протекания электродной реакции:
AgCI (т. в.) + ē ⇄ Ag + CI– .
Этот потенциал может быть выражен уравнением Нернста:
j х. с. = j0 Ag+/ Ag +
Для AgCI термодинамическая константа растворимости равна:


Подставляя значение aAg+ в уравнение Нернста, получим:
j х. с. = j0 Ag+/Ag + 



Соединяя постоянные при данной температуре величины j0 Ag+/Ag и 
j х. с. = j0х. с. – 
В конечном итоге потенциал хлорсеребряного электрода зависит от активности (концентрации) ионов хлора в растворе, связанной с активностью катионов серебра через величину 
Используя хлорсеребрянный электрод как электрод сравнения, проще всего поддерживать постоянную активность Cl– – ионов, используя насыщенный раствор KCl. Схема такого электрода Ag½AgCI, KCI.
Ионоселективные электроды — это электроды, потенциал которых зависит от концентрации только одного какого-то иона в растворе. Они служат электродами определения. При помощи ионоселективных электродов можно определить концентрацию ионов Н+, Na+, K+, Ca2+, 

Одним из важнейших представителей группы ионоселективных электродов является стеклянный электрод, потенциал которого зависит только от активности ионов водорода Н+.
Стеклянный электрод (рис.6) представляет собой тонкостенный шарик (мембрана) из специального сорта токопроводящего литиевого стекла (1), наполненный раствором 0,1М HCI (2). В раствор соляной кислоты погружен внутренний хлорсеребряный электрод сравнения (3). Электродная реакция сводится к обмену ионами Н+ между двумя фазами: стеклянной мембраной (1) и исследуемым раствором (4), которая протекает на поверхности стекла: R (Na+, Li+) + H+⇄ R(H+) + (Na+, Li+)
Состояние поверхности стекла определяется главным образом активностью ионов Н+. Стеклянный электрод с водородной функцией схематически записывается:
Ag½AgCI, 0,1M HCI½стекло ½Н+, раствор
Потенциал стеклянного электрода складывается из нескольких потенциалов:
j стекл. = j1 + j2 + j3,
где j1 – потенциал внутреннего хлорсеребряного электрода сравнения (величина постоянная); j2 — потенциал внутренней поверхности стеклянной мембраны (величина постоянная); j3 — потенциал наружной поверхности стеклянной мембраны (величина переменная, зависящая от активности Н+ в исследуемом растворе).Объединяя постоянные величины под К получим уравнение потенциала стеклянного электрода:
j стекл. = К + 0,059 lg aH+ или j стекл = К – 0,059 рН, где К = j1 + j2.
Потенциометрический анализ
Различают прямую потенциометрию (ионометрию) и потенциометрическое титрование.
Потенциометрические методы анализа основаны на определении зависимости между электрохимическим потенциалом индикаторного электрода, погруженного в исследуемый раствор и концентрацией определяемого вещества в этом растворе. Эта зависимость описывается уравнением Нернста. В разбавленных растворах коэффициенты активности ионов близки к единице, а активность близка к концентрации, поэтому можно пользоваться уравнением Нернста в концентрационной форме:
Е = Е0 +
где Е – ЭДС цепи; Е0 – стандартное значение ЭДС гальванической цепи. При измерении ЭДС в окислительно-восстановительных системах применяют уравнение.
Е = Е0 +
где [окисл.], [восст.] – концентрации окисленной и восстановленной форм в растворе, Е0 – значение ЭДС стандартной окислительно-восстановительной цепи. В этом случае применяют инертный металлический электрод, чаще всего платиновый, потенциал которого зависит от соотношения концентраций окисленной и восстановленной форм веществ. Используя газовый электрод в паре с электродом сравнения возможно прямое потенциометрическое определение содержания газа в образце, т. к. в этом случае ЭДС цепи будет определятся уравнением:
Е = const + 
Вышеуказанные уравнения лежат в основе потенциометрических методов анализа.
Потенциометрическое определение рН. Для измерения рН в исследуемый раствор с неизвестной концентрацией ионов Н+ помещают электрод сравнения (например, хлорсеребряный) и стеклянный электрод, являющийся ионноселективным электродом определения. Стеклянный электрод и хлорсеребрянный электрод присоединяют к разным полюсам. Образуется гальваническая цепь, которая условно записывается так:
Ag½AgCI, HCI½стекло ½Н+, раствор║KCl, AgCl½Ag
ЭДС такой цепи равна разности потенциалов хлорсеребряного электрода сравнения и стеклянного электрода определения:
E = j х. с. – jстекл.
Подставим значение j ст. в выражение, получим:
E = j х. с.– (К – 0,059 рН)
Обозначим постоянные j х. с. и К постоянной const, получим:
Е = const + 0,059 рН, откуда
рН =
Потенциометрическое титрование. Потенциометрическим титрованием называют метод определения концентрации или количества вещества по потенциометрическим кривым титрования. В анализируемый раствор опускают электроды определения и сравнения, которые составляют гальваническую цепь. После каждого добавления малых порций титранта (по 0,1 – 0,2 мл) из бюретки в анализируемый раствор измеряют ЭДС или рН. По результатам титрования строят кривую потенциометрического титрования, представляющую собой график зависимости ЭДС в милливольтах от объема раствора титранта в случае окислительно-восстановительного титрования или рН от объема раствора титранта в случае кислотно-основного титрования (рис.6). Кривая потенциометрического титрования характеризуется наличием почти вертикального отрезка кривой, называемой скачком титрования. Скачок титрования свидетельствует о резком изменении потенциала индикаторного электрода (скачок потенциала), а это достигается в том случае, когда в области точки эквивалентности наблюдается резкое изменение концентрации титруемых ионов. Середина скачка титрования соответствует точке эквивалентности, для нее V(титр.) = Vэкв. Потенциометрическое титрование основано на реакциях нетрализации, окисления-восстановления, комплексообразования, осаждения, при этом фиксирование рН или окислительно-восстановительного потенциала по мере прибавления титранта проводится безиндикаторным способом.
Рис.6. Кривые потенциометрического титрования.
1 – сильной кислоты; 2 – слабой кислоты
В зависимости от реакций, лежащих в основе титрования, подбирают титранты, способы определения точки эквивалентности. Типом протекающей реакции определяется и выбор электрода определения. При кислотно-основном титровании рН раствора измеряется с помощью стеклянного электрода определения. При окислительно-восстановительном титровании применяют окислительно-восстановительный платиновый электрод определения. В случае комплексометрического титрования в качестве электрода определения используют ионоселективный электрод, чувствительный к концентрации анализируемого иона, участвующего в реакции комплексообразования.
Потенциометрическое титрование имеет ряд преимуществ по сравнению с другими методами анализа. Относительная погрешность при проведении потенциометрического титрования составляет 0,5 – 1%, что меньше, чем при титровании с индикаторами (1 – 2%). Потенциометрия выгодно отличается от кондуктометрии тем, что присутствующие в растворе электролиты, как правило, не мешают титрованию. Измеряемая ЭДС не обладает тем свойством аддитивности, которое присуще электрической проводимости.
Метод потенциометрического титрования позволяет определить концентрацию веществ в мутных и окрашенных растворах, допускает автоматизацию титрования и определение концентрации нескольких веществ в одной порции исследуемого раствора. Этот метод используется для определения констант диссоциации и констант гидролиза биологически активных веществ(аминокислот, полисахаридов, белков, жиров, нуклеиновых кислот); для определения констант равновесия отдельных стадий биологического окисления; для определения констант нестойкости и состава хелатных комплексных соединений биометаллов с аминокислотами, белками, ферментами. Этот метод используют для изучения кинетики и механизма биохимических реакций, для контроля за физиологическими процессами, связанными с переносом, либо электронов, либо ионов. Потенциометрическое титрование применяют в санитарной практике для анализа и контроля за состоянием окружающей среды.
Основные вопросы темы
1. Электродные и окислительно-восстановительные (ОВ) потенциалы, механизм их возникновения и зависимость от различных факторов. Уравнения Нернста и Петерса для вычисления значений потенциалов.
2. Гальванические элементы (химические и концентрационные): механизм действия и расчет ЭДС. Измерение электродных и ОВ-потенциалов.
3. Обратимые электроды первого и второго рода (водородный и хлорсеребряный). Ионоселективные электроды (стеклянный электрод). Устройство и механизм возникновения потенциала.
4. Электроды сравнения и электроды определения (индикаторные), применяемые в потенциометрии.
5. Сущность потенциометрического определения рН.
6. Потенциометрическое титрование, его сущность и использование в количественном анализе и медико-биологических исследованиях.
Экспериментальные работы
Работа №1. Определение концентрации раствора слабой кислоты и ее
константы диссоциации методом потенциометрического титрования
Цель работы. Научиться определять концентрацию слабой кислоты в растворе и ее константу диссоциации методом потенциометрического титрования.
Приборы и реактивы. Иономер, магнитная мешалка, бюретка для титрования, пипетка Мора на 10 мл, стакан для титрования, раствор уксусной кислоты неизвестной концентрации, 0,1000н раствор гидроксида натрия.
Задание 1. Определить концентрацию уксусной кислоты в растворе.
В стакан для титрования с помощью пипетки Мора отмерить 10 мл исследуемого раствора уксусной кислоты, а затем 10 мл воды. С помощью магнитной мешалки перемешать раствор и измерить значение рН исходного раствора на ионометре, работая строго по инструкции. Далее титровать раствор кислоты, добавляя щелочь из бюретки порциями, объем которых указан в таблице:
http://www.chem-astu.ru/chair/study/anchem/r_4_1.htm
http://pandia.ru/text/78/039/30406.php