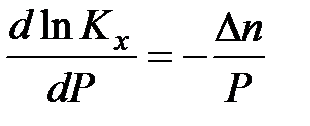Уравнение планка ван лаара физхимия
Лекции для студентов четвертого курса (2015/2016 год)
Лектор: профессор Михаил Валерьевич Коробов
Осенний семестр
Химическая и статистическая термодинамика
Предисловие лектора
Основные понятия термодинамики. Уравнения состояния. Уравнение состояния идеального газа, уравнение Ван-дер-Ваальса, закон соответственных состояний. Термические коэффициенты. PDF
Первый закон термодинамики. Внутренняя энергия, тепло, работа, теплоемкость. PDF
Первый закон в химии. Энтальпии реакций, энтальпии образования, закон Гесса и закон Кирхгоффа. PDF
Второй закон термодинамики. Энтропия. Формулировки Первого и Второго законов термодинамики. PDF
Второй закон, термодинамические потенциалы. Условия термодинамического равновесия. Уравнения Гиббса-Дюгема, Гиббса — Гельмгольца, уравнения Максвелла. PDF
Химический потенциал. Выражение для химического потенциала идеального и реального газов. Фугитивность. Условия химического равновесия. Химическое сродство. Константа равновесия реакций с участием газов. Изотерма химической реакции. PDF
Условия фазового равновесия. Правило фаз. Уравнение Клаузиуса — Клапейрона. Условия мембранного равновесия. PDF
Диаграммы состояния однокомпонентных систем (вода, сера, фосфор). Фазовые переходы первого и второго рода. Уравнение Эренфеста. PDF
Основные понятия термодинамики растворов. Химический потенциал компонента в растворе. Закон Рауля и закон Генри. Выбор стандартных состояний для химического потенциала. Термодинамическая активность. Идеальный, регулярный и атермальный растворы. PDF
Парциальные мольные и средне-мольные величины Уравнения Гиббса-Дюгема-Маргулеса.. Фазовые равновесия в двухкомпонентных системах (уравнение Шредера, Ван-Лаара и т.п.) PDF
Фазовые и мембранные равновесия в двухкомпонентных системах (криоскопия, эбулиоскопия, осмос). Диаграммы p-x (T=const), отклонения от идеальности. Законы Коновалова. Диаграммы плавкости T-x (p=const). PDF
Расслаивание. Зависимости G*-x (p,T=const) и диаграммы p-x (T=const), T-x (p=const) в двухкомпонентных систем. Химические равновесия в растворах. Константы равновесия для реакций в растворах при разном выборе стандартных состояниях. Изобара химической реакции. PDF
Константы равновесия химических реакций (продолжение). Расчет равновесных выходов продуктов. Как по энергии Гиббса судить о возможности протекания химических реакций? Третий закон термодинамики. Приведенный термодинамический потенциал, термодинамические таблицы. PDF
Термодинамика адсорбции. Уравнение Гиббса. Изотермы Ленгмюра и БЭТ. PDF
Термодинамика необратимых процессов. Производство энтропии. Линейные законы. Связь между сродством и скоростью химической реакции. Перекрестные явления. Принцип Кюри, соотношения Онсагера. Теорема Пригожина. PDF
Основные понятия статистической термодинамики. Энтропия и термодинамическая вероятность. Метод ячеек Больцмана. Статистики Бозе-Эйнштейна и Ферми-Дирака. Фазовое Г-пространство. Плотность вероятности в фазовом пространстве. PDF
Фазовые пространства. Плотность вероятности в фазовом пространстве. Микроканонический и канонический ансамбль. Связь между энтропией и плотностью вероятности. Суммы по состояниям Z и Q. Связь с термодинамическими функциями. PDF
Расчет сумм по состояниям для различных видов движения. Поступательная сумма по состояниям. Формула Закура — Тетроде. Электронная сумма по состояниям. Характеристические температуры. PDF
Фазовое μ — пространство. Распределение молекул по скоростям и по энергиям в идеальном газе. Функция f(E) в Г- и μ — пространствах. Колебательная сумма по состояниям. PDF
Вращательная сумма по состояниям. Ядерная сумма по состояниям. Заторможенное внутреннее вращение. Итоги статистических расчетов для идеальных газов. PDF
Расчет константы равновесия химической реакции методом статистической термодинамики. Равновесие пара-орто (1:3) водород. Закон равнораспределения. Теории теплоемкости атомных кристаллов Эйнштейна и Дебая. Конфигурационный интеграл. PDF
Метод ячеек в статистической термодинамике жидкостей. Клеточный интеграл. Расчет энтропии смешения в рамках решеточной модели раствора. Парадокс Гиббса. Расчет конфигурационного интеграла для реальных газов (начало). PDF
Расчет конфигурационного интеграла для реальных газов методом Урселла-Майера. Статистическое рассмотрение вириального уравнения и закона соответственных состояний. PDF


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Лабораторная работа. Государственное бюджетное образовательное учреждение высшего
Государственное бюджетное образовательное учреждение высшего
Профессионального образования
Саратовский государственный медицинский университет
Имени В.И. Разумовского» Министерства здравоохранения и социального
Развития Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздравсоцразвития России)
Методические указания к лабораторно – практическому занятию
для студентов медицинских специальностей
Химическое равновесие
Дисциплина: общая химия.
Очная форма обучения.
Длительность занятия: 90 минут.
Разработка составлена асс. Куликовой Л.Н.
Цели
формирование у студентов представлений о факторах, влияющих на смещение равновесия биохимических процессов.
Исходные знания студентов:
Закон действующих масс. Принцип Ле-Шателье.
Студент должен знать: понятие «химическое равновесие». Термодинамические условия химического равновесия в изолированных и закрытых системах. Константа химического равновесия. Уравнения изотермы и изобары химических реакций.
Студент должен уметь:прогнозировать результаты физико-химических процессов, протекающих в живых системах, опираясь на теоретически положения, в зависимости от изменения температуры и давления (расчеты по уравнениям изотермы и изобары химической реакции).
1. Ознакомиться с вопросами для подготовки к занятию.
Вопросы для подготовки к занятию
1) Химическое равновесие.
2) Обратимые и необратимые по направлению реакции.
3) Термодинамические условия равновесия в изолированных и закрытых системах.
4) Константа химического равновесия.
5) Уравнения изотермы и изобары химической реакции.
2. Осмыслить краткий теоретический материал (приложение 1) и текст лекции «Основные понятия термодинамики. Первое и второе начала термодинамики».
3. Если определённые участки лекции трудны для понимания, то необходимо обратиться к следующим учебникам:
| №п/п | Авторы | Название | Страницы |
| Ершов Ю.А., Попков А.С., Берлянд А.С., Книжник А.З. | Общая химия. Биофизическая химия. Химия биогенных элементов.- М.: Высш. шк.-2000.-560 с. | 32-41 | |
| Глинка Н.Л. | Общая химия. — Л.: Химия.-1978.-720 с. | 184-201 | |
| Равич-Щербо М.И., Новиков В.В. | Физическая и коллоидная химия.-М.: Высш. шк.-1975.-255 с. | 17-19 | |
| Ленский А.С. | Введение в бионеорганическую и биофизическую химию.- М.: Высш. шк.-1989.-256 с. | 80-92 |
4. Ответить на вопросы для самоконтроля (приложение 2).
5. Выполнить тренировочный тест и проверить правильность выполнения по ключу (приложение 3).
6. Решить ситуационную задачу (приложение 4).
Приложение 1: Краткий теоретический материал
Химическое равновесие – это такое состояние системы, при котором скорости прямой и обратной реакций равны между собой.
В равновесии изменения изобарно-изотермического потенциала (∆G) и изохорно-изотермического потенциала (∆F) равны нулю.
Закон действующих масс:
скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов.
aA + bB ↔сС + dD




а, b, c, d — стехиометрические коэффициенты
Константа равновесия может быть выражена не только через парциальные давления газообразных участников реакции, но и через молярные концентрации и мольные доли исходных веществ и продуктов реакции.
КС – константа равновесия, выраженная через концентрации участников реакции
R- газовая постоянная, R=8,314 Дж/(моль К)
∆n-разность количеств вещества конечных и исходных газообразных участников реакции
Кχ– константа равновесия, выраженная через мольные доли участников реакции
Робщ – общее давление.
Направление химической реакции определяют по величине изобарно-изотермического потенциала:
ΔG 0, протекает обратная реакция; несамопроизвольный процесс.
Рассчитывают ΔG по уравнению изотермы химической реакции:
R- газовая постоянная, R=8,314 Дж/(моль К).
РD, РС — неравновесные давления газообразных продуктов реакции
РА , РB— неравновесные давления газообразных исходных веществ.
Способы расчёта изобарно-изотермического потенциала:
1)
2)

Принцип Ле- Шателье:
если на систему, находящуюся в состоянии равновесия подействовать извне, то система смещает равновесие в сторону противодействия внешнему воздействию.
Повышение температуры смещает равновесие в сторону протекания эндотермического процесса. Повышение давления — в сторону образования меньшего числа моль газообразных веществ.
Зависимость константы химического равновесия от температуры при постоянном давлении описывает уравнение изобары Вант-Гоффа:
дифференциальная форма уравнения изобары

где R- газовая постоянная, R=8,314 Дж/(моль К);
Kp– константа равновесия, выраженная через давления;
∆Н – тепловой эффект реакции.
интегральная форма уравнения изобары
К1, К2 –константы химического равновесия реакции при температурах Т1 и Т2.
Зависимость константы химического равновесия от давления описывает уравнение Планка – Ван – Лаара:
Кх – константа химического равновесия, выраженная через мольные доли;
∆n – изменение числа моль газообразных участников реакции.
Приложение 2: Вопросы для самоконтроля
1) Что называют химическим равновесием?
2) Какие реакции называют обратимыми по направлению реакции?
3) Какие реакции называют необратимыми по направлению реакции?
4) Назовите термодинамические условия равновесия в изолированных и закрытых системах.
5) Какими способами рассчитывают ∆G? Приведите расчётные формулы.
6) Через какие характеристики системы можно выразить константу равновесия?
7) Запишите уравнение изотермы и изобары химической реакции.
Приложение 3: Тренировочный тест
1. В системе 2SО2 + O2 —> 2SO3 исходные концентрации SО2 и О2 были соответственно равны 0,03 и 0,015 моль/л. В момент равновесия [SО2] стала равной 0,01моль/л. Константа равновесия равна
2. При 508°С константа скорости реакции Н2(г) + J2(г) —>2HJ(г) равна
0,16 л/(моль·мин). Исходные концентрации Н2 и J2 соответственно равны 0,04 и 0,05 моль/ л. Начальная скорость реакции составляет_________ моль/( л·мин).
3. В системе 2SО2(г) + O2(г) —> 2SO3(г) исходные концентрации SО2 и О2 были соответственно равны 0,03 и 0,015 моль/л. В момент равновесия [SО2] стала равной 0,01, а равновесная [SО3] _____моль/ л
4. Если в системе 2Са(к) + О2(г) —> 2СаО(к) увеличить давление в 2 раза, то скорость прямой реакции
а) возрастет в 4 раза
б) возрастет в 2 раза
в) понизится в 2 раза
5. Исходная концентрация СО и Сl2 в системе СО + Сl2 —>СОСl2 были равны 0,3 и 0,2 моль/л. Если концентрацию СО повысить до 0,6, а Сl2 до 1,2 моль/л, то скорость реакции между ними увеличится в
Эталоны ответов к тесту: 1а, 2а, 3а, 4б, 5в
Приложение 4: Ситуационные задачи.
1)Константа равновесия системы СО2(г) + Н2(г) —> CO(г) + Н2О(г) равна 1. В начальный момент [СО2] и [Н2] были соответственно равны 0,2 и 0,8 моль/ дм 3 . Концентрация [СО] равн. Составляет ______(моль/ дм 3 )
2)Запишите выражения КР для реакций:
Как связаны КР и КС для этих реакций?
3) Железо и водяной пар реагируют по уравнению:
Fe тв + H2O газ = FeО тв + H2 газ. При температуре 1298К и Робщ = 1атм равновесие наблюдается при РH2 = 0, 562 атм. и Р H2O = 0,438 атм. При температуре 1173К равновесие наблюдается при Р(H2)=
0,592 атм., Р (H2O) = 0,408 атм. Рассчитайте средний тепловой эффект реакции в этом интервале температур.
4) При 1000К для реакции SO2 + NO2 = SO3 +NO; Кр = 7,6. В каком направлении будет протекать реакция при РSO2 = 1 атм.; PNO2 = 6 атм.; PSO3 = 2 атм.; PNO= 3 атм.
5) Напишите уравнение, описывающее влияние давления на химическое равновесие. Приведите примеры реакций, на равновесие которых влияет давление и не влияет.
6) Как влияет общее давление на равновесие:
FeCO3 кр = FeO кр + CO2?
7) Для реакции N2+3H2 = 2NH3 при 623 0 К КР = 7,23 · 10 -14 (Н/м 2 ) -2 . В каком направлении будет протекать процесс при:
РN2 = PH2 = PNH3 = 1,0132 · 10 5 Н/м 2 .
8) Как нужно изменить условия проведения реакции (Т и Р)
CO + H2O(газ) = CO2 +H2, чтобы сдвинуть равновесие в сторону продуктов, если ΔН 0 800К = -36994 Дж/моль.
9). Для реакции: 2CO + 2H2 = CH4 + CO2 при 1000К КР = 2,57 · 10 -8 (Н/м) -2 . Определить, в каком направлении будет протекать реакция, если:
РСО = 1,0132 · 10 4 ;
РН2 = 2, 0264 · 10 4 ;
РСН4 = 2, 0264 · 10 4 ;
РСО2 = 6, 0792 · 10 4 Н/м 2
10). Для реакции СТВ + 2Н2 Г = СН4 г, при 973К КР = 0, 1924 · 10 -5 Н/м 2 , а при 1033К КР = 0,1159 · 10 -5 . Вычислить средний тепловой эффект реакции в этом интервале температур.
11)Что требуется сделать для для смещения равновесия гомогенной химической реакции 2НI ® 2H2 + O2, ΔH 0.
Лабораторная работа
Влияние изменения концентраций на химическое равновесие.
Воздействие концентраций на равновесие изучим на примере реакции хлорида железа (+3) с роданидом калия. м.
Обычно полное уравнение реакции представляют так:
Этому молекулярному уравнению можно сопоставить разные ионные.
Если считать, что хлорид железа полностью распадается на ионы, а роданид железа совсем не распадается, получается следующее сокращённое ионное уравнение:
Частичной диссоциации обеих солей железа отвечают другие ионные уравнения, например, такое:
FeCl 2+ + 2SCN – Fe(SCN)2 + + Cl – .
Запишите стандартное выражение для константы данного равновесия.
В пробирку налейте 10 мл раствора KSCN и прибавьте 1–2 капли разбавленного раствора FeCl3. Должен получиться слабоокрашенный раствор. Его разделите на 4 равные порции.
К первой порции прибавьте концентрированный раствор FeCl3. Во вторую порцию всыпьте ложечку сухого KSCN. К третьей порции добавьте ложечку сухого KCl или влейте 1–2 мл концентрированной HСl. Четвёртая пробирка предназначена для сравнения (исходное состояние).
Единственным ярко окрашенным веществом в системе является соединение ионов железа и роданида.
Проанализируйте изменения цвета в порциях 1-3 с точки зрения принципа Ле-Шателье. Какой из вариантов ионного уравнения противоречит опыту?
Коллоквиум № 2 по теме «Химическое равновесие» курса «Физическая химия» (спец. ХТНВМиИ, группы 6–10, 2-й курс, факультет ХТиТ)
Коллоквиум № 2 по теме «Химическое равновесие»
курса «Физическая химия» (спец. ХТНВМиИ, группы 6–10, 2-й курс, факультет ХТиТ)
1. Объединенное выражение для первого и второго законов термодинамики. Понятие о термодинамическом потенциале. Энергия Гельмгольца (изохорно-изотермический потенциал), ее зависимость от температуры и объема. Энергия Гиббса (изобарно-изотермическиц потенциал), ее зависимость от температуры и давления.
2. Энергия Гиббса и энергия Гельмгольца как критерии равновесия и направления протекания процессов в неизолированных системах (в изобарно-изотермических и, соответственно, в изохорно-изотермических условиях).
3. Понятие о характеристических функциях. Понятие о химическом потенциале. Химический потенциал идеального и реального газа. Уравнение Гиббса–Дюгема.
4. Уравнение Гиббса–Гельмгольца. Расчет стандартного изменения энергии Гиббса химической реакции при стандартных условиях и произвольной температуре (5 способов расчета).
5. Понятие о химическом равновесии, его признаки. Константа равновесия химической реакции, способы ее выражения для гомогенных и гетерогенных реакций. Kp, KC и Kx, связь между ними.
6. Расчет состава равновесной смеси, равновесной степени превращения исходных реагентов и равновесного выхода продуктов реакции.
7. Уравнение изотермы химической реакции. Термодинамические критерии химического равновесия и направления протекания химической реакции (при стандартных условиях, при произвольных начальных условиях).
8. Зависимость константы равновесия химической реакции от температуры. Уравнение изобары Вант-Гоффа, его вывод, формы записи (дифференциальная и интегральная) и анализ. Уравнение изохоры Вант-Гоффа.
9. Зависимость константы равновесия Kx химической реакции от давления. Уравнение Планка–Ван Лаара, его вывод и анализ.
10. Влияние различных факторов (температуры, давления, концентраций (парциальных давлений) участников химической реакции, введения в систему газообразных инертных примесей (или разбавления раствора растворителем)) на положение равновесия химической реакции. Принцип Ле Шателье, его формулировки и практическое использование (на примерах)
1. Константа равновесия реакции 2HI (г.) = I2 (г.) + H2 (г.) при 1400 К равна: Kр = 0,065. Начальное давление HI (г.) равно 0,8 атм, начальные давления продуктов реакции – H2 и I2 ‑ равны нулю. Рассчитать равновесный выход I2 (г.). Как влияет повышение температуры на равновесную степень превращения HI, если 
2. Используя справочные данные, рассчитать величину стандартного изменения энергии Гиббса (

3. Для реакции 3(С2H2) = (C6H6) константа равновесия (Kр) при температуре 850 К составляет 4,2·1020 (атм2). Рассчитать значение Kр, выраженное в паскалях, а также значения KС и Kx, если общее давление реакционной смеси составляет 4 атм.
4. Для реакции (N2) + 3(H2) = 2(NH3) константа равновесия (выраженная через атмосферы) составляет 2,28·103 (350 К), 385 (400 К). По уравнению изобары Вант-Гоффа определить значение теплового эффекта химической реакции в интервале температур 350–400 К и рассчитать Kp реакции при температуре 380 К.
http://mydocx.ru/8-42749.html
http://pandia.ru/text/80/295/6649.php