Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de400319f4d00b0 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Гидролиз ортофосфата кальция
Ca3(PO4)2 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
3Ca 2+ + 2PO4 3- + 2HOH ⇄ 2Ca 2+ + 2HPO4 2- + Ca 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
PO4 3- + HOH ⇄ HPO4 2- + OH —
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2Ca 2+ + 2HPO4 2- + 2HOH ⇄ Ca 2+ + 2H2PO4 — + Ca 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
HPO4 2- + HOH ⇄ H2PO4 — + OH —
Третья стадия (ступень) гидролиза
Полное ионное уравнение
Ca 2+ + 2H2PO4 — + 2HOH ⇄ 2H3PO4 + Ca 2+ + 2OH —
Среда и pH раствора ортофосфата кальция
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Структура фосфата кальция (Ca3 (PO4) 2), свойства, образование и использование
фосфат кальция неорганическая и третичная соль, химическая формула которой Ca3(РО4)2. Формула утверждает, что состав этой соли составляет 3: 2 для кальция и фосфата, соответственно. Это можно увидеть непосредственно на нижнем изображении, где показан катион Ca 2+ и анион ПО4 3- . На каждые три КА 2+ Есть два ПО4 3- взаимодействуя с ними.
С другой стороны, фосфат кальция относится к ряду солей, которые варьируются в зависимости от соотношения Ca / P, а также от степени гидратации и pH. На самом деле существует много типов фосфатов кальция, которые существуют и могут быть синтезированы. Однако, буквально следуя номенклатуре, фосфат кальция относится только к трикальцию, упомянутому выше..
Все фосфаты кальция, включая Са3(РО4)2, Они однотонные с легкими сероватыми тонами. Они могут быть зернистыми, мелкими, кристаллическими и иметь размеры частиц около микрометров; и даже были получены наночастицы этих фосфатов, с помощью которых были разработаны биосовместимые материалы для костей..
Эта биосовместимость связана с тем, что эти соли находятся в зубах и, короче, в костных тканях млекопитающих. Например, гидроксиапатит представляет собой кристаллический фосфат кальция, который, в свою очередь, взаимодействует с аморфной фазой той же соли.
Это означает, что существуют аморфные и кристаллические фосфаты кальция. По этой причине разнообразие и множество вариантов не удивительны при синтезе материалов на основе фосфатов кальция; материалы, свойства которых исследователи интересуются каждый день во всем мире, чтобы сосредоточиться на восстановлении костей.
- 1 Структура фосфата кальция
- 1.1 Аморфный фосфат кальция
- 1.2 Остальная часть семьи
- 2 Физические и химические свойства
- 2.1 Имена
- 2.2 Молекулярный вес
- 2.3 Физическое описание
- 2.4 Вкус
- 2.5 Точка плавления
- 2.6 Растворимость
- 2.7 Плотность
- 2.8 Показатель преломления
- 2.9 Стандартная энтальпия тренировки
- 2.10 Температура хранения
- 2,11 рН
- 3 Обучение
- 3.1 Нитрат кальция и гидрофосфат аммония
- 3.2 Гидроксид кальция и фосфорная кислота
- 4 использования
- 4.1 В костной ткани
- 4.2 Биокерамические цементы
- 4.3 Врачи
- 4.4 Другое
- 5 ссылок
Структура фосфата кальция
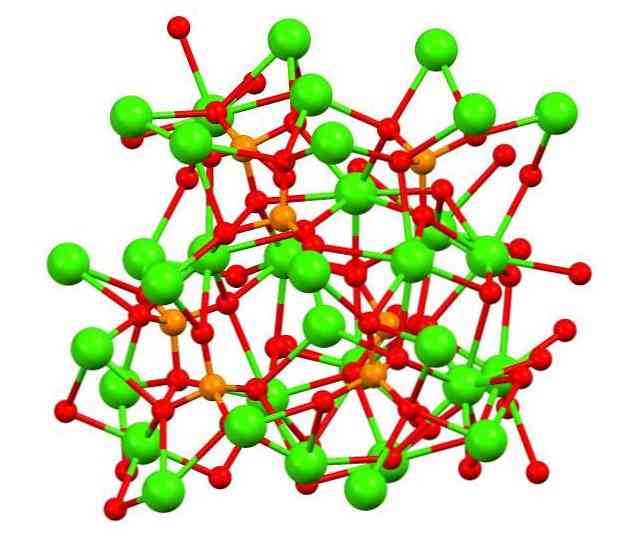
Верхнее изображение показывает структуру трехосновного каликофосфата в странном минерале whitlockite, который может содержать магний и железо в качестве примесей.
Хотя на первый взгляд это может показаться сложным, необходимо уточнить, что модель предполагает ковалентное взаимодействие между атомами кислорода фосфатов и металлическими центрами кальция.
В порядке представления это действительно, однако, взаимодействия являются электростатическими; катионы Са 2+ привлекаются к анионам ПО4 3- (Са 2+ — O-PO3 3- ). Имея это в виду, понятно, почему на изображении кальций (зеленые сферы) окружен отрицательно заряженными атомами кислорода (красные сферы).
Когда есть так много ионов, это не оставляет симметричное расположение или образец видимым. Ca3(РО4)2 Принимает при низких температурах (Т — и HPO4 2- в АШП. Эти ионы образуются при гидролизе одного из фосфатов:
В результате истинная структура АШП становится более сложной, состав ее ионов которой представлен формулой: Ca9(РО4)6-х(HPO4)х(ОН)х. «Х» указывает на степень гидратации, так как если х = 1, то формула будет такой: Ca9(РО4)5(HPO4) (ОН).
Различные структуры, которые могут иметь PCA, зависят от молярных отношений Ca / P; то есть относительного количества кальция и фосфата, которые изменяют весь их результирующий состав.
Остальная часть семьи
На самом деле фосфаты кальция представляют собой семейство неорганических соединений, которые, в свою очередь, могут взаимодействовать с органической матрицей..
Другие фосфаты получают «просто» путем замены анионов, которые сопровождают кальций (ПО4 3- , HPO4 2- , H2ПО4 — , Огайо — ), а также тип примесей в твердом теле. Таким образом, до одиннадцати или более фосфатов кальция, каждый со своей структурой и свойствами, могут возникать естественным или искусственным путем..
Ниже приведены некоторые фосфаты и их соответствующие структуры и химические формулы:
-Водород кальций фосфат дигидрат, CaHPO4H 2H2O: моноклинный.
-Кальция дигидрофосфат моногидрат, Ca (H)2ПО4)2∙ H2O: триклиника.
-Безводный кислый фосфат, Ca (H)2ПО4)2: триклиника.
-Ocalcium гидрофосфат (OCP), Ca8H2(РО4)6: триклиника Является предшественником в синтезе гидроксиапатита.
http://chemer.ru/services/hydrolysis/salts/Ca3(PO4)2
http://ru.thpanorama.com/articles/qumica/fosfato-de-calcio-ca3po42-estructura-propiedades-formacin-y-usos.html