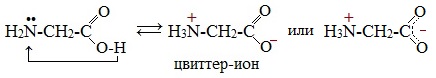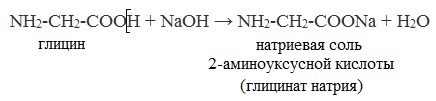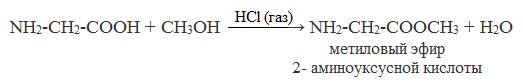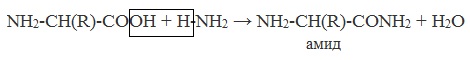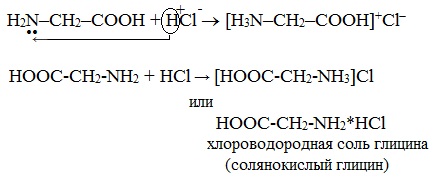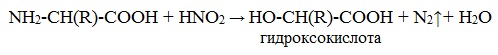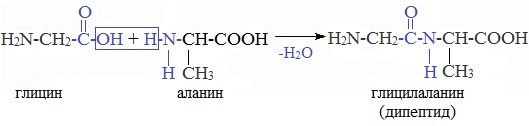СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ
1) Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот):
O2N-C6H4 -COOH + 3H2 → H2N-C6H4 -COOH + 2H2O
2) Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко — с помощью ионообменных смол.
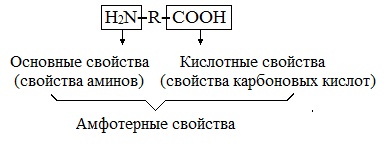
Химические свойства аминокислот как амфотерных органических соединений.
Аминокислоты — амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН), так и основной (-NH2) группы в одной и той же молекуле. В очень кислых растворах NH2-группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
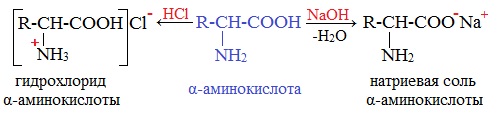
Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N–CH2 –COOH + HCl → Cl- [H3N–CH2 –COOH]+
При взаимодействии с щелочами аминокислоты реагируют по карбоксильной группе.
Как карбоновые кислоты они образуют функциональные производные:
а) соли : H2N–CH2 –COOH + NaOH → H2N–CH2 –COO- Na+ + H2O
б) сложные эфиры(реакция этерификации):
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 COOCH3 (метиловый эфир глицина)
При взаимодействии друг с другом аминокислоты образуют пептидную связь (существует в белке):
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 NH2 + H2O
При взаимодействии двух a-аминокислот образуется дипептид. Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Применение аминокислот.
Аминокислоты широко используются в современной фармакологии. Являясь не только структурными элементами белков и других эндогенных соединений, они имеют большое функциональное значение. Некоторые из них выступают в качестве нейромедиаторных веществ. Некоторые аминокислоты нашли самостоятельное применение в качестве лекарственных средств.
Белки. Получение белков реакцией поликонденсации аминокислот.
Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из -аминокислот, называются пептидами или полипептидами. Амидная связь в таких полимерах называется пептидной связью. Полипептиды с молекулярной массой не меньше 5000 называют белками.
Первичная, вторичная и третичная структуры белков.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка.
Фрагмент полипептидной цепи:
… — N – CH – C – N – CH – C – N – CH –C – N – CH – C — …
Один из первых белков, первичная структура которого была установлена в 1954 г., — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30), Mr (инсулина)=5700. Другой белок – фермент рибонуклеаза – состоит из 124 аминокислотных остатков и имеет Mr=15000.
Белок крови – гемоглобин имеет Mr = 68000. Белки некоторыхвирусов имеют Mr до 50 млн. Относительная молекулярная масса белков изменяется в широких пределах: от 5 тыс. до десятков миллионов.
Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков.
Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка. Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структураопределяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы — фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные(отношение меньше 10). К фибриллярным белкам относится коллаген, наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов.
Химические свойства
Денатурация – разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т.д.
При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы.
Первичная структура, а, следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых групп, облегчается воздействие на белки протеолитических ферментов, а, следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработке пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). К денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используют в пищевой и биотехнологии.
Качественные реакции на белки:
а) При горении белка – запах палёных перьев.
б) ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца):
Белок +HNO3 → жёлтая окраска
в) биуретовая реакция, (на пептидные связи)
Раствор белка +NaOH + CuSO4 → фиолетовая окраска
Гидролиз
Белок + Н2О → смесь аминокислот
г) ) цистеиновая реакция (на остатки аминокислот, содержащих серу):
белок + NaOH + Pb (CH3COO)2 → чёрное окрашивание.
Гидратация
Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличивается.
Биохимические функции белков. Функции белков в природе:
· структурные (кератин шерсти, фиброин шелка, коллаген);
· двигательные (актин, миозин);
· запасные (казеин, яичный альбумин);
· защитные (иммуноглобулины) и т.д.
Существуют белки, выполняющие специфические функции, например рецепторные, — обеспечивают передачу импульсов между нервными клетками и др.
Белки – необходимая составная часть пищи человека, отсутствие или недостаток их в пище может вызвать серьёзные заболевания.
Генетическая связь между органическими соединениями.
Генетическая связь ( от греч. «генезис» — происхождение).
Генетические связи — это связи между классами соединений, основанные на получении одного класса веществ с другого.
Генетическая связь отражает возможность взаимных превращений.
Правило генетических связей:
1) количество стрелок в схеме соответствует количеству уравнений химических реакций, которые необходимо сложить;
2) соединения, записанные перед стрелочкой обязательно должны вступить в химическую реакцию;
3) соединения, записанные после стрелочки должны образоваться в результате реакции.
Имея правила генетических связей давайте вместе совершим такое преобразование: С→СО2 → Н2СО3→СаСО3
Поэтому для неметаллов схема будет иметь такой вид:
Неметалл→ Кислотный оксид→ Кислота→Соль.
Изучая углеводороды, мы убедились в их разнообразии, которая обусловлена способностью атомов Углерода образовывать молекулы линейного, разветвленного, циклического строения; сочетаться между собой с помощью простых и кратных связей. А еще — образовывать гомологические ряды и изомеры.
Сравнив общие формулы алканов, алкенов и алкинов, можно заметить, что они отличаются количеством атомов Водорода в молекулах. Итак, реакциями гидрирования и дегидрирования можно переходить от одного класса углеводородов к другому. Существует также связь между насыщенными, ненасыщенными углеводородами и бензолом. Так, из метана реакцией дегидрирования можно получить ацетилен. А с него реакцией тримеризации добыть бензол:
Итак, при всем разнообразии углеводородов между ними существует взаимосвязь, что отражается во взаимных превращениях веществ. Это открывает огромные возможности для химического синтеза.
Вещественный мир природы чрезвычайно разнообразен, и вместе с тем все вещества взаимосвязаны. Генетическая связь между органическими и неорганическими веществами заключается, прежде всего, в том, что органические вещества можно добыть из неорганических. Например, при нагревании
неорганического вещества цианата аммония образуются органическое вещество мочевина (NH2)2CO:
Ярким доказательством существования генетической связи между органическими и неорганическими веществами являются также круговорот биогенных элементов в природе. Следовательно, все вещества генетически связаны между собой. Генетическая связь заключается в том, что каждое вещество может химически взаимодействовать с веществами других классов. Органические вещества могут взаимодействовать с неорганическими. Их можно синтезировать из неорганических и превращать в неорганические.
В органической химии также следует различать более общее понятие — генетическая связь и более частное понятие генетический ряд. Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одикиконым числом атомов углерода в молекуле. Рассмотрим генетический ряд органических веществ, в который включим наибольшее число классов соединений:
Каждой цифре над стрелкой соответствует определенное уравнение реакции (уравнение обратной реакции обозначено цифрой со штрихом):
Контроль знаний:
1.Дать определение амидной связи.
2. Дать характеристику структурам белка, составу аминокислот.
3.Какие элементы входят состав белка?
4.Опишите физические и химические свойства белков.
5.Какие вещества образуются при гидролизе белков?
6.Укажите число возможных изомерных аминов, имеющих молекулярную формулу СзН9N: а) два; б) три; в) четыре; г) пять.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр.169-173, Л1. Стр.174-177,178-183,пересказ конспекта лекции №14.
Лекция № 16.
Полимеры. Пластмассы: термопласты и реактопласты, их представители и применение. Волокна: природные (растительные и животные) и химические (искусственные и синтетические). Искусственные полимеры. Получение искусственных полимеров, как продуктов химической модификации природного полимерного сырья. Искусственные волокна (ацетатный шелк, вискоза), их свойства и применение
Основные понятия и термины по теме: полимеры и их классификация, искусственные и синтетические полимеры, волокна: ацетатный шёлк, вискоза, лавсан, нитрон, капрон, полипропилен, поливинилхлорид.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Полимеры и их классификация. Пластмассы и волокна: их характеристика.
2. Искусственные полимеры. Их характеристика.Искусственные волокна (ацетатный шелк, вискоза), их свойства и применение.
3. Каучуки. Натуральные и синтетические. Их характеристика.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e183e3b79e8218d • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Уравнение поликонденсации аминокислот в общем виде
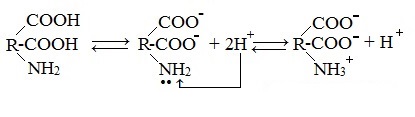
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
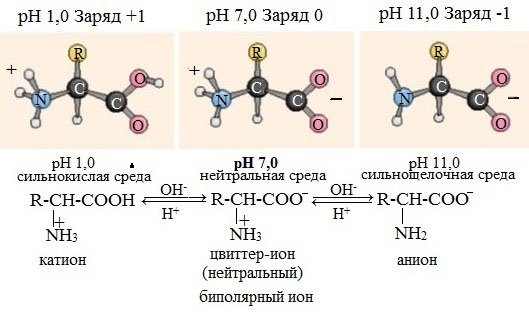
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
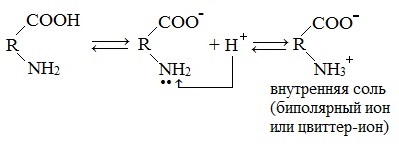
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
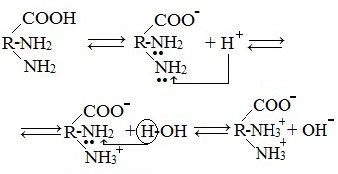
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
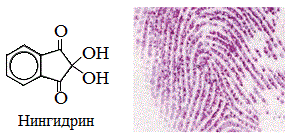
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
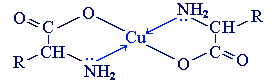
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/442.html
http://himija-online.ru/organicheskaya-ximiya/aminokisloty/ximicheskie-svojstva-aminokislot.html