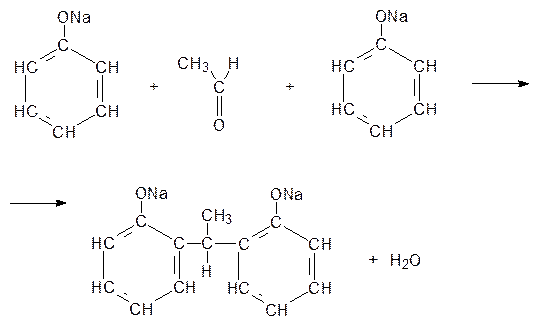Примеры решения задач. Пример 32.1.Чему равна степень полимеризации изобутилена при получении полиизобутилена с молекулярной массой 56280?
Пример 32.1.Чему равна степень полимеризации изобутилена при получении полиизобутилена с молекулярной массой 56280?
Решение.Полиизобутилен (полимер) получается реакцией полимеризации изобутилена (мономера), реакция представлена схемой:







Степень полимеризации nпоказывает, какое число молекул мономера вступает в реакцию полимеризации. Молекулярная масса изобутилена 56, средняя молекулярная масса полимера 56280. Следовательно, степень полимеризации
n = 56280 / 56 = 1005
Пример 32.2.Составить уравнение реакции сополимеризации бутена-1

стирола, входящих в состав макромолекул, находятся в соотношении 2:1.
Решение. Сополимеризация – это реакция полимеризации, в которой участвуют молекулы разных мономеров. В данном случае одним мономером является бутилен, другим стирол. Уравнение реакции сополимеризации имеет вид:


Пример 32.3. Составить схему реакции поликонденсации ацетальдегида с фенолятом натрия, считая, что на 2 моль фенолята натрия приходится 1 моль ацетальдегида.
Решение.Поликонденсация – это реакция синтеза полимера из мономеров, имеющих две или несколько функциональные группы, сопровождающаяся образованием низкомолекулярных продуктов (H2O, NH3 и др.)
Данная реакция поликонденсации может быть представлена схемой:
Задачи
№ 32.1. Для получения синтетического волокна “нитрон” в качестве мономера используют акрилонитрил CH2=CH–CN. Составить уравнение полимеризации этого мономера.
№ 32.2. Написать уравнение реакции полимеризации формальдегида и определить степень полимеризации в реакции получения полиформальдегида со средней молекулярной массой 45000. (Ответ: 1500).
№ 32.3. Написать уравнение реакции получения политетрафторэтилена (фторпласта-4) и определить среднюю молекулярную массу полимера, если степень полимеризации равна 1200. (Ответ: 120000).
№ 32.4. Составить уравнение реакции сополимеризации пропилена и изобутилена. Вычислить степень полимеризации, если полимер имеет молекулярную массу 160000. (Ответ: 1600).
№ 32.5. Составить уравнение реакции получения полихлорвинила, если в качестве исходного вещества взяли ацетилен.
№ 32.6. Муравьиный альдегид вступает в реакцию поликонденсации с мочевиной CO(NH2)2 и образует синтетическую карбамидную смолу. Написать уравнение реакции поликонденсации, считая, что на 2 моль мочевины необходим 1 моль формальдегида.
№ 32.7.Написать структурную формулу винилацетата. Привести схему полимеризации этого соединения.
№ 32.8. Привести схему сополимеризации акрилонитрила CH2=CH−СN и винилацетата.
№ 32.9. Привести схему получения полимера при реакции сополимеризации стирола и акрилонитрила.
№ 32.10. Написать структурную формулу метакриловой кислоты. Какое соединение получается при взаимодействии ее с метанолом? Написать уравнение реакции. Составить схему полимеризации образующегося продукта.
№ 32.11. Составить схему поликонденсации адипиновой кислоты C4H8(COOH)2 и гексаметилендиамина (NH2)2(CH2)6 .
№ 32.12. Как можно получить винилхлорид, имея карбид кальция, хлорид натрия, серную кислоту и воду? Написать уравнения соответствующих реакций. Составить схему полимеризации винилхлорида.
№ 32.13. Полимером какого непредельного диенового углеводорода является натуральный каучук? Написать структурную формулу этого углеводорода и реакцию его полимеризации.
№ 32.14. Составить схему сополимеризации бутадиена и стирола.
№ 32.15. Для получения синтетического волокна “энант” в качестве мономера используют аминоэнантовую кислоту NH2–(CH2)6–COOH. Составить схему поликонденсации аминоэнантовой кислоты.
№ 32.16. Составить схему сополимеризации изопрена и изобутилена.
№ 32.17. Написать уравнение реакции поликонденсации карбамида CO(NH2)2 с уксусным альдегидом, исходя из того, что с каждыми 3 моль карбамида вступают в реакцию 2 моль альдегида.
№ 32.18. При взаимодействии этилакриловой кислоты CH2=C(C2H5)–COOH с пропиловым спиртом C3H7OH образуется пропилэтилакрилат. Написать реакцию его получения и полимеризации. Какая масса полимера получится в результате реакции, если степень полимеризации равна 32? (Ответ: 4992).
№ 32.19. Написать уравнение реакции получения метилового эфира метакриловой кислоты и реакцию полимеризации его в полиметилметакрилат. Определить среднюю молекулярную массу полимера, если степень полимеризации равна 150. (Ответ: 13200).
№ 32.20. Волокно “лавсан” является продуктом поликонденсации терефталевой кислоты C6H4(COOH)2 и этиленгликоля. Соотношение между числом молекул терефталевой кислоты и этиленгликоля 2:1. Изобразить строение структурного звена этого полимера.
Лабораторная работа 33
Качественный анализ металлов
Цель работы: изучить качественные реакции на катионы металлов.
Задание: перевести исследуемые металлы в растворимое состояние и доказать наличие катионов определенных металлов с помощью специфическх качественных реакций. Выполнить требования к результатам работы, оформить отчет, решить задачу.
Качественный анализ – это совокупность химических, физико-химических и физических методов, применяемых для обнаружения компонентов, входящих в состав анализируемого вещества или смеси веществ. Методы качественного анализа в водных растворах сводятся к проведению химических реакций между ионами анализируемого вещества и прибавленных к ним реагентов (реактивов). Обычно проводят характерные реакции, которые могут быть замечены по какому-либо внешнему эффекту, например по образованию осадков, выделению газа, изменению окраски раствора или осадка и т.д.
Реагенты, применяемые в качественном анализе, делятся на групповые и специфические.
Специфическими реагентами называются такие реагенты, которые дают в определенных условиях характерную реакцию только с одним каким-либо ионом. Например, реактивом на ион Fe 3+ является раствор гексацианоферрата (II) калия (желтая кровяная соль), который образует с катионом Fe 3+ темно-синий осадок берлинской лазури:
Также для обнаружения ионов Fe 3+ используется роданид аммония (NH4SCN) или калия (KSCN), который образует с катионом Fe 3+ роданид железа Fe(SCN)3 кроваво-красного цвета.
Групповыми реагентами называются такие реактивы, которые дают аналогичные реакции с несколькими ионами. Ионы, одинаково относящиеся к групповому реагенту, называются ионами одной аналитической группы.
Существуют различные аналитические классификации катионов по группам. Для идентификации с помощью образования малорастворимых соединений наиболее распространенными являются кислотно-основная и сероводородная.
Кислотно-основная классификация основана на использовании в качестве групповых реагентов водных растворов кислот и щелочей. По этой классификации групповым реагентом на катионы Ca 2+ , Sr 2+ , Ba 2+ , Pb 2+ является раствор серной кислоты H2SO4, реже – растворимые сульфаты Na2SO4, K2SO4, (NH4)2SO4. Названные катионы образуют с групповым реагентом нерастворимые сульфаты МSO4 белого цвета.
Сероводородная классификация базируется на использовании групповых реагентов: растворов HCl; H2S; (NH4)2S и (NH4)2CO3.
Для ионов Ag + , Pb 2+ , Hg 2+ групповым осадителем служит HCl (образуются нерастворимые хлориды белого цвета); для ионов Ca 2+ , Sr 2+ , Ba 2+ – (NH4)2CO3 (получаются нерастворимые карбонаты МСО3 белого цвета); для ионов Al 3+ , Cr 3+ , Fe 3+ , Fe 2+ , Mn 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cd 2+ и др. – (NH4)2S. При действии группового реагента на ионы Fe 2+ , Co 2+ , Ni 2+ , Pb 2+ , Сu 2+ образуются нерастворимые сульфиды черного цвета, сульфид цинка ZnS белого цвета, CdS − желтый. Сульфиды алюминия, хрома (III), железа (III) подвергаются гидролизу, поэтому в водном растворе не образуются. Вместо сульфидов выделяются продукты их гидролиза − гидроксиды этих металлов и сероводород.
Дата добавления: 2015-09-11 ; просмотров: 6420 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Полимеризация пропилена: схема, уравнение, формула
Что представляет собой полимеризация пропилена? Каковы особенности протекания данной химической реакции? Попробуем найти развёрнутые ответы на эти вопросы.
Характеристика соединений
Схемы реакций полимеризации этилена и пропилена демонстрируют типичные химические свойства, которыми обладают все представители класса олефинов. Такое необычное название данный класс получил от старого названия масла, используемого в химическом производстве. В 18 веке был получен хлористый этилен, который представлял собой маслянистое жидкое вещество.
Среди особенностей всех представителей класса непредельных алифатических углеводородов отметим наличие в них одной двойной связи.
Радикальная полимеризация пропилена объясняется именно присутствием в структуре вещества двойной связи.
Общая формула
У всех представителей гомологического ряда алкенов общая формула имеет вид СпН2п. Недостаточное количество водородов в структуре объясняет особенность химических свойств этих углеводородов.
Уравнение реакции полимеризации пропилена является прямым подтверждением возможности разрыва по такой связи при использовании повышенной температуры и катализатора.
Непредельный радикал называется аллилом или пропенилом-2. Зачем проводится полимеризация пропилена? Продукт этого взаимодействия применяется для синтеза синтетического каучука, который, в свою очередь, востребован в современной химической промышленности.
Физические свойства
Уравнение полимеризации пропилена подтверждает не только химические, но и физические свойства данного вещества. Пропилен является газообразным веществом с невысокими температурами кипения и плавления. Данный представитель класса алкенов имеет незначительную растворимость воде.
Химические свойства
Уравнения реакции полимеризации пропилена и изобутилена показывают, что процессы протекают по двойной связи. В качестве мономеров выступают алкены, а конечными продуктами такого взаимодействия будут полипропилен и полиизобутилен. Именно углерод-углеродная связь при подобном взаимодействии будет разрушаться, и в конечном итоге будет образовываться соответствующие структуры.
По двойной связи происходит образование новых простых связей. Как протекает полимеризация пропилена? Механизм данного процесса аналогичен процессу, протекающему у всех остальных представителей данного класса непредельных углеводородов.
Реакция полимеризации пропилена предполагает несколько вариантов протекания. В первом случае процесс осуществляется в газовой фазе. По второму варианту реакция идет в жидкой фазе.
Кроме того, полимеризация пропилена протекает и по некоторым устаревшим процессам, предполагающим применение в качестве реакционной среды насыщенного жидкого углеводорода.
Современная технология
Полимеризация пропилена в массе по технологии Spheripol представляет собой совмещение суспензионного реактора для изготовления гомополимеров. Процесс предполагает применение газофазного реактора с псевдожидкостным слоем для создания блок-сополимеров. В подобном случае реакция полимеризации пропилена предполагает добавление в устройство дополнительных совместимых катализаторов, а также проведение предварительной полимеризации.
Особенности процесса
Технология предполагает перемешивание компонентов в специальном устройстве, предназначенном для предварительного превращения. Далее эту смесь добавляют в петлевые полимеризационные реакторы, туда поступает и водород, и отработанный пропилен.
Работа реакторов осуществляется при диапазоне температур от 65 до 80 градусов по Цельсию. Давление в системе не превышает 40 бар. Реакторы, которые располагаются последовательно, применяются на заводах, рассчитанных на большие объемы изготовления полимерной продукции.
Из второго реактора удаляют полимерный раствор. Полимеризация пропилена предполагает перенос раствора в дегазатор повышенного давления. Здесь осуществляется удаление порошкового гомополимера от жидкого мономера.
Производство блоксополимеров
Уравнение полимеризации пропилена CH2 = CH — CH3 в данной ситуации имеет стандартный механизм протекания, есть отличия только в условиях осуществления процесса. Вместе с пропиленом и этеном порошок из дегазатора идет в газофазный реактор, работающий при температуре около 70 градусов по Цельсия и давлении не больше 15 бар.
Блок сополимеры после выведения из реактора поступают в специальную систему отведения от мономера порошкообразного полимера.
Полимеризация пропилена и бутадиенов ударопрочного вида допускает использование второго газофазного реактора. Он позволяет увеличивать уровень пропилена в полимере. Кроме того, возможно добавление в готовый продукт добавок, использование гранулирования, способствует повышению качества получаемого продукта.
Специфика полимеризации алкенов
Между изготовлением полиэтилена и полипропилена есть некоторые отличия. Уравнение полимеризации пропилена позволяет понять, что предполагается применение иного температурного режима. Кроме того, некоторые различия существуют и в конечной стадии технологической цепочки, а также в областях использования конечных продуктов.
Пероксид используют для смол, которые обладают отличными реологическими свойствами. У них повышенный уровень текучести расплавов, сходные физические свойства с теми материалами, которые имеют низкий показатель текучести.
Смолы, имеющие отличные реологические свойства, применяют в процессе литьевого формования, а также в случае изготовления волокон.
Для повышения прозрачности и прочности полимерных материалов производители стараются добавлять в реакционную смесь специальные кристаллизирующие добавки. Часть полипропиленовых прозрачных материалов замещают постепенно иными материалами в области выдувного формования и создания литья.
Особенности полимеризации
Полимеризация пропилена в присутствии активированного угля протекает быстрее. В настоящее время применяется каталитический комплекс углерода с переходным металлом, основанный на адсорбционной способности углерода. В результате полимеризации получается продукт, имеющий отличные эксплуатационные характеристики.
В качестве основных параметров процесса полимеризации выступает скорость реакции, а также молекулярный вес и стереоизомерный состав полимера. Значение имеет и физическая и химическая природа катализатора, полимеризационная среда, степень чистоты составных частей реакционной системы.
Линейный полимер получается и в гомогенной, и в гетерогенной фазе, если идет речь об этилене. Причина заключается в отсутствии у данного вещества пространственных изомеров. Чтобы получить изотактический полипропилен, стараются использовать твердые хлориды титана, а также алюминийорганические соединения.
При применении комплекса, адсорбированного на кристаллическом хлориде титана (3), можно получать продукт с заданными характеристиками. Регулярность решетки носителя не является достаточным фактором для приобретения катализатором высокой стереоспецифичности. Например, в случае выбора иодида титана (3) наблюдается получение большего количества атактического полимера.
Рассмотренные каталитические компоненты имеют льюисовский характер, поэтому связаны с подбором среды. Самой выгодной средой является применение инертных углеводородов. Так как хлорид титана (5) является активным адсорбентом, в основном выбирают алифатические углеводороды. Как протекает полимеризация пропилена? Формула продукта имеет вид (-СН2-СН2-СН2-)п. Сам алгоритм реакции аналогичен протеканию реакции у остальных представителей данного гомологического ряда.
Химическое взаимодействие
Проанализируем основные варианты взаимодействия для пропилена. Учитывая, что в его структуре есть двойная связь, основные реакции протекают именно с ее разрушением.
Галогенирование протекает при обычной температуре. По месту разрыва сложной связи происходит беспрепятственное присоединение галогена. В результате данного взаимодействия образуется дигалогенпроизводное соединение. Труднее всего происходит йодирование. Бромирование и хлорирование протекает без дополнительных условий и энергетических затрат. Фторирование пропилена протекает со взрывом.
Реакция гидрирования предполагает использование дополнительного ускорителя. В качестве катализатора выступает платина, никель. В результате химического взаимодействия пропилена с водородом, образуется пропан – представитель класса предельных углеводородов.
Гидратация (присоединение воды) осуществляется по правилу В. В. Марковникова. Суть его состоит в присоединении по двойной связи атома водорода к тому углероду пропилена, который имеет его максимальное количество. При этом галоген будет прикрепляться к тому С, который имеет минимальное число водорода.
Для пропилена характерно горение в кислороде воздуха. В результате этого взаимодействия будет получаться два основных продукта: углекислого газа, водяного пара.
При действии на данное химическое вещество сильных окислителей, например, перманганата калия, наблюдается его обесцвечивание. Среди продуктов химической реакции будет двухатомный спирт (гликоль).
Получение пропилена
Все способы можно разделить на две основные группы: лабораторные, промышленные. В лабораторных условиях можно получить пропилен при отщеплении галогеноводорода от исходного галогеналкила при воздействии на них спиртового раствора гидроксида натрия.
Пропилен образуется при каталитическом гидрировании пропина. В лабораторных условиях данное вещество можно получить при дегидратации пропанола-1. В данной химической реакции применяют в качестве катализаторов фосфорную либо серную кислоту, оксид алюминия.
Как получают пропилен в больших объемах? В связи с тем, что в природе данное химическое вещество встречается редко, были разработаны промышленные варианты его получения. Самым распространенным является выделение алкена из продуктов нефтепереработки.
Например, осуществляется крекинг сырой нефти в специальном кипящем слое. Пропилен получают путем пиролиза бензиново фракции. В настоящее время выделяют алкен и из попутного газа, газообразны продуктов коксования угля.
Есть разнообразные варианты пиролиза пропилена:
- в трубчатых печах;
- в реакторе с применением кварцевого теплоносителя;
- процесс Лавровского;
- автотермический пиролиз по методу Бартломе.
Среди отработанных промышленных технологий необходимо отметить и каталитическое дегидрирование насыщенных углеводородов.
Применение
Пропилен имеет различные области применения, поэтому и производится в больших масштабах в промышленности. Своим появлением данный непредельный углеводород обязан работам Натты. В середине двадцатого века он, пользуясь каталитической системой Циглера, разработал технологию полимеризации.
Натта сумел получить стереорегулярный продукт, который был им назван изотактическим, поскольку в структуре метильные группы были расположены с одной стороны цепочки. Благодаря такому варианту «упаковки» полимерных молекул, получаемое полимерное вещество имеет отличные механические характеристики. Полипропилен используется для изготовления синтетического волокна, востребован в качестве пластической массы.
Примерно десять процентов нефтяного пропилена потребляется для производства его оксида. До середины прошлого века данное органическое вещество получали хлоргидринным методом. Реакция протекала через образование промежуточного продукта пропиленхлоргидрина. У такой технологии есть определенные недостатки, которые связаны с использованием дорогостоящего хлора и гашеной извести.
В наше время на смену этой технологии пришел халкон-процесс. Он основывается на химическом взаимодействии пропена с гидропероксидами. Применяют оксид пропилена в синтезе пропиленглиголя, идущий на изготовление пенополиуретанов. Они считаются отличными амортизирующими материалами, поэтому идут на создание упаковок, ковриков, мебели, теплоизоляционных материалов, сорбирующих жидкостей и фильтрующих материалов.
Кроме того, среди основных сфер применения пропилена необходимо упомянуть синтез ацетона и изопропилового спирта. Изопропиловый спирт, являясь отличным растворителем, считается ценным химическим продуктом. В начале двадцатого века этот органический продукт получали сернокислотным методом.
Кроме того, отработана технология прямой гидратации пропена с введением в реакционную смесь кислых катализаторов. Около половины всего производимого пропанола уходит на синтез ацетона. Данная реакция предполагает отщепление водорода, проводится при 380 градусах по Цельсия. Катализаторами в этом процессе выступают цинк и медь.
Среди важных отраслей применения пропилена особое место занимает гидроформилирование. Пропен идет на производство альдегидов. Оксисинтез в нашей стране стали использовать с середины прошлого века. В настоящее время эта реакция занимает важное место в нефтехимии. Химическое взаимодействие пропилена с синтез-газом (смесью угарного газа и водорода) при температуре 180 градусов, катализаторе оксиде кобальта и давлении в 250 атмосфер наблюдается образование двух альдегидов. Один имеет нормальное строение, у второго – изогнутая углеродная цепочка.
Сразу после открытия данного технологического процесса, именно эта реакция стала объектом исследований для многих ученых. Они искали способы смягчения условий ее протекания, старались снизить процентное содержание в получаемой смеси альдегида разветвленного строения.
Для этого были придуманы экономичные процессы, предполагающие применение иных катализаторов. Удалось снизить температуру, давление, увеличить выход альдегида линейного строения.
Эфиры акриловой кислоты, которые также связаны с полимеризацией пропилена, применяют в качестве сополимеров. Около 15 процентов нефтехимического пропена применяют в качестве исходного вещества для создания акрионитрила. Этот органический компонент необходим для изготовления ценного химического волокна – нитрона, создания пластических масс, производства каучуков.
Заключение
Полипропилен считают в настоящее время крупнейшим производством нефтехимии. Спрос на этот качественный и недорогой полимер растет, поэтому он постепенно вытесняет полиэтилен. Он незаменим при создании жесткой упаковки, пластин, пленок, автомобильных деталей, синтетической бумаги, канатов, ковровых деталей, а также для создания разнообразного бытового оборудования. В начале двадцать первого века производство полипропилена занимало второе место в полимерной промышленности. Учитывая запросы различных отраслей промышленности, можно сделать вывод: в ближайшее время сохранится тенденция масштабного производства пропилена и этилена.
Дайте определение эквивалента. Вычислите эквивалент элемента, если 1,5 г этого элемента вытеснили 1381,6 мл Н2. Какой это элемент?
111. Дайте определение эквивалента. Вычислите эквивалент элемента, если 1,5 г этого элемента вытеснили 1381,6 мл Н2. Какой это элемент?
Эквивалент (Э) – это реальная или условная частица вещества, которая может замещать, присоединять или выделять один ион водорода в кислотно-основных или ионообменных реакциях или один электрон в окислительно-восстановительных реакциях. Под «реальной частицей» понимают реально существующие соединения (КОН, H2SO4, Н2О), под «условной» – доли этих реальных частиц (½H2SO4, 1/5KMnO4). Эквивалент так же, как атом, молекула, ион – безразмерная величина и его состав выражают с помощью химических формул и символов. Количество вещества эквивалентов измеряется в молях. Масса 1 моль эквивалентов называется молярной массой эквивалентов (Мэк) и выражается в г/моль.
Задача решается по закону эквивалентов. Так как одно из реагирующих вещест находится в газообразном состоянии, то удобно воспользоваться формулой

Учитывая, что объем 1 моль эквивалентов водорода равен 11,2 л (н. у.), тогда
Мэк(Е) =
Умножая полученное число на валентность (1, 2, 3), находим, что искомый элемент-Магний
М(E)=Мэк(Е)*2 =24,3 г/моль.
185. Две цинковые пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. Какая из этих пластинок быстрее подвергается коррозии? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок.
Находим потенциалы восстановления цинка, олова и меди
Электрохимической коррозией называется разрушение металла в среде электролита, сопровождающееся возникновением внутри системы электрического тока. Электрохимическая коррозия протекает по механизму действия гальванического элемента. На поверхности металла одновременно протекают два процесса:
анодный – окисление металла М – nē ® Мn+
катодный – восстановление окислителя (Ох): Ох + nē ® Red.
Наиболее распространенными окислителями при электрохимической коррозии являются молекулы О2 воздуха и ионы водорода Н+ электролита, восстановление которых на катоде протекают по уравнениям:
О2 + 2Н2О + 4ē ® 4ОН– – в нейтральной или щелочной среде
2Н+ + 2ē ® Н2 – в кислой среде.
Одним из методов защиты металлов от коррозии является использование металлических покрытий. Различают катодные и анодные покрытия. Покрытие защищаемого металла менее активным металлом (металлом с более отрицательным значением потенциала) называется катодным.
Цинк имеет меньшее значение потенциала (–0,763 В), чем олово (–0,136 В) и медь (+0,337), поэтому он является анодом, а олово и медь – катодами. Следовательно, цинк растворяется, а на поверхности олова и меди идет восстановление деполяризатора: во влажном воздухе – с кислородной деполяризацией.
Анодный процесс: Zn – 2ē = Zn2+
Катодный процесс во влажном воздухе О2 + 2Н2О + 4ē ® 4ОН–
Так как процессы на электродах в обеих случаях одинаковы, то и скорость коррозии в обоих случаях будет одинаковой.
205. Составьте уравнение реакции полимеризации пропилена и изобутилена. Вычислите степень полимеризации, если сополимер имеет молекулярную массу 160000.
Сополимеризация — полимеризация, в которой участвуют два или несколько различных мономеров. В результате сополимеризации образуются сополимеры, макромолекулы которых состоят из двух или более разнородных структурных звеньев.
Молекулярная масса элементарного звена сополимера равна 98 .
http://fb.ru/article/289442/polimerizatsiya-propilena-shema-uravnenie-formula
http://pandia.ru/text/78/192/41043.php