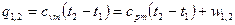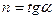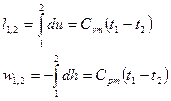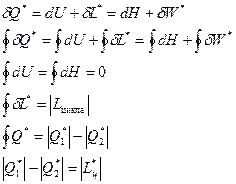Политропный процесс | 20+ важных часто задаваемых вопросов и числовых значений
Content
Политропный процесс
Определение политропный процесс
Политропное уравнение | Политропное уравнение состояния
Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Это метод постоянной удельной теплоемкости, при котором учитывается поглощение тепла газом из-за повышения температуры на единицу.
Политропный индекс
- п nd закон термодинамики. Эти частные случаи используются в тепловом взаимодействии для астрофизики и химической энергии.
- п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
- n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
- 1 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
- γ st закон термодинамики,
Политропный против изэнтропического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Изэнтропический процесс, также известный как обратимый адиабатический процесс, представляет собой идеальный процесс, в котором не происходит передача энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу. Т.к. теплопередача равна нулю. дQ = 0
Согласно первому закону термодинамики,
Политропный процесс против адиабатического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Адиабатический процесс — это особое и специфическое состояние политропного процесса, при котором.
Подобно изэнтропическому процессу, в этом процессе также не происходит передачи энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу.
Политропная эффективность
«Политропический КПД, точно определяемый как отношение идеальной работы сжатия для изменения перепада давления в многоступенчатом компрессоре к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре».
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
Политропная голова
Политропный напор можно определить как напор, создаваемый центробежным компрессором при политропном сжатии газа или воздуха. Величина развиваемого давления зависит от плотности сжатого газа, и это зависит от изменения плотности газа.
γ = индекс адиабаты
zсредний = Средний коэффициент сжимаемости
η = политропная эффективность
Pd = Давление нагнетания
Ps = Давление всасывания
S = удельный вес газа
Ts = Температура всасывания
Политропный процесс для воздуха | Политропный процесс для идеального газа
Считается, что воздух является идеальным газом, и поэтому законы идеального газа применимы к воздуху.
………………………. Соотношение между давлением [P] и объемом [V]
………………………. Связь между объемом [В] и температурой [Т]
………………………. Связь между давлением [P] и температурой [T]
Примеры политропных процессов
1. Рассмотрим политропный процесс с индексом политропы. п = (1.1). Начальные условия: P1 = 0, В1 = 0 и заканчивается на P2= 600 кПа, В2 = 0.01 м 3 . Оцените проделанную работу и теплоотдачу.
Ответ: Работы, выполненные политропным процессом, предоставлены
Теплопередача определяется выражением
2. Поршневой цилиндр содержит кислород при 200 кПа объемом 0.1 м. 3 и при 200 ° С. Масса добавляется так, чтобы газ сжимался с PV. 1.2 = постоянная до конечной температуры 400 ° C. Подсчитайте проделанную работу.
Ответ: Выполненная политропная работа определяется
3. Рассмотрим аргон при 600 кПа, 30 ° C, сжатый до 90 ° C в политропном процессе с n = 1.33. Найдите проделанную работу на Газе.
Ответ: Выполненная политропная работа определяется
для аргона при 30 ° C составляет 208.1 Дж / кг. K
Принимая m = 1 кг
4. Предположим, что масса 10 кг ксенона хранится в баллоне при 500 К, 2 МПа, расширение представляет собой политропный процесс (n = 1.28) с конечным давлением 100 кПа. Посчитайте проделанную работу. Учтите, что система имеет постоянную удельную теплоемкость.
Ответ: Выполненная политропная работа определяется
для ксенона при 30 ° C — 63.33 Дж / кг. K
Принимая m = 10 кг
5. Рассмотрим цилиндр-поршень с начальным объемом 0.3, содержащий 5 кг газообразного метана при давлении 200 кПа. Газ сжимают политропно (n = 1.32) до давления 1 МПа и объема 0.005. Рассчитайте теплопередачу во время процесса.
Ответ: Политропная теплопередача определяется
6. Примите во внимание цилиндр-поршень, содержащий 1 кг метана при 500 кПа, 20 ° C. Газ политропно сжимают до давления 800 кПа. Рассчитайте теплопередачу с показателем n = 1.15.
Ответ: Политропная теплопередача определяется
Мы знаем, что R для метана = 518.2 Дж / кг. K
7. 1 кг гелия хранится в системе поршень-цилиндр при 303 К, 200 кПа сжимается до 400 К в обратимом политропном процессе с показателем степени n = 1.24. Гелий является идеальным газом, поэтому удельная теплоемкость будет фиксированной. Найдите работу и теплопередачу.
Ответ: Выполненная политропная работа определяется
R для гелия составляет 2077.1 Дж / кг.
Политропная теплопередача определяется выражением
8. Предположите, что воздух хранится в баллоне объемом 0.3 литра при 3 МПа, 2000 К. Воздух расширяется в соответствии с обратимым политропным процессом с показателем степени n = 1.7, объемное соотношение в этом случае составляет 8: 1. Рассчитайте политропную работу для процесса и сравните ее с адиабатической работой, если процесс расширения следует за обратимым адиабатическим расширением.
Ответ: Нам дается
Соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
Проделанная адиабатическая работа определяется выражением
Для процесса расширения Работа, выполняемая посредством обратимого адиабатического процесса, больше, чем Работа, выполняемая посредством обратимого политропного процесса.
9. В закрытом контейнере содержится 200 л газа при 35 ° C, 120 кПа. Газ сжимается в политропном процессе до температуры 200 ° C, 800 кПа. Найти политропную работу, совершаемую воздухом для n = 1.29.
Ответ: соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
10. Масса 12 кг газообразного метана при 150 ° C, 700 кПа подвергается политропному расширению с n = 1.1 до конечной температуры 30 ° C. Найти теплопередачу?
Ответ: Мы знаем, что R для метана = 518.2 Дж / кг. K
Политропная теплопередача определяется выражением
11. Узел цилиндр-поршень содержит R-134a при 10 ° C; объем 5 литров. Охлаждающая жидкость сжимается до 100 ° C, 3 МПа в соответствии с обратимым политропным процессом. рассчитать проделанную работу и теплоотдачу?
Ответ: Мы знаем, что R для R-134a = 81.49 Дж / кг. K
Выполненная политропная работа определяется выражением
Политропная теплопередача определяется выражением
12. Является ли политропный процесс изотермическим по своей природе?
Ответ: Когда n становится 1 для политропного процесса: согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
13. Обратим ли политропный процесс?
Ответ: политропные процессы внутренне обратимы. Вот несколько примеров:
п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV γ = C представляет собой постоянную температуру или изотермический процесс.
п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
n = Бесконечность: Представляет собой изохорный процесс или процесс постоянного объема.
14. Адиабатический политропный процесс?
Ответ: когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
14. Что такое политропная эффективность?
Ответ: Политропический КПД можно определить как отношение идеальной работы сжатия к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре. Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
15. Что такое гамма в политропном процессе?
Ответ: В политропном процессе, когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
16. что такое политропный процесс?
Ответ: Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Его также называют процессом с постоянной удельной теплотой, при котором тепло, поглощаемое газом, учитываемое из-за повышения температуры на единицу, является постоянным.
17. Какие выводы можно сделать для политропного процесса с n = 1?
Ответ: когда п = 1: PV n = C : Согласно предположению об идеальном газе, закон становится PV = C представляет собой постоянную температуру или изотермический процесс.
18. Что такое неполитропный процесс?
Ответ: Политропный процесс можно определить уравнением PV n = C показатель степени n называется индексом политропы. Когда,
- п 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа PV γ = C представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
- γn0). Как и в циклах сжатия пара, тепло теряется в горячее окружение. Изменение температуры происходит из-за изменения внутренней энергии, а не подводимого тепла. Произведенная работа превышает количество поданного или добавленного тепла. Таким образом, даже если при политропном расширении добавляется тепло, температура газа снижается.
21. В политропном процессе, когда PV n = константа, температура тоже постоянна?
Ответ: В политропном процессе, когда PV n = постоянная, температура остается постоянной только при показателе политропы n = 1. Для n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
Аналитическое выражение первого начала термодинамики
Вопрос № 1.Метод и законы.
Теоретической основой теплотехники являются термодинамика и теплопередача.
Термодинамика— наука, изучающая законы превращения энергии и особенности процессов этих превращений.
В основу термодинамики положены основные законы или начала.
1НТ характеризует собой количественное выражение закона сохранения и превращения энергии: «энергия изолированной системы при всех изменениях происходящих в системе сохраняет постоянную величину».
2НТхарактеризует качественную сторону и направленность процессов, происходящих в системе. Второе начало термодинамики отражает принципы существования абсолютной температуры и энтропии, как функций состояния, и возрастания энтропии изолированной термодинамической системы. Важнейшим следствием второго начала является утверждение о невозможности осуществления полных превращений теплоты в работу.
3НТ (закон Нерста) гласит о том, что при абсолютном нуле температур все равновесные процессы происходят без изменения энтропии.
Метод термодинамики заключается в строгом математическом развитии исходных постулатов и основных законов, полученных на основе обобщения общечеловеческого опыта познания природы и допускающих прямую проверку этих положений во всех областях знаний
Система–тело или совокупность тел, нах-ся в мех.и тепл.взаимодействии
Системы делятся на закрытые и открытые системы.
Закрытая система–система, в которой количество вещества остаётся постоянным при всех происходящих в ней изменениях.
Закрытые системы делятся на изолированные и неизолированные системы.
Изолированная система – система, у которой нет энергетического взаимодействия с внешней средой.
Гомогенная— система, состоящая из одной фазы вещества или веществ.
Однородная— гомогенная система, неподверженная действию гравитационных, электромагнитных и других сил и имеющая во всех своих частях одинаковые свойства.
Гетерогенная— система, состоящая из нескольких гомогенных частей (фаз), отделенных поверхностью раздела.
Равновесным состояниемсистемы-состояние системы, которое может существовать сколь угодно долго при отсутствии внешнего воздействия.
Термодинамическая система – объект изучения термодинамики – система, внутреннее состояние которой может быть описано 
Простое тело – тело, у которого два параметра состояния.
Идеальный газ – тело, у которого один параметр состояния.
Вопрос №2.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные и экстенсивные.
Интенсивные свойства не зависят от массы системы, а экстенсивные — пропорциональны массе.
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы.
1. 
2. 
3. 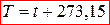
Уравнение состояния для простого тела- 
Термодинамический процесс – непрерывная последовательность равновесных состояний.
Уравнение термодинамического процесса – уравнение вида 
Внутренняя энергия – полный запас энергии, определяемый внутренним состоянием. 
Удельная энергия — 

Элементарное изменение внутренней энергии — 
Количество теплоты — 

Удельная теплота — 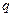

Элементарное количество теплоты — 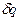
Теплообмен – процесс передачи энергии путём передачи теплоты.
Термодинамическая работа – работа, вызванная изменением объёма, 
Удельная работа — 
Вопрос №3.
Термодинамич.работа: 


Удельная работа: 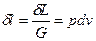


Если 





Если рассматривать малое изменение объёма, то давление при этом изменении практически не изменяется.


1. В случае если 

2. В случае если дано уравнение процесса — 


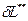
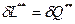
Потенциальная работа – работа, вызываемая изменением давления.
Если 



Если рассматривать малое изменение давления, то объём при этом изменении практически не изменяется.


1. В случае если 

2. В случае если дано уравнение процесса — 



Вопрос №4 Теплоёмкость.
теплоёмкость–количество тепла,которое надо сообщить еденице массы,количества или объема вещества,чтобы его температура повысилась на 1 градус.
Истинная теплоемкость: 






Объёмная теплоёмкость 
· Объемная изобарная теплоёмкость — 
· Объёмная изохорная теплоёмкость — 
Молярная теплоёмкость 
· Молярная изобарная теплоёмкость — 
· Молярная изохорная теплоёмкость — 
Средняя теплоёмкость 
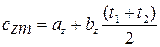
Вопрос №5
Первое начало термодинамики – это количественное выражение закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой».
Математическое выражение первого начала термодинамики.
Внутренняя энергия изолированной системы сохраняет своё постоянное значение при всех изменениях, протекающих внутри системы, то есть 

Первое начало термодинамики по внешнему балансу: 


В термодинамике приняты следущие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное значение; если теплота отводится от тела, она имеет отрицательное значение.
Вопрос №6
Первое начало термодинамики по балансу рабочего тела: 



Первое начало термодинамики по балансу рабочего тела справедливо для любых процессов протекающих в системе.
В условиях обратимого процесса, то есть 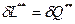


Вопрос №7.
Аналитическое выражение первого начала термодинамики
Значения удельных внутренней энергии и энтальпии простого тела однозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:

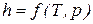
Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями


Для изохорного процесса ( 

а для изобарного процесса ( 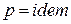

В результате подстановки выражений (1) и (2) в уравнение 

Данное соотношение (5) называется первым началом термодинамики для простых тел в аналитической форме.
Первое начало термодинамики для идеального газа.
Идеальный газ – система, которая подчиняется уравнению Менделеева-Клаперона: 

Первое начало термодинамики для простого тела: 




Получили закон Майера: 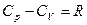
Универсальная газовая постоянная 
Разделим первое начало термодинамики на 
Энтропия 

Удельная энтропия 

Энтропия, как и время, всё время возрастает. Только в изолированной системе энтропия может оставаться постоянной.
При давлении 








Уравнение, определяющее энтропию:
Адиабатный процесс— термодинамический процесс изменения состояния системы, при котором отсутствует теплообмен 

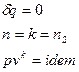
Первое начало термодинамики: 


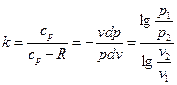



Для идеального газа: 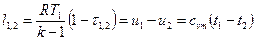
Так как 

Для идеального газа:
Первое начало термодинамики: 




Изобарный и изохорный процессы.
Если 
Так как 
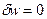
Для идеального газа:
Первое начало термодинамики: 
Для идеального газа: 

Политропным процессом с постоянным показателем называется обратимый термодинамический процесс изменения состояния простого тела.
Уравнение политропного процесса с постоянным политропным показателем: 
где 
Это значит, что постоянный показатель политропы определяется соотношением потенциальной и термодинамической работ в элементарном или конечном процессах.
Показателем политропного процесса является линейная зависимость 


1.
2. 

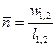
Если 
При этом политропный показатель может принимать значения в пределах от минус бесконечности до плюс бесконечности и оставаться постоянным в течение процесса. Если 










Если уравнением процесса является уравнение 


Для идеального газа 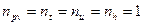

Работа: 

Характеристика растяжения (сжатия).





Для адиабатического процесса 
Все уравнения для политропного процесса остаются справедливы и для адиабатического процесса, только вместо политропного показателя используют адиабатический показатель.
Для идеального газа 
Выражения конечных (интегральных) величин термодинамической и потенциальных работ в политропных процессах можно получить при сопоставлении их элементарных значений:


После подстановки выражения для показателя политропы 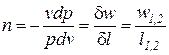


Интегрируя последнее выражение (4) с учетом того, что процесс подчиняется уравнению политропы с постоянным показателем (n=idem), получаем следующее соотношение для определения удельной термодинамической работы в конечном процессе (1-2)

Теплообмен в любом термодинамическом процессе изменения состояния простых тел может быть выражен в зависимости от величины термодинамической или потенциальной работы процесса. При этом термодинамический процесс в общем случае рассматривается как политропа с переменным показателем.
Расчетное выражения теплообмена для простых тел выводится на основе рассмотрения выражения первого начала термодинамики

Удельная внутренняя энергия для простых тел может быть представлена в виде функции любых двух независимых параметров состояния. Примем, что u =и (p, v). Тогда дифференциал внутренней энергии запишется в следующем виде:

Последнее выражение (2) можно представить в виде

Введем следующие обозначения:


При этом выражение (3) примет вид:
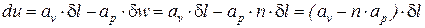
Сопоставляя соотношения (1) и (5), получим

Для определения величин ( 

1. Изоэнергетический процесс (u = idem, du = 0). Для этого процесса показатель политропы принимает значение n = nu.
Так как в изоэнергетическом процессе 

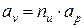
2. Адиабатный процесс(d q = 0). В этом процессе показатель политропы принимает значение n = k и называется показателем адиабаты.
В адиабатном процессе элементарная термодинамическая работа также не равна нулю, поэтому из выражения (6) имеем

Сопоставляя соотношения (7) и (8), получаем следующие выражения:


С учетом полученных соотношений для определения av и ap, находим выражения для расчета удельных значений изменения внутренней энергии и теплообмена в элементарном процессе:


Соотношения для расчета удельных значений изменения внутренней энергии и теплообмена в конечном процессе имеют следующий вид:


При изучении процессов изменения состояния идеальных газов, наряду с общими соотношениями по расчету термодинамических
процессов,следует использовать уравнение Клапейрона 
и закон Джоуля 

если 




Из уравнений (1)¸(4) следует, что для идеального газа процессы изопотенциальный (pv =idem), изотермический (T = idem), изоэнергетический (u= idem) и изоэнтальпийный (h = idem) тождественны и, следовательно, показатели этих процеcсов равны

Характеристика расширения или сжатия процессов, в которых рабочим телом является идеальный газ, с учетом уравнения Клапейрона может быть определена по соотношению температур


Изменения удельных значений внутренней энергии и энтальпии идеального газа в процессе в соответствии с законом Джоуля находится по следующим формулам:
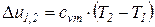

Показатель адиабатного процесса для идеального газа определяется как соотношение изобарной и изохорной теплоемкостей
k = ns = 



На основании закона Майера ( 
k = 

Для идеального газа показатель изоэнергетического процесса 

Круговой процесс – процесс, который характеризуется возвратом в исходное состояние системы (рабочего тела).



Циклы – периодически повторяющиеся в тепловых машинах круговые процессы.
Если круговой процесс идёт по часовой стрелке это означает, что по верхней дуге тепло подводится, а по нижней отводится. Такой процесс называется прямым и реализуется в тепловых машинах.

Различают три вида циклов тепловых машин: реальные, обратимые и термодинамические.
В реальных циклах тепловых машин имеют место внешняя и внутренняя необратимости.
Внешняя необратимость определяется конечной разностью температур между рабочим телом и источниками теплоты. Этим объясняется то, что реальный цикл теплового двигателя располагается внутри границ температур внешних источников, а реальный цикл холодильной машины — вне границ температур внешних источников .
Внутренняя необратимость обусловлена потерями энергии, связанными с трением, завихрениями и т.д. в процессах цикла.
В обратимых циклах тепловых машин отсутствует внешняя и внутренняя необратимости.
В термодинамических циклах тепловых машин, в отличие от реальных и обратимых циклов, рассматривается не вся система, включающая внешние источники теплоты, а только рабочее тело. При этом в процессах термодинамических циклов отсутствует внутренняя необратимость, то есть все процессы таких циклов являются обратимыми.
Эффективность любого реального теплового двигателя определяется коэффициентом полезного действия (КПД).
Коэффициент полезного действия реальных циклов тепловых двигателей численно равен отношению полученной работы к подведенному извне количеству теплоты
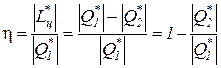
Для обратимого цикла теплового двигателя КПД определяется следующим образом:
h обр = 
Термический коэффициент полезного действия термодинамического цикла теплового двигателя находится из соотношения


Эффективность циклов холодильных машин оценивается холодильным коэффициентом ( 
Для реального цикла холодильной машины холодильный коэффициент определяется соотношением

для обратимого цикла холодильной машины – из зависимости

а для термодинамического цикла холодильной машины – по соотношению
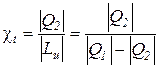
1. Состоит из двух изотерм и двух адиабат.
2. Рабочее тело – идеальный газ.
3. Величины 

1-2, 3-4 – изотермические процессы.



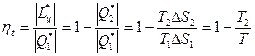
Подвод теплоты от горячего источника производится на изотерме 1-2 при температуре Т1, при этом рабочее тело — идеальный газ расширяется и совершается полезная работа. В процессе дальнейшего расширения по адиабате 2-3 до температуры Т2 также совершается полезная работа. Для осуществления последующих процессов — сжатия 3-4 по изотерме Т2 с отводом теплоты к холодному источнику и адиабатного сжатия 4-1 до начальной температуры Т1 работа затрачивается.
Термодинамический коэффициент полезного действия 


4 Анализ политропных процессов идеальных
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
4 Анализ политропных процессов идеальных
4.1 Особенности политропных процессов
Политропными называются процессы с постоянной теплоёмкостью. В каждом из этих процессов рабочее тело может иметь любое значение теплоёмкости 
При изучении политропных процессов используются термодинамические законы, формулы для определения теплоты, работы, изменения энтропии и внутренней энергии в процессах, а также уравнение состояния идеального газа.
Для определения уравнения политропного процесса, связующего переменные параметры состояния, используются формулы, определяющие энергетический баланс в соответствии с первым законом термодинамики:




После деления (4.1) на (4.2) и замены 


Показатель политропы n может принимать любое числовое значение.
В результате интегрирования и последующего потенцирования уравнения (4.3) определяется взаимосвязь между давлением и удельным объёмом в политропном процессе:

Если по уравнению состояния произвести замену 
удельным объёмом в политропном процессе:
Aналогично определяется взаимосвязь в политропном процессе между температурой и давлением:

В политропном процессе 1-2 соотношения между начальными и конечными значениями параметров определяются из выражений (4.4 — 4.6):

Удельная теплота политропного процесса равна

где теплоёмкость политропного процесса определяется из выражения


где
Удельная работа политропного процесса равна
Учитывая, что 

Изменение удельной внутренней энергии в политропном процессе определяется по формуле

Изменение удельной энтропии в политропном процессе равно


При известных параметрах в начале и конце процесса 1-2 показатель
политропы определяется из соотношения

з последнего выражения следует, что в логарифмических координатах “давление — удельный объём” (рисунок 4.1) политропа изображается прямой линией, а показатель политропы n численно равен тангенсу угла наклона этой линии
4.2 Частные политропные процессы
Термодинамический процесс, в котором объем рабочего тела остаётся постоянным, называется изохорным . В диаграммах p-v и T-s этот процесс показан на рисунке 4.2 . Здесь же показаны схемы трансформации энергии при изохорном нагреве (а) и изохорном охлаждении (б) вещества. Показатель политропы в изохорном процессе 
Так как в этом процессе объём не изменяется, работа процесса равна нулю (
Уравнение первого закона термодинамики для изохорного процесса имеет вид:

Удельная теплота изохорного процесса

Соотношение между параметрами в изохорном процессе

Изменение удельной энтропии в данном процессе

сли принять показатель n=0, уравнение политропы 
При нагревании часть передаваемой рабочему телу теплоты идёт на увеличение внутренней энергии, а часть — на совершение работы расширения. При охлаждении отведённая теплота численно равна сумме уменьшения внутренней энергии и работе сжатия.
Соотношение между начальными и конечными изменяющимися параметрами состояния в изобарном процессе

Удельная теплота изобарного процесса

Удельная работа изобарного процесса определяется из выражения (4.10) при n=0:

где р = р 1 = р 2 .
Изменение удельной внутренней энергии в данном процессе, как и в любом политропном, определяется по формуле (4.11).
Уравнение первого закона термодинамики применительно к изобарному процессу имеет такой вид:

При дифференцировании уравнения состояния
ввиду постоянства p и R получается равенство pdv=RdT. С учётом этого, выражение (4.22) имеет вид

а после сокращений:

Последнее выражение, отражающее взаимосвязь между теплоёмкостями и газовой постоянной, называют уравнением Майера . Оно свидетельствует о том, что изобарная теплоёмкость идеального газа больше изохорной теплоёмкости на величину газовой постоянной.
Для изобарного процесса справедливо равенство:
q=dh , 
что гласит: в изобарном процессе теплота процесса численно равна разности конечной и начальной энтальпий. Это следует из сопоставления уравнений первого закона термодинамики и энтальпийного выражения при условии dp=0 :
В термодинамическом процессе с показателем политропы n=1 характеристическое уравнение имеет вид
Для идеального газа pv = RT, поэтому в рассматриваемом процессе температура постоянна. Процесс с постоянной температурой называется изотермическим .
В изотермическом процессе 1-2, показанном на рисунке 4.4, внутренняя энергия не изменяется, так как в идеальных газах её изменение однозначно определяется изменением температуры. Соотношение между начальными и конечными параметрами в этом процессе

Рисунок 4.4

Теплоёмкость изотермического процесса

поэтому использовать для определения теплоты формулу (1.7), включающую теплоёмкость, в этом процессе нельзя. Так как в изотермическом процессе теплота численно равна работе, достаточно иметь расчётную формулу работы.
Удельная работа изотермического процесса равна
Окончательно при

Изменение энтропии в изотермическом процессе

Рисунок 4.5
и называется показателем адиабаты .
Так как в соответствии с уравнением Майера (4.23) изобарная теплоёмкость больше изохорной, показатель адиабаты всегда больше единицы. В расчётах с небольшой точностью обычно принимают следующие значения:
для одноатомных газов k= 1,69 ;
для двухатомных газов k=1,41;
для многоатомных газов k=1,33 .
Уравнение первого закона термодинамики применительно к адиабатному процессу имеет вид:

Уравнения адиабатного процесса, связывающие переменные параметры состояния, получаются из выражений (4.4 – 4.6) при замене n на k :

Из уравнений (4.30) выводятся соотношения между параметрами:

Изменение удельной внутренней энергии в адиабатном процессе 1-2 составляет:

С учетом равенства (4.29) удельная работа адиабатного процесса

Удельная работа может быть определена также по формуле (4.10) при замене n на k :

4.3 Круговые диаграммы политропных процессов
Рисунок 4.6
Так как в идеальных газах увеличению температуры соответствует рост внутренней энергии, а уменьшению температуры — снижение внутренней энергии, в диаграмме T- s все процессы над изотермой (n=1), включая адиабатное сжатие (n=k), изохорный нагрев (n=± ) и изобарное расширение (n=0) , происходят с увеличением внутренней энергии (du>0). Процессы в противоположном секторе, включающем адиабатное расширение (n=k), изохорное охлаждение (n= ) и изобарное охлаждение (n=0 ), протекают с уменьшением внутренней энергии (du
Сектор диаграммы, в котором все процессы происходят с подводом теплоты, определяется по положительному приращению энтропии ds>0 , а в противоположном секторе, где все процессы протекают с отводом теплоты, энтропия рабочего тела уменьшается ds . Сектор с подводом теплоты в процессах включает изохорный нагрев (n= ), изобарное расширение (n=0) и изотермическое расширение (n=1), а сектор, в котором процессы происходят с отводом теплоты, включает изохорное охлаждение (n= ), изобарное сжатие (n=0) и изотермическое сжатие газа (n=1).
С помощью круговых диаграмм можно проводить качественный анализ термодинамических политропных процессов. Например, для политропного процесса сжатия 0-А по диаграммам можно определить, не производя расчетов, следующее:
процесс происходит с отводом теплоты ( q ) и увеличением внутренней энергии du>0 ;
несмотря на отвод теплоты, температура газа возрастает;
учитывая взаимосвязь между теплотой, работой и изменением внутренней энергии, определяемую уравнением первого закона термодинамики, схема трансформации энергии будет такой:
работа процесса больше теплоты, так как часть работы преобразуется во внутреннюю энергию рабочего тела.
Ещё пример. В процессе расширения О-D с показателем политропы n=-100 теплота подводится, внутренняя энергия газа увеличивается, причём это увеличение равно разности теплоты и работы. Можно сказать также, что в этом процессе расширения температура газа возрастает.
5 Процессы течения идеальных газов
5.1 Преобразование энергии в потоке газа
В технике много машин и двигателей, в которых происходят процессы течения газа с трансформацией энергии потока. Течение газа может происходить в цилиндрических трубах, через отверстия или в специально спроектированных каналах.
Каналы, в которых происходит увеличение кинетической энергии и снижение потенциальной энергии потока, называются соплами . В сопловых каналах давление газа или пара снижается, а скорость возрастает.
Каналы, в которых кинетическая энергия газа уменьшается, а потенциальная возрастает, называются диффузорами . В диффузорах давление увеличивается, а скорость потока уменьшается.
Уравнение первого закона термодинамики для потока (2.5), при отсутствии технической работы и нулевом изменении потенциальной энергии в поле гравитационных сил, приобретает следующий вид:

В 

Так как

Рисунок 5.1
где 
Термин “работа” здесь несколько условен, точнее — произведение объёма на приращение давления есть изменение потенциальной энергии. Предполагается, что эта потенциальная энергия при течении газа по соплу, в соответствии с выражением (5.3), превратится в кинетическую, которая затем на лопатках турбины преобразуется в работу перемещения ротора турбины.
Процесс адиабатного расширения газа в потоке изображается на диаграмме p — v (рисунок 5.1) линией 1-2 . Площадь а-1-2-в по смыслу выражения

представляет собой располагаемую работу процесса .
При известных начальных и конечных параметрах состояния располагаемая работа определяется по следующей формуле 
При сравнении формул (5.5) и (4.34) видно, что располагаемая работа в к раз больше работы изменения объёма:

5.2 О форме сопел и диффузоров.
В формулировках сопел и диффузоров не оговаривается возможная геометрия этих каналов. Это не случайно, так как их продольный профиль зависит от условий течения газа, о чём пойдёт речь ниже.
Одним из уравнений, определяющих физико-математическую модель процесса течения газа, является уравнение неразрывности (сплошности):
где М — массовый секундный расход газа, — удельный объем газа, — скорость потока, А — площадь поперечного сечения канала
Смысл уравнения сплошности заключается в том, что массовое количество газа, проходящего в единицу времени одинаково для любого поперечного сечения канала; при переходе от одного сечения канала к другому масса газа не может увеличиться или уменьшиться.
В дифференциальном виде при М = Const (массовый расход газа через любое поперечное сечение канала одинаков) уравнение (5.7) выглядит так:
d(Mv)=d( A) и Mdv= dA+Ad (5.8)
После деления (5.8) на (5.7) получается

Из дифференциального уравнения адиабаты


а из уравнения располагаемой работы (5.3) получается

После подстановки из уравнений (5.10) и (5.11) уравнение (5.8) имеет вид

Из школьного курса физики известно, что скорость звука определяется выражением

C учётом этого формула (5.12) записывается так:

Приращение dA в формуле (5.14) может быть как положительным, так и отрицательным. Это зависит от знака приращения dp и величины, заключенной в скобках. Знак “минус” перед dA означает, что площадь поперечного сечения должна уменьшаться, а положительному приращению dA должно соответствовать расширение канала.
В соответствии с формулировками, для сопла dp а для диффузора dp>0 . Когда скорость потока меньше скорости звука, величина, заключенная в скобках, всегда положительна, потому что скорость, давление и показатель адиабаты не могут быть отрицательными; если же поток движется со сверхзвуковой скоростью, то она отрицательна.
Таблица 5.1
Знак
Из таблицы 5.1следует:
— когда скорость газа на входе в канал меньше местной (то есть в данном сечении канала) скорости звука, сопло должно быть суживающимся, а диффузор — расширяющимся;
если скорость потока во входном сечении канала превышает местную скорость звука, то сопло должно быть расширяющимся, а диффузор суживающимся.
5.3 Истечение газа из суживающегося сопла
При изучении этого процесса предполагается, что истечение происходит при постоянных параметрах газа на входе в сопло и на выходе из него.
Пусть давление cреды, откуда происходит истечение, равно 


С

Рисунок 5.2
Сложность при использовании формулы (5.15) заключается в том, что энтальпия газа на выходе из сопла, как правило, неизвестна, и её определение требует дополнительных расчётов. Более удобной представляется формула, в которой были бы задействованы начальные параметры и перепад давлений до и после сопла. Для получения такой формулы используются выражения (5.3-5.5), откуда

и, при условии 

Дальнейшие преобразования будут относиться к выражению, заключенному в скобки под корнем:
Если отношение давлений обозначить 

Для определения массового расхода газа используется уравнение сплошности применительно к выходному сечению площадью 

Для удаления из формулы удельного объёма в выходном сечении производятся следующие преобразования:

После подстановки полученного фрагмента в формулу (5.18), получается:

На основании формул (5.17) и (5.20) на рисунке 5.3 построены графические зависимости скорости истечения и массового расхода газа в суживающемся сопловом канале.
П
По мере уменьшения скорость потока в выходном сечении возрастает, и при = 0 , что соответствует истечению в вакуумированное пространство, она достигает максимума:

Рисунок 5.3
Проведенные эксперименты по изучению процесса истечения газа показали, что формулы (5.17) и (5.20) справедливы в диапазоне изменения от единицы до некоторого значения, соответствующего максимальному расходу газа и точке перегиба кривой 
Для выяснения появившегося несоответствия между теорией и практикой следует вначале определить, от чего зависит и чему равно значение 

Последнее выражение можно представить в таком виде

Из формулы (5.23) следует, что критическое отношение давлений зависит только от показателя адиабаты и, с учётом ранее принятых числовых значений показателей адиабаты, составляет для одноатомных газов — 0,485, для двухатомных — 0,527 и для многоатомных — 0,545.
Дальнейший анализ сводится к более подробному изучению факторов, влияющих на выходную скорость газа. Из исходной формулы (5.16) находится зависимость скорости потока от критических параметров газа в выходном сечении сопла:

После замены 

Если в выражение (5.25) подставить значение критического отношения давлений из формулы (5.23), то, после сокращений, оно предстанет в таком виде:

где 
Рисунок 5.4
Пока отношение давлений больше критического 





Уменьшение давления в приёмной среде при постоянном начальном давлении ведёт к увеличению градиента давления и выходной скорости потока. Это продолжается до тех пор, пока в устье сопла не установится критический режим, когда скорость потока оказывается равной местной скорости звука. Дальнейшее понижение давления в приёмной среде (противодавления) не приводит к перераспределению давлений по длине сопла и увеличению градиента давления, так как волны давления перемещаются именно со скоростью звука. Можно сколь угодно понижать давление 

Изменение скорости потока, местной скорости звука и давления по длине соплового канала в различных режимах течения газа показано на рисунке 5.4 .
В докритической области формулы (5.17) и (5.20) для определения скорости истечения и массового расхода используются без всяких оговорок. В критическом режиме эти формулы также справедливы при условии, что в них будет присутствовать значение 
Для определения скорости в закритическом режиме в формулу (5.17) следует подставлять значение 


где удельный объём 

5.4 Сопло Лаваля
Д
ля получения сверхзвуковых скоростей при истечении газа или пара применяются комбинированные сопла, состоящие из суживающейся части и расширяющегося патрубка.
Рисунок 5.5
Чтобы в процессе расширения не происходил отрыв потока от стенок, и во избежание нежелательного вихреобразования, угол конусности в расширяющейся части сопла Лаваля обычно принимается равным 8-12 . Правильным подбором длины расширяющегося насадка можно добиться полного преобразования потенциальной энергии газа в кинетическую.
Изменение скорости потока , местной скорости звука а и давления р по длине сопла Лаваля представлено на рисунке 5.5 . Так как в сопловом канале Лаваля происходит расширение газа при полном использовании перепада давления, скорость потока в выходном сечении определяется по формуле (5.17) при действительном значении . Массовый расход газа здесь определяется пропускной способностью минимального сечения, в котором установились критические условия, поэтому в формулу массового расхода (5.20) следует подставлять критическое отношение давлений 
Так как массовый расход газа одинаков и в минимальном, и в выходном сечениях, можно записать


Длина расширяющейся части круглого сопла Лаваля определяется из соотношения
где ОА=(D-d)/2. , D — диаметр выходного сечения сопла, d — диаметр минимального сечения сопла.
Благодаря разработке теории комбинированных сопел, когда стало возможным эффективно использовать пар высокого давления, мощный толчок получило судовое турбостроение, и в конце 19 — начале 20 века стали эксплуатироваться турбинные установки мощностью в десятки и сотни тысяч киловатт.
5.5 Нерасчётные режимы истечения газа из сопел
Изменение давления в среде, откуда происходит истечение, так же как и изменение противодавления при течении газа в суживающемся сопле, отражается на скорости истечения в соответствии с закономерностями, выясненными выше в п.5.3. При нерасчётных режимах никаких сложностей и новых особенностей здесь не возникает.
В канале Лаваля, предназначенном для работы в условиях закритического течения газа, изменение противодавления в сторону увеличения приводит к тому, что в некотором сечении х – х расширяющейся части сопла давление газа р х становится меньше противодавления р 2 (точка 2 на рисунке 5.6), в связи с чем следует резкое повышение давления газа (процесс 2-3). Такой процесс повышения давления называется скачком давления .
После скачка давления скорость течения газа становится сразу дозвуковой. Участок сопла за сечением х – х начинает работать как диффузор, в котором давление возрастает по линии 3-4.
Рисунок 5.6
Пояснить случившееся можно, проанализировав следующую ситуацию. Если на пути потока, движущегося по трубе, внезапно установить препятствие в виде диафрагмы, то у диафрагмы возникнет волна давления, которая будет двигаться навстречу потоку и по ходу его со скоростью звука. Встречное движение волны будет устанавливать повышенное давление до диафрагмы со скоростью, равной разности скоростей звука и потока. За диафрагмой давление останется равным противодавлению.
Сверхзвуковой поток в аналогичных условиях ведёт себя иначе. Волна давления, возникшая у диафрагмы, не может проникнуть навстречу потоку, потому что он движется со сверхзвуковой скоростью. Эта волна может распространяться только в направлении движения потока, поэтому давление за диафрагмой возрастает. Это новое давление может оказаться больше противодавления приёмной среды.
Если противодавление за соплом Лаваля станет больше расчётного, то на срезе сопла возникает волна давления, которая со скоростью звука внедряется в сверхзвуковой поток. В результате взаимодействия скоростей образовавшаяся волна давления принимает коническую форму и переходит в так называемый косой скачок давления z — z ¹- z . Давление за наружной поверхностью конуса равно противодавлению окружающей среды р 2 , а внутри конуса давление меньше. Протяженность скачка давления очень мала и оценивается длиной свободного пробега молекул.
Кроме неприятностей в виде скачка давления, увеличение противодавления может привести к отрыву струи от стенок сопла. Волна давления, возникшая у выходной кромки сопла, может распространиться внутрь сопла по пограничному слою, где скорость движения газа может быть меньше скорости звука. Следует помнить, что по теории пограничного слоя скорость газа или жидкости, соприкасающейся с поверхностью канала равна нулю. Здесь, в расширяющейся части сопла может возникнуть ещё один скачок давления y — y ¹- y .
5.6 Термодинамические процессы в турбине
урбина является одним из элементов газотурбинного двигателя, работающего по круговому процессу. Кроме того, в турбинах используется энергия отработанных газов поршневых ДВС для привода нагнетателей, позволяющих повысить мощность установок. Турбины также применяются в холодильных установках и системах кондиционирования воздуха. В зависимости от применяемого рабочего тела турбины подразделяются на паровые и газовые.
Рисунок 5.8
Работа процесса, совершаемая газом или паром в условиях открытой термодинамической системы, которой является турбина, называется технической или располагаемой работой (о ней упоминалось ранее при рассмотрении первого закона термодинамики).
Для идеальной турбины, в которой отсутствуют тепловые потери и потери на трение, уравнение первого закона термодинамики записывается в таком виде:

но при отсутствии тепловых потерь 

а работа газа в процессе адиабатного процесса расширения1-2 равна:

Следовательно, удельная работа, совершаемая рабочим телом в турбине, равна разности удельных энтальпий перед входом в турбину и на выходе из неё.
Адиабатный процесс, происходящий в турбине, показан в диаграммах p – v и T – s на рисунке 5.8. Заштрихованная площадь 12аб определяет работу при расширении и перемещении газа.
При расширении рабочего тела в турбине давление его снижается, и работа, в соответствии с выражением (5.32), получается положительной. Из уравнения политропы (4.3) следует:

что означает – удельная работа открытой системы (располагаемая работа) в п раз больше работы изменения объёма закрытой системы. Адиабатный процесс является частным случаем политропных процессов при п = к , поэтому, на основании формулы 4.34, адиабатному расширению газа в турбине соответствует удельная работа, определяемая по формуле

(5.33)
нтиподы турбин – лопаточные компрессоры применяются в газотурбинных установках, в турбонагнетателях поршневых двигателей, а также в других машинах, где требуется перемещение и сжатие упругих веществ (газов или паров).
Упрощенная модель открытой термодинамической системы, имитирующей компрессор, показана на рисунке 5.9,а. Пусть на входе в компрессор параметры газа равны p 1 , v 1 , T 1 , h 1 , а на выходе – p 2 , v 2 , T 2 , h 2 . Для такой системы справедливо уравнение первого закона термодинамики 5.30, а при условии адиабатности процесса – уравнение 5.31. Техническая работа, затраченная на сжатие и перемещение газа в идеальном лопаточном компрессоре определяется по формуле 5.32, которая может быть представлена в таком виде:

где β = р 2 /р 1 – перепад давлений, который создаёт компрессор.
Работа, подсчитанная по формуле (5.34), отрицательна, так как компрессор – машина, потребляющая энергию.
Процесс сжатия, происходящий в компрессоре, на диаграмме p – v изображается линией 1-2, а заштрихованная площадь на рисунке 5.9 представляет собой теоретическую работу компрессора.
5.6 Эжектирование
Эжектированием называют процесс перемещения одного газа под действием разряжения, создаваемого другим газом, движущимся с большой скоростью. Активный высоконапорный газ, создающий разряжение, называется эжектирующим, а пассивный, который приводится в движение – эжектируемым.
Различают эжекторы и инжекторы. В эжекторах статическое давление на выходе смеси равно давлению окружающей среды, они находят применение для вентиляции помещений, для перемещения атмосферного воздуха через радиатор двигателя и для других нужд. Инжекторы предназначены для нагнетания жидкостей и газов в сосуды, находящиеся под давлением, превышающем давление окружающей среды. В этих смесительных устройствах чаще всего количество эжектирующего тела больше, чем эжектируемого, в отличие от эжекторов, где соотношение иное.
На рисунке 5.10 показана схема эжектора, на которой даны эпюры распределения давления в проточной части. Эжектор состоит из соплового канала 1 , по которому подаётся высоконапорный эжектирующий газ, сопло 2 для эжектируемого низконапорного газа, камеры смешения 3 и диффузора 4 . Все каналы, и камера смешения в том числе, могут иметь как круглое, так и прямоугольное или иное сечение. Длина камеры смешения выбирается такой, чтобы в ней заканчивался процесс смешения газов. Расчёты и опыт проектирования эжекторов показывает, что достаточно однородная смесь получается при длине, превышающей диаметр смесительной камеры в 8-12 раз. В диффузоре скорость смеси газов уменьшается при одновременном росте статического давления, ч
то уменьшает потери энергии с выходной скоростью.
Рисунок 5.10
При сверхкритическом режиме течения (рисунок 5.10в) статическое давление р 1 превышает давление р 2 , из-за чего поток эжектирующего газа начинает расширяться и скорость его движения становится сверхзвуковой. Смешение сверхзвуковой струи с эжектируемым газом происходит менее интенсивно. Поток эжектируемого газа, перемещаясь между стенками канала и устойчивой струей эжектирующего газа, постепенно разгоняется и статическое давление в нём падает. Полное смешение потоков при выравнивании давлений происходит в некотором сечении, находящемся на удалении от среза сопла активного газа.
При увеличении перепада давления на сопле активного газа сечение полного смешения будет отодвигаться от начала камеры смешения, площадь потока эжектируемого газа будет уменьшаться, а его скорость возрастать. Режим, когда скорость эжектируемого газа достигает скорости звука, называется критическим. Дальнейшее увеличение перепада давлений ведёт к уменьшению расхода эжектируемого газа за счёт уменьшения проходного кольцевого сечения, по которому этот газ движется. Когда сверхзвуковой поток эжектирующего газа расширяется до стенок камеры смешения, наступает запирание эжектора, из которого будет выходить только активный газ.
Расчёт эжектора базируется на трёх уравнениях: сохранения массы, энергии и количества движения. В нижеприведённых уравнениях величины с индексом 1 относятся к эжектирующему газу, с индексом 2 – к эжектируемому, а с индексом 3 – к смеси.
По закону сохранения массы
G 3 = G 1 + G 2 или G 3 / G 1 = m +1, (5.35)
где G 2 / G 1 = m – коэффициент эжекции .
При адиабатном течении газа энтальпия смеси равна сумме энтальпий компонентных потоков:
Н 3 =Н 1 +Н 2 или c p 3 G 3 T 3 = c p 1 G 1 T 1 + c p 2 G 2 T 2
Если пренебречь влиянием температуры на теплоёмкость, то, при делении на c p 1 G 1 T 1, получается
( m +1) T 3 / T 1 =1+ mT 2 / T 1 или T 3 / T 1 =( mΘ +1)( m +1),
где Θ = T 2 / T 1
Отношение критических скоростей в газовых потоках представляется в следующем виде:
a кр2 / a кр1 = 
a кр3 / a кр1 = 
По закону сохранения количества движения равнодействующая внешних сил, приложенных к секундной массе газа, равна изменению количества движения этой массы. Равнодействующая внешних сил равна разности сил давления газа на входе в камеру смешения и на выходе из неё:
R = p 1 A 1 + p 2 A 2 — p 3 A 3 (5.38)
Количество движения на входе в камеру смешения складывается из количества движения компонентных потоков, а на выходе из камеры смешения равно количеству движения суммарной массы двух потоков:

p 1 A 1 + p 2 A 2 — p 3 A 3 = 
откуда 
Выражение 

Из формулы торможения потока (14.13) следует
Отсюда определяется отношение давления к плотности:

После подстановки в уравнение (5.41) получается

где
С учётом последнего вывода выражение () имеет вид

Это выражение называется основным уравнением эжекции. Оно обычно решается относительно z 3 для определения скорости смеси газов на выходе из камеры смешения. Решение этого квадратного уравнения даёт два значения скорости, одно из которых соответствует дозвуковому режиму течения газа, а второе – сверхзвуковому.
Для решения уравнения эжекции нужно знать скорости истечения из сопел эжектирующего и эжектируемого газов, а также площади проходных сечений на выходе из сопел. Их определяют по ранее полученным формулам истечения.
6 Поршневые компрессоры
Рисунок 6.1
На рисунке 6.1,а показан простейший поршневой компрессор, состоящий из цилиндра ЦЛ, в котором перемещается приводимый от кривошипно-шатунного механизма КШ поршень ПР. Для впуска и выпуска газа в цилиндре имеются два клапана: впуска К1 и выпуска К2.
При ходе поршня слева-направо из-за разряжения, создавшегося в полости цилиндра, происходит открытие всасывающего клапана К1, и газ заполняет цилиндр. На диаграмме «объём – давление» (рисунок 6.1,б) процесс всасывания изображается линией 1-2 . При обратном ходе поршня клапан К1 закрывается, газ сжимается (процесс 2-3 ), а затем вытесняется поршнем из цилиндра через открывшийся клапан К2 (процесс 3-4 ).
Процесс всасывания происходит при давлении газа, несколько меньшем давления среды р 0 , откуда поступает газ. Причиной тому является гидравлическое сопротивление всасывающего клапана движению потока. При выталкивании газа в цилиндре давление несколько больше давления р к той среды, куда подаётся газ; причина та же – гидравлическое сопротивление выпускного клапана.
В момент прихода поршня в крайнее левое положение между поршнем и крышкой цилиндра КЦ остаётся зазор, образующий так называемое «вредное» или «мёртвое» пространство, в котором находится сжатый газ. Из-за расширения этого газа процесс всасывания начинается не из крайнего левого положения поршня, а в точке 1 , после того, как давление в процессе расширения 4-1 станет меньше р 0 . Чем больше «вредное» пространство V 0 , тем меньше активный ход процесса всасывания, и тем меньше производительность компрессора.
Следует отметить, что, несмотря на кажущуюся замкнутость процесса, изображенного на диаграмме, назвать циклом его нельзя. В этом сложном процессе два процесса (сжатие и расширение) протекают в условиях постоянства массы, а два других (всасывание и выталкивание) происходят при переменной массе газа.
Зависимость давления в цилиндре от его рабочего объёма называется индикаторной диаграммой .
Для возможности использования термодинамического анализа вводятся некоторые упрощения:
предполагается, что клапаны впуска и выпуска не имеют гидравлического сопротивления;
рабочим телом в компрессоре является идеальный газ;
считается, что объём «вредного» пространства в цилиндре равен нулю.
Индикаторная диаграмма, соответствующая этим условиям, показана на рисунке 6.2,а, где изображены: 0-1 – процесс всасывания, 1-2 – процесс сжатия и 2-3 – процесс выталкивания газа.
Работа процесса всасывания, происходящего при постоянном давлении, равна

где 



Начальный объём цилиндра по условию равен нулю.
Работа процесса сжатия 1-2 в общем случае равна

Работа процесса выталкивания 2-3 определяется по формуле

где 

Работа компрессора определяется как алгебраическая сумма работ трёх рассматриваемых процессов:

На индикаторной диаграмме (рисунок 6.2,а) работа всасывания определяется площадью 01аб , работа сжатия выражается площадью 12са, работа вытеснения представляется площадью 23бс , а работа компрессора – есть площадь, заключенная внутри контура 0-1-2-3.
Сжатие газа теоретически может быть осуществлено по-разному: изотермически, то есть в условиях интенсивного отвода теплоты; адиабатно, то есть при полной тепловой изоляции цилиндра; возможно и политропное сжатие при теплообмене и изменении температуры газа.
Работа компрессора при изотермическом сжатии равна

Из выражения (6.5) следует, что работа изотермического компрессора численно равна работе изотермического сжатия. На рисунке 6.2,б изотермическое сжатие показано линией 1-2 Т , а работа такого компрессора определяется площадью 012 Т 3 .
Работа компрессора при адиабатном сжатии определяется по формуле

В
ыражение (6.6) свидетельствует о том, что работа адиабатного компрессора в k раз больше работы адиабатного процесса сжатия. На рисунке 6.2,б процесс адиабатного компрессора изображен линиями 0-1-2 А -3 , а площадь, заключенная в этом контуре представляет собой работу компрессора.
Рисунок 6.2

Рабочий процесс политропного компрессора изображен на рисунке 6.2,б линиями 0-1-2 n -3.
Из графиков на рисунке 6.2,б видно, что наименьшую работу имеет изотермический компрессор, а наибольшую – адиабатный. Поскольку компрессор – это машина, потребляющая энергию, уменьшение работы является положительным фактором. Следовательно, при конструировании компрессоров следует предусматривать интенсивное охлаждение газа в цилиндре. Для этой цели цилиндры имеют водяные рубашки охлаждения или развитое оребрение снаружи при воздушном охлаждении.
Формулы для определения теоретической мощности компрессоров получаются из выражений (6.5 – 6.7), если вместо начального объёма V 1 подставить объёмный секундный расход газа V 1 c при температуре и давлении на линии всасывания:



Н
екоторые преобразования в формулах 6.9 и 6.10 заимствованы из п.5.
Рисунок 6.3
Индикаторная диаграмма идеального трёхступенчатого компрессора показана на рисунке 6.3,б. Рабочий процесс компрессора состоит из:
изобарного всасывания в ступени низкого давления (0-1),
политропного сжатия в ступени низкого давления (1-2),
изобарного охлаждения газа в ОВ1 (2-3),
политропного сжатия во второй ступени (3-4),
изобарного охлаждения в ОВ2 (4-5),
политропного сжатия в третьей ступени (5-6),
выталкивание газа из цилиндра третьей ступени при
постоянном давлении (6-7).
Для сравнения здесь приведены рабочие процессы одноступенчатых компрессоров: с политропным сжатием – 0-1-8-7 и с изотермическим сжатием – 0-1-9-7.
При промежуточном охлаждении объем перемещаемого газа уменьшается, и поэтому работа многоступенчатого компрессора оказывается меньше, чем у одноступенчатого на величину, пропорциональную площади 234568.
Исходя из равенства мощностей во всех ступенях компрессора, перепады давлений λ в них должны быть одинаковы, если в промежуточных теплообменниках газ будет охлаждаться до начальной температуры всасывания (Т 5 =Т 3 =Т 1 ). Отсюда следует

где Р нс , Р кс — начальное и конечное давление в ступени , Р нк, Р кк — начальное и конечное давление в компрессоре, z — число ступеней.
Например, если начальное давление в трёхступенчатом компрессоре равно 0,1 МПа , а конечное – 6,4 МПа , то в каждой ступени отношение давлений должно составлять 
Мощность каждой ступени компрессора определяется по формулам (6.9,6.10), куда подставляется отношение давлений в данной ступени. Мощность многоступенчатого компрессора подсчитывается как сумма мощностей всех ступеней.
7 Водяной пар
7.1 Состояния веществ и фазовые переходы.
Одно и то же вещество может находиться в зависимости от внешних условий (температуры, давления) в различных агрегатных состояниях – газообразном, жидком или твёрдом. Переход из одного состояния в другое называют фазовым переходом. Различают: кипение, плавление и сублимацию . В первом случае происходит переход из жидкого состояния в парообразное, во втором – преобразование твёрдого вещества в лёд, а в третьем – переход твёрдого вещества в газообразное. Обратные процессы называются конденсацией, затвердеванием и десублимацией. Все эти процессы сопровождаются поглощением или выделением значительного количества теплоты. При фазовых переходах две или несколько фаз сосуществуют, то есть находятся в равных физических условиях.
При фазовом переходе обычно резко изменяется плотность (удельный объём) вещества. Так, при кипении плотность воды, например, может измениться в тысячи раз.
Некоторые вещества, находясь в твёрдом состоянии, могут образовывать несколько кристаллических модификаций. Каждая из этих модификаций существует в определённой области параметров состояния, а при изменении этих параметров переходит в другую твёрдую модификацию, что может происходить как с подводом, так и с отводом теплоты.
При анализе фазовых равновесий и фазовых переходов используется правило фаз Гиббса , устанавливающее зависимость между числом независимых переменных ψ , определяющих состояние термодинамической системы, находящейся в равновесии, числом фаз r и числом компонентов системы n :
Независимые переменных, характеризующие систему, называют степенями свободы системы .
Для однокомпонентной системы, не претерпевающей фазовых переходов, правило фаз имеет следующий вид:
Последнее означает, что для чистых веществ в однофазной системе число независимых переменных равно двум. Этими переменными могут быть, например, давление и термодинамическая температура. Все остальные параметры функционально зависят от них.
Е
ля однокомпонентной трёхфазной системы по уравнению Гиббса число степеней свободы равно нулю. Отсутствие степеней свободы говорит о том, что данное состояние возможно только при вполне конкретном сочетании температуры и давления. Для чистого вещества характерна тройная точка сосуществования жидкой, газообразной и твёрдой фаз. Для воды тройной точке соответствует температура 273,16 К (0,01 °С) и давление 0,0061 бар. Вещества, имеющие несколько твёрдых фаз, имеют несколько тройных точек.
На рисунке 7.1 показана характерная диаграмма р – Т с нанесенными на ней кривыми фазовых переходов. Влево от линии АОВ расположена область твёрдого состояния вещества, справа от линии КОВ – область газообразного состояния, а между линиями ОА и ОК – область жидкого состояния. Линия ОВ представляет собой кривую сублимации, линия ОА – кривую плавления (затвердевания), а линия ОК – кривую кипения (конденсации), которую называют также кривой насыщения. Точка О представляет собой тройную точку сосуществования трёх фаз.
7.2 Свойства реальных газов
Как уже отмечалось в п.3, теория идеальных газов оказывается неприменимой для парообразных веществ, у которых межмолекулярные потенциальные взаимодействия оказываются более сложными, чем это определено условностями идеализации газов. Из уравнения состояния идеальных газов следует, что

Числовое значение коэффициента сжимаемости К с определяет степень отличия реального газа от идеального. На рисунке 7.2,а показано , что этот коэффициент у реального газа может быть меньше или больше единицы и изменяться в зависимости от давления.
Рисунок 7.2

Так как в реальных газах объём молекул не равен нулю, сжимаемость этих веществ будет меньше на величину, пропорциональную суммарному объему молекул. В уравнении (7.2) это обстоятельство учитывается коэффициентом b .
Вторая поправка учитывает влияние потенциальных сил взаимодействия между молекулами, которые в идеальном газе отсутствуют. Молекулы идеального газа свободны в своём движении. В реальном газе сила ударов молекул о стенки сосуда будет меньше, потому что частично эта сила тратится на взаимодействие с другими молекулами, находящимися в сосуде. Сила взаимодействия между молекулами прямо пропорциональна квадрату плотности или обратно пропорциональна квадрату удельного объёма газа, что и отражает поправка а/ v 2 , где а – константа, не зависящая от параметров состояния.
Уравнение Ван-дер-Вааальса, графически представленное на рисунке 7.2,б качественно верно отображает свойства реальных газов в жидком или газообразном состоянии, но совершенно неприменимо для двухфазных сред, которые, например, наблюдаются при кипении жидкости. Достаточно сказать, что реальный процесс кипения жидкости происходит при постоянной температуре, если давление постоянно, но изотерма как сочетание криволинейных и прямолинейных участков в координатах р – v не может быть описана уравнением (7.2). Существуют более сложные и более точные уравнения состояния реальных газов, но они используются в расчётах редко. Теплотехнические расчёты с водяным и иными парами обычно выполняются с помощью таблиц и диаграмм, полученных в результате проведения специальных экспериментальных исследований.
7.3 Диаграммы реальных газов
На рисунке 7.3 показана диаграмма “давление — удельный объём” для воды и водяного пара. Метод её построения прост — в процессе нагрева воды и пара при постоянном давлении на диаграмме отмечаются искомые параметры: удельный объём, температура и степень сухости пара.
При 0 С и заданном давлении р вода занимает объём 




После того как вода полностью превратится в пар (точка 

Е
Линия В-А по условию экспериментов определяет состояние воды при 0 С , линия С-К характеризует начало кипения воды, а линия К-D — окончание процесса кипения. В области В-А-С-К вещество находится в жидком состоянии, под линией С-К-D — в смешанном состоянии “пар-жидкость”, а над линией К-D — в парообразном состоянии.
Рисунок 7.3

Степень сухости пара, находящегося на линии В-А , равна нулю (х=0 ).
На линии К-D степень сухости пара равна единице (х=1).
Пар, соответствующий окончанию процесса кипения и определяющий линию К-D , называется сухим насыщенным . В области над линией К-D находится пар, температура которого выше температуры кипения (при определённом давлении). Этот пар называется перегретым. Линию С-К-D иногда называют пограничной кривой .
Теплота r , необходимая для полного превращения 1 кг воды в сухой насыщенный пар той же температуры, называется удельной теплотой парообразования .
При постоянном увеличении давления удельный объем воды в процессе парообразования увеличивается, а удельный объем сухого насыщенного пара уменьшается. В точке К , называемой критической точкой , объёмы воды и пара равны. Для разных жидкостей параметры критической точки различны. Для воды критическое давление составляет 



Наименьшим давлением, при котором возможно равновесие воды и насыщенного пара, является давление тройной точки 
На диаграмме р — v изображаются линии равных сухостей 
Как и в диаграмме р — v идеального газа в диаграмме воды и водяного пара площадь под кривой процесса 1-2 определяет собой работу процесса.
На рисунке 7.4,а показана диаграмма Т — s воды и водяного пара. Она также строится на основе экспериментальных данных. Для воды условно принято нулевое значение энтропии при 0 С , поэтому пограничная кривая С-К-D начинается не из начала координат, а из ординаты 273,15 К . Кроме пограничной кривой на этой диаграмме изображаются изобары 


В практических расчётах чаще других используется диаграмма “удельная энтальпия — удельная энтропия” . При построении диаграммы

— s (рисунок 7.4,б) условно приняты нулевые значения энтальпии и энтропии при 0 С , поэтому пограничная кривая исходит из начала координат. Обычно на диаграммах h — s изображаются: пограничная кривая, изохоры, изобары, изотермы и линии равных сухостей. В области влажного пара изобары и изотермы совпадают из-за однозначности зависимости температуры кипения от давления.
7.4 Анализ обратимых процессов с водяным паром
Термодинамический анализ процессов включает: изучение особенностей, изображение процессов в диаграммах, определение начальных и конечных параметров, а также теплоты, работы и других характеристик. Основополагающими формулами при этом являются: уравнение первого закона термодинамики (2.11), уравнение работы (1.6), энтропийное выражение (1.12). Неизвестные параметры состояния, как правило, определяются непосредственно по диаграммах или по таблицам воды и водяного пара при заданных параметрах.
7
.3.1 Изохорный процесс
Процесс с постоянным объёмом водяного пара (dv=0) показан на рисунке 7.5 в диаграммах p — v, T — s и h — s.
Рисунок 7.5

поскольку 
Неизвестные параметры в начальном 1 и конечном 2 состояниях, как уже отмечалось, определяются непосредственно по диаграммам или таблицам. Теплоту процесса 1-2 можно определить графически, используя свойство диаграммы T — s, где площадь 1-2 -с-б есть количество энергии, переданной в форме теплоты. Чаще удельную теплоту определяют, учитывая равенство (7.4) и определив изменение внутренней энергии

так как в соответствии с формулой энтальпии (2.14):

7.3.2 Изобарный процесс
П
роцесс, происходящий при постоянном давлении, изображён на рисунке 7.6 .
Рисунок 7.6
Удельная работа процесса 1-2 при 

На диаграмме р — v удельную работу определяет площадь прямоугольника 1-2- m — n .
Изменение удельной внутренней энергии в изобарном процессе составляет

Из уравнения первого закона термодинамики находится формула для определения удельной теплоты процесса:


Удельная теплота процесса на диаграмме T – s характеризуется площадью 1-2- f — e и равна разности конечной и начальной энтальпий.
7.3.3 Изотермический процесс
Рисунок 7.7
Площадь прямоугольника 1-2-f-e на диаграмме T — s определяет собой удельную теплоту процесса. Отсюда следует при Т = Т 1 = Т 2 :

Изменение удельной внутренней энергии в процессе 1-2 определяется по уже применявшемуся выражению

Следует отметить, что в изотермических процессах с парами, несмотря на постоянство температуры, внутренняя энергия изменяется. В отличие от идеальных газов, в парах энергия потенциального взаимодействия между молекулами оказывается сопоставимой с кинетической энергией движения молекул, и пренебрегать ею нельзя.
Удельная работа изотермического процесса на диаграмме p – v изображается площадью 1-2- m — n и определяется по формуле

7.3.4 Адиабатный процесс
Рисунок 7.8
k = 1,035 + 0,1x , (7.14)
где х — степень сухости пара.
В соответствии с первым законом термодинамики для адиабатного процесса, показанного на диаграммах рисунка 7.8, справедливы равенства:

7.3.5 Процессы истечения пара
При адиабатном истечении пара с начальным давлением 




где начальное 

При 


где 
Для определения 

а затем находится положение точки 
Рисунок 7.9
При истечении пара в комбинированном сопле Лаваля выходная скорость определяется по формуле

а критическая — в самом узком сечении — по формуле (7.17). Для определения массового секундного расхода пара используется уравнение сплошности
где 


http://poisk-ru.ru/s5488t4.html
http://gigabaza.ru/doc/28770-pall.html