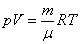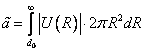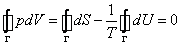1. Уравнение состояния газа Ван-дер Ваальса
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
1. Уравнение состояния газа Ван-дер Ваальса
1. Реальный газ отличается от идеального.
Уравнение состояния идеального газа – приближенно:
1) М.В.Ломоносов еще в XVIII в. указывал, что давление, обусловленное ударами о стенку хаотически движущихся молекул, не будет подчиняться закону Бойля 

2) как мы знаем из теоремы Нернста, и при низких температурах 

3) существуют и другие количественные и качественные нарушения уравнения Клайперона-Менделеева 
Основной причиной наблюдаемых отличий реальных газов от идеальных является наличие сил взаимодействия между молекулами реальных газов .
Силы взаимодействия можно классифицировать следующим образом:
а) химические или валентные, если возникло новое соединение;
б) кулоновские силы притяжения и отталкивания, если газ ионизирован
(плазма — квазинейтральный ионизированный газ);
в) молекулярные силы 
Именно они нас и будут интересовать. Это силы притяжения между молекулами на “больших” расстояниях 
( 
Если в отсутствии внешних полей центры положительных и отрицательных зарядов не совпадают, то такие молекулы называются полярными.
Если электронная оболочка симметрична и центры положительных и отрицательных
зарядов в молекуле совпадают, то мы имеем дело с неполярными молекулами.
Под действием электрического поля
а) неполярные молекулы поляризуются за счет деформации электронной оболочки;
б
Вокруг каждой поляризованной молекулы возникает быстро убывающее с радиусом электрическое поле 
Если в поле 
П




Энергия взаимодействия 





Аппроксимация (от лат. approximo–приближаюсь) –приближенное выражение какого-либо математическкого объекта через другие более простые.
Потенциал Леннарда-Джонса используется в теории газов и дает хорошее совпадение с экспериментом для реальных газов.
2. Модель: В простейшей теории используется ещё более грубая пунктирная аппроксимация,
соответствующая следующей модели:
1) Газ состоит из твердых упругих шариков диаметром 
2) Молекулы-шарики притягиваются на расстоянии 


3. Учёт притяжения.
Из-за взаимного притяжения между молекулами газ как бы сжимается эффективно большим давлением, чем давление 
Величина этой положительной добавки к 
молекул, содержащихся в единице объема каждого из взаимодействующих объемов 





4. Учет отталкивания.
Учтем силы отталкивания в рамках предложенной модели, предполагая существование объема недоступного для движения молекул вследствие конечности их размера 
П


Если у нас 1 моль, то объем, доступный движению молекул, 

5. Уравнение Ван-дер-Ваальса.
Тогда подправим уравнение состояния одного моля идеального газа, написав
уравнение состояния для 1 моля газа Ван-дер-Ваальса:

где 

Если у нас не один моль, а 

Еще раз о смысле каждой скобки, 



6. Качественные вопросы
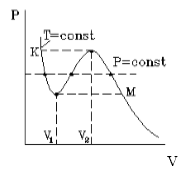
1) Изобразим изохору реального газа в координатах
То есть для реального газа увеличение температуры при постоянном объеме вызывает более резкий рост давления, чем для идеального газа:



2) Изобразим изобару в координатах
T При


2. Внутренняя энергия газа Ван-дер-Ваальса
1. Внутренняя энергия В-д-В газа


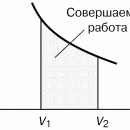
При расширении работа, совершаемая силами притяжения молекул газа, равна убыли его потенциальной энергии, связанной с притяжением молекул:

2. Задача об убранной перегородке для реального газа .
а) Для идеального газа:

б) Для Ван-дер-Ваальсовского газа:
То есть с увеличением объема
3. Эффект Джоуля-Томпсона
В

Отв. Для идеального газа температура не изменится, а для реального газа будет наблюдаться эффект Джоуля- Томпсона.
а) Если 


Газ охлаждается, так как при расширении внутренняя энергия расходуется на работу против сил молекулярного притяжения. Этот эффект используется для ожижения газов и получения низких температур.
б) При 
Отрицательный эффект Джоуля-Томпсона реализуется для 


Для общего развития: 
где 
3. Теплоемкость газа Ван-дер Ваальса
Здесь 
Проведем расчет теплоемкости для одного моля реального газа при различных процессах:
1) Изохорический 


2) Адиабатический 

3)
4)
Найдем 


т.о. 
4. Уравнение адиабаты для газа Ван-дер- Ваальса


5. Энтропия газа Ван-дер Ваальса
1)

2) Как измениться энтропия газа в задаче об убранной перегородке:
То есть
6. Уравнение политропы В-д-В газа
Уравнение адиабаты для В-д-В газа:
Для идеального газа уравнение адиабаты:
По аналогии естественно предположить, что для В-д-В газа уравнение политропы будет иметь вид:



или уравнения политропы В-д-В газа, здесь 
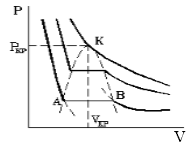
7. Изотермы Ван-дер-Ваальса

М
в) Изотермы, построенные в координатах (P,V), дают наиболее содержательные результаты.
Найдем особые точки изотермы, вычислив 
Найдем корни этого уравнения:



Т.о. чем 


В точке К с параметрами 

К понятию критического состояния можно придти путем анализа экспериментальной изотермы без рассмотрения какого-либо теоретического уравнения состояния. Уравнение В-д-В является лишь модельным, и не все состояния, совместимые с уравнением В-д-В, могут быть реализованы. Реализованы могут быть только устойчивые состояния.
Одно из необходимых условий термодинамической устойчивости однородного вещества:
Оно означает, что при изотермическом увеличении давления 


Участки AC и BD соответствуют разным фазовым состояниям вещества.
8. Экспериментальные изотермы реального газа
В изучение этого вопроса значительный вклад внесли следующие исследователи: Ван Марум (1750-1837), Фарадей (1791-1867), Эндрюс (1813-1885).
Опред. В термодинамике фазой называется совокупность однородных, одинаковых по
свойствам частей системы .
Различают следующие фазы: газообразная, жидкая, различные кристаллические
Разные фазы могут существовать в равновесии друг с другом.
Переход вещества из одной фазы в другую называется фазовым переходом.
Существуют фазовые переходы:
жидкость 
газ 
жидкость 
Фазовый переход I рода сопровождается выделением/поглощением тепла.
твердая фаза 
резистивное состояние 
обычная жидкость 
При фазовых переходах II рода нет выделения/поглощения тепла .
Р

На участке EF жидкость и газ находятся в термодинамическом равновесии (т.д.р.)
Условия термодинамического равновесия фаз :
Таким образом мы распространили уравнение Ван-дер Вальса на область жидкого состояния, где оно вообще-то не применимо.
Газ, находящийся в равновесии с жидкостью, называется насыщенным паром .
Вопр.: Какая разница между паром и газом?
Отв. Пар – это газ, который может быть превращен в жидкость изотермически .
Пар – это газ с температурой ниже критической.
В значительной степени двойственная терминология обусловлена исторически: те газы, которые могли быть превращены в жидкость, называли парами, а те, которые ожижить не удавалось, — газами. Когда все газы сжижили, то необходимость в различии названий отпала.
В 

Из т.1 
Из т.2
Из т.3
На самом деле 
следовательно, вещество внизу ампулы должно заметно уплотняться вследствие
гравитации, поэтому благодаря сильному изменению плотности вещества с высотой,
в ампуле иметь критическую плотность может только бесконечно тонкой слой вещества.
В нем и происходит исчезновение мениска. В этом заключается суть метода мениска для
измерения критической температуры 
В критической точке вещество обладает необычными свойствами:
1) бесконечной сжимаемостью;
2)
3
Метастабильные участки AE и BF могут существовать:
BF соответствует пересыщенному пару, который может быть получен при резком адиабатическом расширении.
EA соответствует перегретой жидкости, она может быть получена резким уменьшением давления. Это – физически однородная жидкость, в которой нет растворенного газа.
Горизонтальный участок изотермы EF определяется правилом Максвелла: 
Рассмотрим цикл 

Вопр.: Рассмотрим два цикла 



Отв.: 1) Для цикла 


2) Для цикла 


состояние не может перейти в однофазное. В обратную сторону перход возможен, но при этом 
К




9. Уравнение Клайперона-Клаузиуса. Диаграмма состояния
1234 – цикл Карно с изотермическим реальным газом.

Тангенс угла наклона кривой испарения и
сублимации всегда больше нуля,
следовательно, угол наклона соответствующих кривых меньше 
Для плавления это может быть не так (
Диаграмма фазовых переходов
Три фазы одного и того же вещества могут существовать в равновесии только в
одной точке, то есть при единственных значениях 
Р
Параметры критичного состояния для 


10. Другие уравнения реальных газов




Уравнение Ван-дер Вальса имеет преимущества вследствие легко объяснимого физического смысла параметров. Его-то и надо уметь пояснять.
ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ
ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ – модельное уравнение состояния реального газа, учитывающее, в отличие от уравнения состояния идеального газа, взаимодействие молекул между собой, а именно: мощное отталкивание на малых расстояниях R между центрами масс молекул
(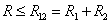
(R > R12) расстояниях. Здесь R1 и R2 – газокинетические радиусы молекул. В ряде случаев, для простоты, используется средний газокинетический диаметр взаимодействующих молекул 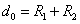
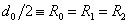
Уравнение состояния является функциональной связью между четырьмя термодинамическими параметрами состояния физической системы. Для описания однокомпонентных (состоящих из частиц одного сорта) физических систем достаточно четырех параметров. Для систем, состоящих из различных частиц (например, воздух – смесь азота, кислорода, аргона, углекислого газа и др.), полный перечень необходимых параметров включает относительные концентрации компонент смеси. Для простоты, будут рассмотрены только однокомпонентные системы. Традиционный и наиболее употребительный набор параметров состояния состоит из массы системы m, давления p, объема V и температуры T. Использование массы системы в качестве одного из ее параметров предполагает, что известна молярная масса вещества 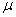
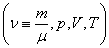
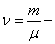
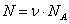
Уравнение состояния идеального газа (газа невзаимодействующих материальных точек) было получено Э.Клапейроном (1834) в результате объединения трех экспериментально установленных газовых законов: 1) Р.Бойля (1662) и Э.Мариотта (1676); 2) Шарля (1785); 3) Гей-Люссака (1802). Сейчас это уравнение (здесь R – универсальная газовая постоянная)
называют уравнением Клапейрона – Менделеева.
В данном частном случае заслуга Д.И.Менделеева в том, что он вывел написанное выше универсальное уравнение состояния идеальных газов. В частности, при исследовании явлений, не укладывающихся в модель идеального газа и обусловленных взаимодействием молекул между собой (поверхностное натяжение жидкостей и сопутствующие капиллярные явления, непрерывные и скачкообразные фазовые переходы жидкость – газ), Менделеев ввел понятие температуры «абсолютного» кипения, которая впоследствии была названа Эндрюсом критической температурой – температурой критического состояния вещества, это уже сфера непосредственных применений уравнения Ван-дер-Ваальса.
Учет взаимодействия между молекулами газа при расчете его термодинамических характеристик впервые был выполнен в 1873 голландским физиком Я.Д.Ван-дер-Ваальсом, именем которого названо полученное им уравнение состояния такого газа. Строго говоря, ван-дер-ваальсовским можно называть газ, потенциальная энергия притяжения молекул которого на больших расстояниях убывает с ростом R по закону
его, например, нет места в плазме состоящей из заряженных частиц, потенциальная энергия взаимодействия которых на больших расстояниях убывает в соответствии с законом Кулона
т.е существенно медленнее.
Силы Ван-дер-Ваальса (R > d0)
для молекулярных и атомарных газов носят достаточно универсальный характер. Квантовомеханическое усреднение потенциальной энергии по взаимным ориентациям взаимодействующих объектов практически во всех случаях приводит к асимптотическому закону (1), (3).
Во-первых, это взаимодействие полярных молекул, т.е. молекул с собственным электрическим дипольным моментом (молекулы типа HCl, H2O и т.п.). Соответствующие силы называют ориентационными.
Во-вторых, взаимодействие полярной и неполярной молекулы (не имеющей собственного электрического дипольного момента): He, Ar, … N2, O2 … . Такое взаимодействие принято называть индукционным.
Наконец, взаимодействие неполярных атомов и молекул – дисперсионное взаимодействие. Происхождение дисперсионных сил строго объясняется только в рамках квантовой механики. Качественно возникновение этих сил можно объяснить – в результате квантовомеханических флуктуаций у неполярной молекулы возникает мгновенный дипольный момент, его электрическое поле поляризует другую неполярную молекулу и у неё появляется наведенный мгновенный дипольный момент. Энергия взаимодействия неполярных молекул – это квантовомеханическое среднее энергии взаимодействия таких мгновенных диполей. Дисперсионные силы не зависят от наличия или отсутствия собственных дипольных моментов у атомов и молекул и потому всегда имеют место. В случае неполярных атомов и молекул дисперсионные силы в десятки и даже сотни раз больше сил ориентационных и индукционных. В случае молекул с большим собственным дипольным моментом, например, молекул воды H2O, дисперсионная сила в три раза меньше ориентационной. Все эти силы имеют асимптотику (3), таким образом, в общем случае усредненная потенциальная энергия
(4) 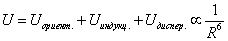
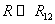
Мощное отталкивание молекул на малых расстояниях возникает при перекрытии внешних заполненных электронных оболочек и обусловлено принципом запрета Паули. Зависимость этих сил от R нельзя объяснить в рамках чисто классической электродинамики. Силы отталкивания в большей мере, чем силы притяжения, зависят от конкретных особенностей строения электронных оболочек взаимодействующих молекул и требуют для своего определения громоздких квантовомеханических расчетов. Хорошее согласие с экспериментом дает следующая модель
Из (5) видно, что уменьшение расстояния в два раза приводит к увеличению силы отталкивания 15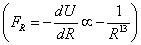
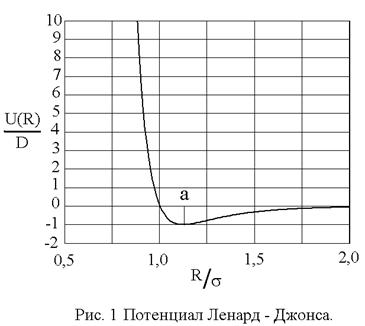
При практических расчетах широко используется модельный потенциал Ленард – Джонса, (с учетом (1) и (5))
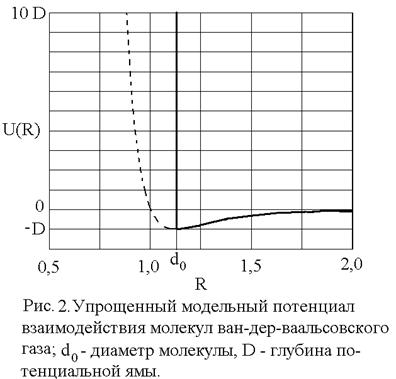
показанный на рис. 1. Видно, что параметр D имеет смысл глубины потенциальной ямы, а параметр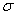
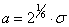
Уравнение состояния ван-дер-ваальсовского газа, само по себе приближенное, может быть, тем не менее, точно получено в рамках модели притягивающихся твердых шаров. В этой модели весьма большие, но конечные силы отталкивания на малых расстояниях заменяются бесконечно большими силами, что означает замену близкого к вертикали криволинейного потенциального барьера левее точки минимума (рис. 1) вертикальной потенциальной стенкой в соответствующей точке: R = d0, что показано на рис. 2. При расстояниях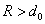
Вертикальная потенциальная стенка ставится именно в точке R = d0 = 2R0, т.к. минимальное расстояние между центрами двух твердых шаров равно их диаметру.
Притяжение молекул на расстояниях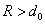
(7) 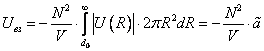
Где 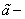
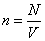
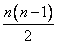
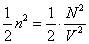
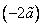
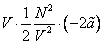
Внутренняя энергия реального газа складывается из суммарной кинетической энергии его молекул (той же, что и в идеальном газе при тех же параметрах состояния) и потенциальной энергии их взаимодействия. Отсюда, например, для одноатомного газа с температурой T можно записать:
Конечность объема молекул приводит к тому, что не весь объем сосуда V доступен для их движения – уменьшается «свобода» размещения молекул газа в его фазовом пространстве, что, в свою очередь, уменьшает статистический вес макросостояния и энтропию газа. Энтропия идеального (молекулы – материальные точки) одноатомного газа с температурой , занимающего сосуд объемом V, имеет вид
Если объем недоступный для движения молекул – шариков реального газа, равен V0, то его энтропия
Для двух молекул радиуса R0 с минимальным расстоянием между центрами 2R0, объем, недоступный для движения, – это объем сферы, равный
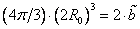
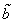
Недоступный для движения объем в расчете на одну молекулу равен 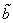
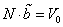
В рамках рассматриваемой модели параметры а и b (вторые формулы в (8) и (12)) являются атомными константами (диаметр молекулы d0 считается фиксированной величиной, не зависящей от температуры, хотя, строго говоря, это не так), не зависящими параметров термодинамического состояния вещества.
Основное термодинамическое тождество имеет вид
это первое начало термодинамики, в которое для квазистатических процессов подставлены выражения для получаемой системой теплоты и (–pdV) для совершаемой над системой работы, оно позволяет получить уравнение состояния Ван-дер-ваальсовского газа с выражения для давления, следующего из (12)
В (13) индекс S указывает на то, что дифференцировать нужно при постоянной энтропии. Подстановка (8) и (11) в (13) приводит к уравнению состояния реального газа Ван-дер-Ваальса
Переход от числа молекул в газе N к числу молей 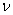
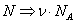
В этих переменных уравнение Ван-дер-Ваальса имеет вид 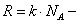
Главное значение уравнения Ван-дер-Ваальса состоит, во-первых, в простоте и физической понятности его аналитической структуры: поправка a учитывает притяжение молекул на больших расстояниях, поправка b – их отталкивание на малых расстояниях. Уравнение состояния идеального газа 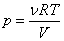
Во-вторых, уравнение Ван-дер-Ваальса обладает (несмотря на приближенность модели) широким спектром качественных, а в ряде случаев и полуколичественных предсказаний о поведении реального вещества, которые следуют из анализа уравнения (16) и вида соответствующих ему изотерм и касаются поведения вещества не только в достаточно разреженном газообразном состоянии, но и в жидком и двухфазном состояниях, т.е. в состояниях, далеких от априорной области применимости модели Ван-дер-Ваальса.
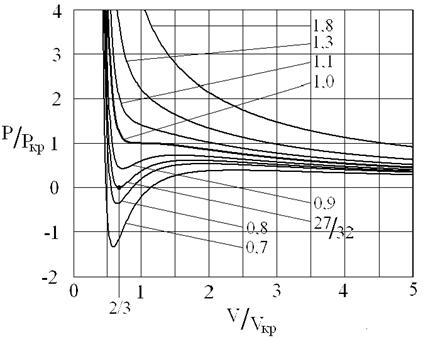
Рис. 3. Изотермы Ван-дер-Ваальса. Цифры, указывают отношение температуры, соответствующей данной изотерме, к критической температуре вещества. Единица соответствует критической изотерме T = Tкр.
Уравнение (16) имеет особую точку – точку перегиба, в которой
это соответствует реальной физической особенности – критическому состоянию вещества, в котором исчезает различие между жидкостью и ее паром (жидкой и газовой фазами), находящимися в состоянии термодинамического равновесия. Критическая точка является одним из концов кривой равновесия жидкость – пар на диаграмме (p, T), другим концом этой кривой является тройная точка, в которой в термодинамическом равновесии находятся все три фазы: газовая, жидкая и кристаллическая. Критической точке соответствуют критическая температура Tкр., критическое давление pкр. и критический объем Vкр. При температурах выше критической переход «жидкость – пар» происходит без скачка плотности, в критической точке исчезает мениск в капилляре, обращается в нуль теплота испарения и в бесконечность изотермическая сжимаемость (пропорциональная производной 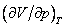
Решение уравнений (17) дает связь критических параметров с постоянными Ван-дер-Ваальса a и b:
Формулы (18) позволяют найти константы а и b по экспериментально определенным параметрам критического состояния. Одним из показателей количественной точности уравнения Ван-дер-Ваальса является результат критического коэффициента 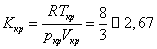
| Вещество | Kкр, эксперимент | Вещество | Kкр, эксперимент |
| H2 | 3,03 | SO2 | 3,60 |
| He | 3,13 | C6H6 | 3,76 |
| N2 | 3,42 | H2O | 4,46 |
| O2 | 3,42 | CO2 | 4,49 |
Если для водорода 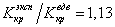
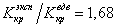
Критическое давление и критическая температура, например, воды равны соответственно: 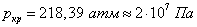
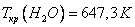
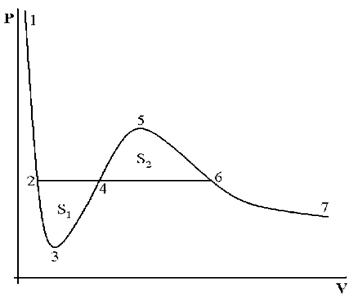
На рис. 4 дано несколько утрированное (по сравнению с рис. 3) качественное изображение изотермы Ван-дер-Ваальса с температурой ниже критической. На участке 3–4–5 производная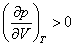
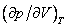
взаимодействия молекул, что справедливо при малых плотностях (больших объемах) – это «хвост» 6–7 изотермы на рис. 4, где она асимптотически сближается с изотермой идеального газа. Поправка на конечность размера молекул сделана в предположении, что молекулы ведут себя как твердые шары, это приближенно имеет место в жидкости при объемах, близких к суммарному объему плотно упакованных молекул, чему соответствует участок 1–2 изотермы. Следовательно, только на «концах» 1–2 и 6–7 изотермы ван-дер-ваальсовский подход может претендовать на приближенное количественное и правильное качественное описание. В промежуточной области теоретических оснований для таких претензий нет и, как следствие, получается нефизический участок 3–4–5.
Таким образом, участок 1–2 может быть поставлен в соответствие жидкому состоянию вещества. Его вертикальность обусловлена тем, что при V стрелка vb знаменатель в первом слагаемом (16) обращается в нуль и кривая выходит на вертикальную асимптоту V = vb = V0. В эксперименте этому соответствует ничтожно малая (по сравнению с газами) сжимаемость жидкостей. На участке 6–7 изотерма Ван-дер-Ваальса близка к изотерме идеального газа.
При температурах ниже критической, когда только и есть нефизический участок 3–4–5 (см. рис. 3), переход из жидкого состояния 1–2 в газовое состояние 6–7 происходит только через двухфазное состояние. Известно, что давление в двухфазной системе есть однозначная функция температуры, поэтому в переменных (p, V) соответствующий двухфазному состоянию На рис. 4 участок изотермы является отрезком горизонтальной прямой (участок 2–4–6 на рис. 4).
В уравнении Ван-дер-Ваальса нет горизонтального участка, однако наличие ван-дер-ваальсовского нефизического участка 3–4–5 позволяет теоретически определить «высоту» двухфазного участка 2–4–6, т.е. давление в двухфазной системе при данной температуре.
Если рассмотреть циклический процесс 2–3–4–5–6–4–2 (замкнутый контур ) и, учитывая, что во всех точках этого цикла температура постоянна, проинтегрировать основное термодинамическое тождество, то получим
(19) .
Равенство нулю интегралов в правой части (19) есть следствие замкнутости процесса и того, что энтропия S и внутренняя энергия U – функции состояния. Равенство нулю интеграла 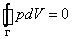
Участки 2–3 и 5–6 соответствуют реальным метастабильным состояниям вещества, а именно: 2–3 – перегретая жидкость, 6–5 – переохлажденный (пересыщенный) пар. В этих состояниях жидкость или пар могут существовать в течение некоторого времени, если нет центров парообразования и конденсации. Появление в жидкости центров парообразования ведет к немедленному возникновению и росту на их месте пузырьков пара. Аналогично, появление центров конденсации в переохлажденном паре ведет к немедленному возникновению и росту на их месте капель жидкости. Оба явления используются для регистрации треков заряженных частиц: первое в пузырьковой камере, второе в камере Вильсона (туманной камере). Роль центров парообразования (конденсации) играют ионы, которые оставляет на своем пути заряженная частица в результате ионизации молекул жидкости (пара) при столкновениях с ними. Пузырьки (капли) существуют достаточное для их фотографирования время, что делает видимой траекторию, по которой двигалась заряженная частица. Исследование трека частицы позволяет определить ее энергию и импульс, соответственно, вычислить ее массу, что является одной из важнейших задач физики элементарных частиц.
При температуре 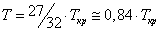
Савельев И.В. Курс общей физики, т. 3, Молекулярная физика и термодинамика, М.: Наука, Физматлит, 1998;
Сивухин Д.В. Общий курс физики, т. 2, Термодинамика и молекулярная физика, М., Физматлит, 2003;
Вдовиченко Н.В. Развитие фундаментальных принципов статистической физики в первой половине XX века. М., НАУКА, 1986.
Уравнение Ван-дер-Ваальса
Вы будете перенаправлены на Автор24
Что такое реальный газ
Реальным газом называют газ, между молекулами которого существуют заметные силы взаимодействия. В неидеальных, газах под высоким давлением, газах с большой плотностью взаимодействие молекул велико и его необходимо учитывать. Силы притяжения играют наиболее существенную роль на больших расстояниях между молекулами. Расстояние уменьшается, силы притяжения растут, но до определенного предела, затем они начинают уменьшаться и переходят в силы отталкивания. Притяжение и отталкивание молекул можно разделить и рассматривать и учитывать отдельно друг от друга.
Уравнение Ван-дер-Ваальса
Уравнение Ван-дер-Ваальса, описывающее состояние 1 моля реального газа, имеет вид:
где d- диаметр молекулы,
величина a вычисляется по формуле:
где $W_p\left(r\right)$- потенциальная энергия притяжения двух молекул. Необходимо заметить, что газовая постоянная имеет индивидуальное значение для каждого вещества. Она отличается от молярной газовой постоянной, причем она меньше, что говорит об объединении молекул вещества в комплексы около критического состояния. Вдали от критических состояний можно использовать универсальную газовую постоянную.
С увеличением объема роль поправок в уравнении (1) становится менее существенной. И в пределе уравнение (1) переходит в уравнение состояния идеального газа для 1 моля (4):
Уравнение (4) — уравнение Менделеева — Клайперона, где m- масса газа, $R=8,31\ \frac<Дж><моль\cdot К>$- универсальная газовая постоянная.
Это согласуется с тем фактом, что при уменьшении плотности реальные газы по своим свойствам приближаются к идеальным.
Уравнение (1) может быть записано в вириальной форме:
Для анализа изотерм уравнение (1) удобнее представить в виде:
Рассматриваемое уравнение может описывать и свойства жидкости, например плохую ее сжимаемость.
На рис.1 изображена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T, построенная из соответствующего уравнения.
Такая зависимость на практике невозможна. Опыт показывает, что график должен иметь вид рис.2 то есть существуют области, в которых при изменении объема давление неизменно. В некоторых отрезках график изотермы параллелен оси V (рис 2). Это область фазового перехода. Жидкость и газ существую одновременно.
По мере увеличения температуры участок, отражающий состояние нахождения газа одновременно в двух фазах на графиках p(V), сужается и превращается в точку (рис. 2). Это особая точка К, в которой пропадает различие между жидкостью и паром. Это так называемая критическая точка.
Готовые работы на аналогичную тему
Итак, уравнение Ван-дер-Ваальса описывает поведение газов близких к реальным. Их можно применить к газообразной и жидкой фазам вещества. Эти уравнения отражают существование фазового перехода газ — жидкость. Показывают наличие критической точки перехода. Однако абсолютно точных количественных результатов расчеты, в которых используются вышеназванные уравнения, не дают.
Задание: Газ в количестве 1 моль находится в сосуде объемом V л при температуре $T_1$ давление газа $p_1$, а при $T_2$ давление газа $p_2$. Найти постоянные Ван-дер-Ваальса.
Запишем уравнение Ван-дер-Ваальса для одного моля реального газа для состояний 1 и 2:
Раскроем скобки в (1.1):
Вычтем $\left(1.4\right).\ из\ \left(1.3\right):$
Выразим a из (1.1):
Задание: Для реального газа, используя уравнение Ван-дер-Ваальса, получите уравнение адиабаты в параметрах V и T.
\[\delta Q=dU+\partial A=0\ \left(\ 2.1\right)\]
Так как процесс адиабатный, то он идет теплообмена. Перепишем уравнение (2.1) для ван-дер-ваальсовского газа, зная, что:
Из уравнения Ван-дер-Ваальса:
Подставим (2.5) в (2.4), разделим переменные:
Ответ: Уравнение адиабаты для заданного случая имеет вид: $<\left(V-b\right)>^<\frac<2>\nu >T=const.$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 15 01 2022
http://www.krugosvet.ru/enc/fizika/van-der-vaalsa-uravnenie
http://spravochnick.ru/fizika/molekulyarnaya_fizika/uravnenie_van-der-vaalsa/