Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
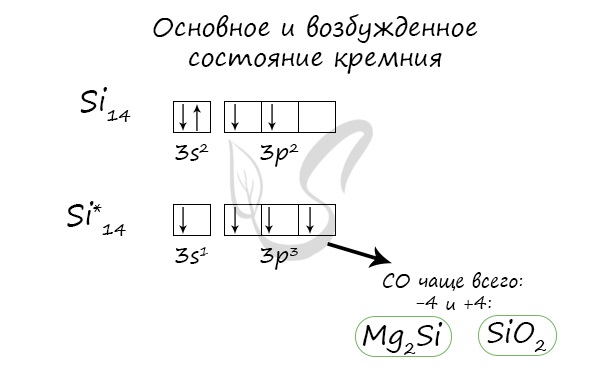
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кремний. Химия кремния и его соединений
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :
+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например , если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Способ получения кремния или силицида цинка из диоксида кремния
Владельцы патента RU 2345950:
Изобретение может быть использовано в химической промышленности. Диоксид кремния восстанавливают цинком с получением кремния или силицида цинка, силикатов натрия и паров хлорида цинка. Реакция проводится в трехкомпонентном расплавленном шлаке, включающем хлорид натрия, диоксид кремния и цинк. Реакцию осуществляют при температуре выше температуры испарения образующегося хлорида цинка, но ниже температуры испарения цинка. Предложенное изобретение позволяет получить кремний без прямого контакта с углеродом. При этом процесс реализуется при температурах, значительно меньших температуры прямого восстановления диоксида кремния углеродом. 2 з.п. ф-лы, 4 табл.
Изобретение относится к области химии металлургических процессов. Кремний — один из наиболее распространенных в природе химических элементов после кислорода. Исключительно велика роль кремния в научно-техническом прогрессе. Поэтому проблема поиска новых способов получения кремния с целью повышения эффективности его производства и улучшения качества, актуальна.
Одним из наиболее распространенных способов получения кремния является использование хлоридно-гидридной технологии с последующей вертикальной зонной плавкой по методу «плавающей зоны». [Свойства элементов. Справочник под редакцией М.Е.Дрица. — М.: Металлургия, 1985 г., 409 с.] Данный способ является экологически опасным и технологически трудоемким. Исходные и конечные продукты сильно ядовиты.
Наиболее близким к заявленному техническому решению является получение кремния из его диоксида. Кремний может быть восстановлен углеродом при температуре выше 1600°С. [Г.Г.Грибов, К.В.Зиновьев. Получение высокочистого кремния для солнечных элементов. Неорганические материалы. 2003 г., т.39, №7] [В.В.Стендер. Прикладная электрохимия. — Харьков: Изд. Харьковского университета, 1961 г.]. В результате получается кремний технической чистоты. В микроэлектронике требуется кремний высокочистый и в виде монокристаллов. Процесс может быть осуществлен в дуговых электропечах в относительно малых объемах.
Техническая задача, решаемая изобретением, состоит в создании экологически безопасного и энергосберегающего способа получения достаточно чистого кремния и как промежуточного или самостоятельного продукта — силицида цинка.
Для решения поставленной технической задачи получения кремния из диоксида кремния путем самопроизвольной реакции в среде расплавленного шлака, согласно предложению, расплавленный шлак представляет собой трехкомпонентную электролитическую среду, включающую хлорид натрия, диоксид кремния и цинк, а самопроизвольную реакцию осуществляют при температуре выше, чем температура испарения образующегося хлорида цинка, но ниже температуры испарения цинка с образованием кремния, силикатов натрия и паров хлорида цинка, при этом осуществляют дальнейшую реакцию в расплаве хлорида цинка с образовавшимся силикатом натрия и последующее восстановление цинка из образовавшегося силиката цинка с помощью углерода. Дополнительно осуществляют восстановление кремния из его диоксида с помощью углерода при температуре, не выше температуры испарения цинка.
Экспериментально доказана возможность получения Si из SiO2 в расплаве соли NaCl (ж) с помощью Zn — восстановителя при температуре, выше температуры испарения ZnCl2 (733°C), по реакции:
Для термодинамического расчета реакции (1) нами использовались известные термодинамические потенциалы веществ, участвующих в этой реакции [М.Х.Карапетьянц, М.Л.Карапетьянц. Основные термодинамические константы неорганических и органических веществ. — М.: Химия, 1968. 469 с.], и предполагаемые значения потенциалов пара ZnCl2(г) (исходя из аналогии ZnCl2(г) с MgCl2(г) (табл.1).
Исходя из приведенных в табл.1 термодинамических потенциалов веществ получаем следующие величины термодинамических потенциалов реакции (I):
ΔG(20°C)≈+170,53 кДж/моль; ΔН≈+239,77 кДж/моль; ΔS≈+237,99 Дж/(моль·град)
Отсюда следует, что минимальная температура реакции (1) в приближении температурной зависимости ΔG(T) равна:
| Таблица 1 Термодинамические потенциалы веществ, участвующих в реакции (1) | ||||||
| Термодинамические потенциалы | NaCl(ж) | SiO2 | Zn | Si | Na2SiO3 | ZnCl2(г) |
| G (20°С), кДж/моль | -366,21 | -856,98 | -1428,37 | ≈-419(г) | ||
| Н, кДж/моль | -386,47 | -911,32 | -1481,16 | ≈-419(г) | ||
| S, Дж/(моль·град) | 95,193 | 41,9 | 41,65(к) | 18,85 | ≈209,5 | ≈251,4(г) |
Отсутствие термодинамического запрета на восстановление кремния из его диоксида с помощью цинкового восстановителя обусловлено образованием химически «прочного» силиката натрия с малой величиной ДС и парообразного ZnCl2(г) с большой величиной энтропии.
В лабораторных опытах для нейтрализации пара ZnCl2(г) и его регистрации использовался порошок СаО (или СаСО3) в большом корундовом тигле, в котором размещалась емкость с исходной шихтой — смесью NaCl, SiO2 и Zn — гранул. Над ней располагался колпак для образования клапана на известковой засыпке.
На практике в качестве поглотителя ZnCl2(г) можно использовать также расплав стекла:
При термодинамическом расчете реакции (2) исходили из следующих величин термодинамических потенциалов веществ:
| Таблица 2 Термодинамические потенциалы веществ, участвующих в реакции (2) | ||||
| Термодинамические потенциалы | ZnCl2(г) | Na2SiO3 | NaCl(ж) | ZnSiO3 |
| G (20°С), кДж/моль | ≈-419(г) -369,01(к) | -1428,37 | -366,21 | -1150,57 |
| Н, кДж/моль | ≈-419(г) -415,98(к) | -1481,16 | -386,47 | ≈-1194,15 |
| S, Дж/(моль·град) | ≈251,4(г) 108,02(к) | ≈209,5 | 95,193 | 89,67 |
Отсюда, для термодинамических потенциалов реакции (2) получаем: ΔG(20°С)≈-35,62 кДж/ моль; ΔН≈-77,23 кДж/моль; ΔS≈-180,17 Дж/(моль·град).
Реакция (2) с участием парообразного ZnCl2(г) при температуре выше 733°С является термодинамически запрещенной из-за положительной величины ΔG(733°C):
ΔG(733°С)=-35,62+180,17·10 -3 (733-20)=93,02 кДж/ моль.
Реакция (2) с участием жидкого ZnCl2(ж) термодинамически разрешена, так как ее термодинамические потенциалы равны:
ΔG(20°С)≈-85,60 кДж/моль; ΔH≈-71,23 кДж/моль; ΔS≈-37,46 Дж/(моль·град).
При Т 733°С как реакция расплавленного раствора ZnCl2 в NaCl(ж) с Na2SiO3. Образующийся при этом силикат цинка ZnSiO3 является одним из основных природных минералов, используемых в производстве цинка. Он может быть восстановлен по традиционной технологии:
Приведем термодинамический расчет известной реакции (3) для подтверждения используемого приближения линейной температурной зависимости ΔG(T°C) и предположения о значениях термодинамических потенциалов парообразного Zn(г). При термодинамическом расчете этой реакции исходили из известных значений термодинамических потенциалов веществ, участвующих в реакции (3) и гипотетической величины энтропии паров цинка (по аналогии с Mg(г)).
| Таблица 3 Термодинамические потенциалы веществ, участвующих в реакции (3) | |||||
| Термодинамические потенциалы | ZnSiO3 | С | Zn(г) | СО | SiO2 |
| G (20°C), кДж/моль | -1150,57 | 95,32 | -137,35 | -856,98 | |
| Н, кДж/моль | ≈-1194,15 | 16,55 | 130,92 | -110,68 | -911,32 |
| S, Дж/(моль·град) | 89,67 | 2,3732 | ≈146,65 | 197,85 | 41,9 |
Отсюда для термодинамических потенциалов реакции (3) получаем: ΔG(20°C)≈251,56 кДж/ моль; ΔН≈286,51 кДж/моль; ΔS≈294,36 Дж/(моль·град). В приближении линейной зависимости ΔG(T) получаем минимальную температуру реакции:
Таким образом, рассчитанная температура оказалась близкой к реальной температуре, при которой осуществляется реакция (3) на практике.
Известно, что для разделения Zn(г) и СО, образующихся в реакции (3), используется быстрое охлаждение паров Zn(г):
Материальный баланс предлагаемого нами процесса получения кремния с участием реакций 1-4 формально совпадает с материальным балансом процесса прямого восстановления диоксида кремния углеродом в электропечах по известной реакции:
Расход углерода по реакции (5) равен 0,860 кг на 1 кг кремния.
Оценим энергетический баланс процесса получения Si из SiO2 по реакциям (1)-(4):
Отсюда удельный расход энергии -23·10 3 кДж/1 кг Si или 6,4·10 3 кВт·ч/1т Si. Для сравнения расход электроэнергии на 1т электролизного алюминия равен (16-17)·10 3 кВт·ч/1т Al, т.е. в 2,6 раза больше удельного расхода энергии в рассматриваемом процессе с участием реакций (1)-(4). Для реализации последнего нет необходимости в использовании электроэнергии. Расход тепловой энергии на получение кремния при учете 40% к.п.д. тепловых машин в 6 раз меньше расхода тепловой энергии, затрачиваемой ТЭЦ на выработку электроэнергии для производства такого же количества алюминия в существующем электролизном производстве.
Для проверки справедливости используемого приближения линейной температурной зависимости ΔG(T) приведем термодинамический расчет реакции прямого восстановления диоксида кремния углеродом (5), исходя из термодинамических потенциалов веществ табл.4:
| Таблица 4 Термодинамические потенциалы веществ, участвующих в реакции (4) | ||||
| Термодинамические потенциалы | SiO2 | С | Si | CO |
| G (20°С), кДж/ моль | -856,98 | -137,35 | ||
| Н, кДж/ моль | -911,32 | 16,55 | -110,68 | |
| S, Дж/(моль·град) | 41,9 | 2,3732 | 18,84 | 197,85 |
Из данных табл.4 получаем следующие значения термодинамических потенциалов химической реакции прямого восстановления диоксида кремния углеродом:
ΔG(20°C)≈291,14 кДж/моль; ΔН≈328,43 кДж/моль; AS≈183,95 Дж/(моль·град).
Заметим, что в соответствии с известным законом Гесса, получено близкое совпадение ЛИ для реакции прямого восстановления и АН процесса (1) — (4). Из ΔG(20°C) и ΔS определяем минимальную температуру реакции (5):
Таким образом, при температурах предлагаемого процесса реакция (5) является запрещенной. В производстве кремния она реализуется при Т≥1600°С.
Одним из основных преимуществ предложенного в настоящей работе процесса с участием реакций (1)-(4) — более низкие (на 500-600°С) температуры его реализации по сравнению с прямым восстановлением SiO2 углеродом в электропечах.
Другое исключительно важное преимущество для получения чистого кремния преимущество — отсутствие прямого контакта с углеродом. Основные реакции проходят без его участия. Применение углерода связано только с получением Zn из ZnSiO3, являются сырьем. В нашем случае ZnSiO3 является промежуточным продуктом процесса, который может быть использован для получения израсходованного цинка.
В связи с использованием цинка в качестве восстановителя диоксида кремния в расплаве NaCl важно рассмотреть вопрос о химическом взаимодействии кремния с цинком. По данным работы [Диаграммы состояния двойных металлических систем. Справочник в 3-х томах, Т.3, Кн.2, под редакцией академика РАН Н.П.Лякишева, — М.: Машиностроение, 2001. 448 с.] оно отсутствует. Однако при изучении реакции (1) нами был обнаружен ряд химических соединений цинка с кремнием — силицидов цинка ZnmSin.
1. Способ получения кремния или силицида цинка из диоксида кремния путем осуществления самопроизвольной реакции в среде расплавленного шлака, отличающийся тем, что расплавленный шлак представляет собой трехкомпонентную электролитную среду, включающую хлорид натрия, диоксид кремния и цинк, а самопроизвольную реакцию осуществляют при температуре выше, чем температура испарения образующегося хлорида цинка, но ниже температуры испарения цинка с образованием кремния, силикатов натрия и паров хлорида цинка.
2. Способ по п.1, отличающийся тем, что осуществляют дальнейшую реакцию в расплаве хлорида цинка с образовавшимся силикатом натрия и последующее восстановление цинка из образовавшегося силиката цинка с помощью углерода.
3. Способ по п.2, отличающийся тем, что дополнительно осуществляют восстановление кремния из его диоксида с помощью углерода при температуре не выше температуры испарения цинка.
http://chemege.ru/silicium/
http://findpatent.ru/patent/234/2345950.html