Оксид кремния (IV)
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) SiO2 – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
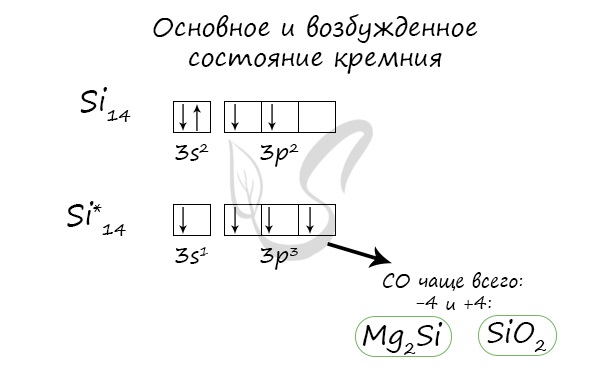
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Оксид кремния (IV): свойства, получение и применение
Введение
В вашей квартире ремонт, и необходимо купить керамическую плитку. В магазине, долго перебирая различные варианты форм и расцветок, вы нашли подходящую и, направляясь к кассе, мельком взглянули на ту часть упаковки с плиткой, где написан ее состав. Почти все ингредиенты знакомы, но один из них вызвал у вас удивление — оксид кремния. Естественно, вы захотите узнать о нем побольше. Сегодня я постараюсь удовлетворить ваш интерес.
Кремний имеет переменную валентность, и из-за этого в химии известно два его соединения с кислородом. Сегодня мы рассмотрим высший оксид кремния, в котором последний имеет валентность IV.
Название
В разных источниках его могут обозвать диоксидом кремния, кремнезёмом или оксидом силиция.
Свойства
Он является кислотным оксидом, которому присущи твердость и прочность. Если нагреть его и любую щелочь/основный оксид, то они будут взаимодействовать друг с другом. Это соединение кремния — стеклообразующее, т. е. из него может получиться переохлажденный расплав — стекло.
Получение
В промышленности оксид кремния получают, нагревая кремний в кислородной среде. Он окисляется и образует искомый продукт. Также его добывают при помощи термического оксидирования. В лаборатории оксид кремния получают при действии любых кислот на растворимый силикат, для этого подходит даже слабая уксусная. К примеру, если соединить ее и силикат натрия, продуктом реакции станет ацетат натрия и кремниевая кислота. Тут же произойдет разложение последней, и продуктами ее распада станут вода и искомый оксид.
С помощью оксида кремния производят стекло, керамику, абразивы, бетонные изделия, а также получают сам кремний. Еще он выполняет роль наполнителя в отрасли производства резины. Кристаллы аморфной модификации оксида кремния — кварцевого стекла — имеют пьезоэлектрические свойства, и этим пользуются создатели радиотехники, ультразвуковых установок и зажигалок. Силикаты и кремнезёмы — почти 90% массы литосферы. Также оксид кремния известен как пищевая добавка E551. Это его аморфная непористая разновидность. Она предотвращает слеживание и комкование пищи, в фармацевтике используется как вспомогательное вещество и лекарственный препарат-энтеросорбент. Пленки данного оксида служат изолятором, когда производят микросхемы и другие электронные компоненты. Также с их помощью создают волоконно-оптические кабели. А нагревательные элементы электронной сигареты были бы невозможны без кремнезёмной нити.
Заключение
Вот как широко используется данный оксид. И чтобы увидеть его, не нужно бежать в магазин и любопытства ради рассматривать цемент и бетон. Природный оксид кремния находится у нас под ногами — это обыкновенный песок. Оказывается, и он может быть полезным.
http://studarium.ru/article/167
http://www.syl.ru/article/88693/oksid-kremniya-iv-svoystva-poluchenie-i-primenenie