Основные положения протолитической теории кислот и оснований Бренстеда-Лоури
Кислоты – молекулы или ионы, способные в данной реакции отдавать катион водорода
Кислота – донор протонов
Основания – молекулы или ионы, способные в данной реакции присоединять протоны (акцепторы протонов)
Основания – акцепторы протонов.
С каждой кислотой сопряжено основание, в которое она переходит, теряя протоны.
Каждой кислоте соответствует свое основание и каждому основанию — своя кислота. Эту пару сопряженных веществ называют кислотно-основной или протолитической парой. Каждый отдельный компонент этой пары называется протолитом. Кислота и основание одной протолитической пары называются сопряженными протолитами (сопряженными кислотой и основанием).
Чем сильнее кислота, тем слабее сопряжённое с ней основание.
Согласно протонной теории кислоты подразделяют на 3 типа:
нейтр. к-та основание сопряжённая к-та сопряжённое основание
2) Катионные кислоты, представляющие собой положительные ионы, например NH4 + , H3O + :
3) Анионные кислоты, представляющие собой отрицательные ионы, например HSO4 — , H2PO4 — , HPO4 2- и др.
анионная к-та основание сопряжённая к-та сопряжённое основание
Подобного рода классификация имеется и для оснований:
2) Анионные основания, представляющие собой отрицательные ионы, например Cl — , CH3COO — , OH — :
3) Катионные основания, представляющие собой положительные ионы, например H2N-NH3 +
Связь между константой кислотности и константой основности в сопряженной протолитической паре.
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы равновесия. Например, для электролитической диссоциации (протолиза) уксусной кислоты, протекающей под действием молекул воды,
константа равновесия имеет вид
| Кa = | [H3O + ][CH3COO – ]/ [CH3COOH] |
Здесь в числителе дроби стоят равновесные концентрации ионов — продуктов диссоциации, а в знаменателе — равновесная концентрация недиссоциированных молекул.
Константа протолитического равновесия, определяющая полноту протекания протолиза слабой кислоты при данной температуре, называется константой кислотности.
Аналогично для протолиза слабого основания
существует константа основности, определяющая полноту протекания протолиза слабого основания при данной температуре
| Кb = | [NH4 + ][OH – ]/ [NH3 · HOH] |
Величины Ка и Кb для сопряженной кислотно-основной пары связаны также простым соотношением.
Амфолиты.
Амфолиты — амфотерные электролиты, т. е. вещества, молекулы которых содержат одновременно и кислотные, и основные группы, и поэтому в водных растворах диссоциируют и как кислоты с отщеплением водородных ионов Н + , и как основания с отщеплением гидроксильных ионов ОН — .
К амфолитам относятся биологически важные вещества: аминокислоты , пептиды , белки и др. Кислотные свойства этих веществ обусловлены наличием в них карбоксильных групп СООН, а основные свойства — содержанием аминогрупп NH2. К амфолитам также относится вода.
Теория Льюиса.
Кислоты Льюиса – это молекулы или ионы, имеющие вакантные электронные орбитали, вследствие чего они могут акцептировать электронную пару. (пример – протон водорода, катионы металлов, оксиды некоторых неметаллов (SO3, SiO2), ряд солей (AlCl3 и др.))
Основания Льюиса – это молекулы и ионы, имеющие пару электронов, являющиеся донорами электронных пар. Примеры: все анионы, аммиак, вода, спирты, галогены и др.
Взаимодействие между кислотой и основанием заключается в образовании донорно-акцепторной связи между реагирующими частицами.
Принцип жестких и мягких кислот (ЖМКО).
Основан на теории Льюиса.
Жёсткие кислоты – это акцепторы электронной пары, обладающие малым размером, значительным положительным зарядом, большой электроотрицательностью и низкой поляризуемостью.
Примеры: протоны водорода, катиона лития, магния, калия, натрия, алюминия, хрома. Молекулы BF3, AlCl3 и др.
Жёсткие основания – донорные частицы с высокой электроотрицательностью, низкой поляризуемостью. Соединения прочно удерживают электроны.
Примеры: гидроксид-ион, фторид-ион, хлорид-ион, нитрат-ион, NH3, R-NH2, H2O, спирты, эфиры.
Мягкие кислоты – кислоты Льюиса, содержащие акцепторные атомы с малым положительным зарядом, большим размером, низкой электроотрицательностью, высокой поляризуемостью.
Примеры: Катионы серебра, меди (I), ртути, I + , Br +
Мягкие основания – основания Льюиса, содержащие донорные частицы с низкой электроотрицательностью, высокой поляризуемостью.
Слабо удерживают валентные электроны.
Примеры: I — , H — , C6H6, алкены
Суть принципа ЖМКО: жёсткие кислоты реагируют с жёсткими основаниями, мягкие кислоты – с мягкими основаниями.
Билет 18. Автопротолиз воды. Константа автопротолиза воды. Водородный показатель (pH) как количественная мера активной кислотности и основности. Определение активной концентрации ионов водорода.
Автопротолиз воды.
Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
Наличие водородных связей в жидкой воде объясняет её автопротолиз
Для воды характерна протолитическая амфотерность. Реакция самоионизации (автопротолиза) воды, в ходе которой протон от одной молекулы воды (кислоты) переходит к другой молекуле воды (основанию) описывается уравнением:
Константа равновесия для уравнения автопротолиза воды равна 1,82*10 -16
Основания. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Основания – сложные вещества, которые состоят из катиона металла Ме + (или металлоподобного катиона, например, иона аммония NH4 + ) и гидроксид-аниона ОН — .
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания . Также есть неустойчивые основания, которые самопроизвольно разлагаются.
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например , оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например , калий реагирует с водой очень бурно:
2K 0 + 2 H2 + O → 2 K + OH + H2 0
3. Электролиз растворов некоторых солей щелочных металлов . Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например , электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например , гидроксид меди (II) взаимодействует с сильной соляной кислотой:
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например , гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например , гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4 Fe +2 (OH)2 + O2 0 + 2H2O → 4 Fe +3 ( O -2 H)3
Химические свойства щелочей
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли , а в растворе – комплексные соли .
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например , при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
Например , при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе , при условии, что в продуктах образуется газ или осадок . Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Например , гидроксид калия взаимодействует с раствором нитрата аммония:
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид , взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла .
Например , избыток сульфата цинка реагирует в растворе с гидроксидом калия:
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей . Т аким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например , гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Протолитическая теория кислот и оснований
(Теория Бренстеда и Лоури)
По протолитической, или протонной теории кислота – это соединение, частица которого может отдать протон (Н + ) другой частице – основанию. Согласно этой теории кислоты и основания — это вещества, теряющие и приобретающие протоны и называемые протолитами. Передача протона от кислоты к основанию называется протолизом. Кислота–донор протонов,а основание–акцептор Н + .
В результате отдачи протона сама кислота превращается в сопряженное ей основание. Основание – акцептор Н + — превращается в сопряженную ему кислоту.
В следующей реакции протолитического равновесия:
НА + В ⇄А — + НВ + (14)
НА – кислота, А — — сопряженное ей основание; В – основание, НВ + — сопряженная ему кислота.
Таким образом, в равновесной протолитической реакции присутствуют две сопряженные пары «кислота / основание»: НА /А — и НВ + / В.
Кислоты и основания, или протолиты, могут быть нейтральными (молекулы), катионными или анионными:
Анионные Молекулярные Катионные
протолиты протолиты протолиты
Протонодонорная способность вещества — это его кислотность; протоноакцепторная способность — это основность. Эти свойства определяются сродством к протону, т.е. величиной энтальпии реакции присоединения протона.
При кислотно-основном взаимодействии роль основания играет тот партнер, у которого протонное сродство выше.
Из термохимических уравнений:
NH3(г) + H + (г) 
H2O(г) + H + (г) 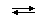
OH — (г) + H + (г) 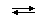
F — (г) + H + (г) 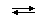
1) NH3 — более сильный акцептор протона и более сильное основание, чем H2O, а NH4 + , наоборот, более слабый донор протона и более слабая кислота, чем H3O + ;
2) OH — — более сильное основание, чем F — , а H2O — более слабая кислота, чем HF.
Количественной характеристикой состояния протолитического равновесия обратимой реакции между кислотой HA и основанием (растворителем) HL
HA(s) + HL 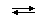
является величина Kк — константа кислотности:
Чем больше значение Kк, тем более сильной кислотой является протолит HA в данном растворителе HL.
Количественной характеристикой состояния протолитического равновесия в реакции между основанием B и кислотой (растворителем) HL
В + HL 
является величина Kо — константа оснόвности:
Kо = [HB + ] . [L — ] / [B] = Const = f(T). (16)
Чем больше значение Kо, тем более сильным основанием является протолит B в данном растворителе HL.
Пример 2.1.
где HCl — кислота, а Н2О – основание.
http://chemege.ru/base/
http://helpiks.org/7-18361.html











