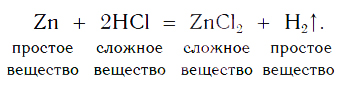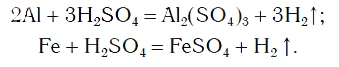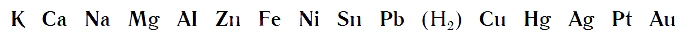Урок 24. Выделение водорода в реакциях кислот с металлами
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.
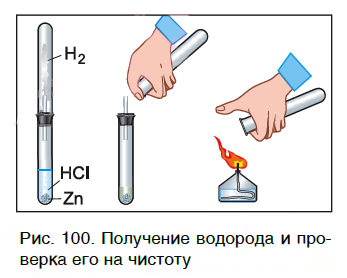
Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа. В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок. Это свидетельствует о наличии в пробирке водорода.
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
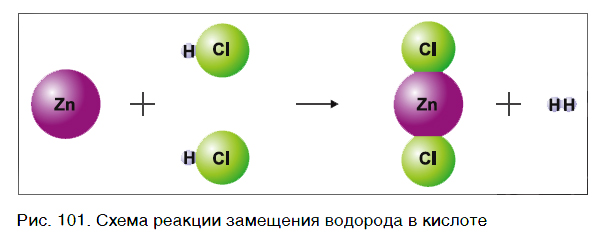
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода,
способных замещаться на атомы металла, и кислотных остатков.
Вытеснительный ряд металлов
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
- Будут ли реагировать металлы с кислотами с выделением водорода;
- Насколько активно будут протекать эти реакции.
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей. Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий. Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
- Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- Металлы, стоящие в вытеснительном ряду до водорода, вытесняют его из кислот.
- В лаборатории водород получают в реакции металлов с кислотами.
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Получение водорода
История открытия водорода История водорода начинается с XVI века, когда было замечено, что при действии кислот на железо и другие металлы выделяется некий неизвестный газ. Первоначально его назвали «горючим воздухом». Такое название газ получил из-за способности гореть. Во второй половине XVIII века английский ученый Генри Кавендиш получил водород при действии соляной кислоты HCl на цинк:
Zn + 2HCl = ZnCl2 + H2
Что же такое кислота с точки зрения химии? Кислота – это сложное вещество, в состав которого всегда входят атомы водорода. В формулах кислот атомы водорода принято писать на первом месте. Атомы, следующие в формуле за водородом, называют кислотным остатком. Так, в соляной кислоте HCl кислотный остаток – Cl.
Например, в серной кислоте H2SO4, кислотный остаток – SO4. Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток Генри Кавендиш изучил свойства «горючего воздуха». Он установил, что этот газ намного легче воздуха, а при сгорании на воздухе образует прозрачные капли жидкости. Этой жидкостью оказалась вода.
Генри Кавендиша считают первооткрывателем водорода. Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лораном Лавуазье. Антуан Лоран Лавуазье дал этому веществу латинское название (Hydrogenium), которое происходило от греческих слов «хюдор» – вода и «геннао» – рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у просто вещества H2. Русское слово водород – это точный перевод латинского названия Hydrogenium.
Получение водорода в лаборатории
Современный лабораторный способ получения водорода не отличается от того, которым его получал Генри Кавендиш. Это реакции металлов с кислотами. В лаборатории водород получают в аппарате Киппа (рисунок 152).
Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
- реакционная колба с резервуаром;
- воронка с длинной трубкой;
- газоотводная трубка.
Реакционная колба имеет верхнюю шарообразную часть с отверстием, в которое вставляется газоотводная трубка, снабженная краном или зажимом, и нижний резервуар в виде полусферы. Нижний резервуар и реакционная колба разделены резиновой или пластиковой прокладкой с отверстием, через которое проходит в нижний резервуар длинная трубка воронки, доходящая почти до дна. На прокладку через боковое отверстие шпателем насыпают твёрдые вещества (мрамор, цинк). Отверстие закрывается пробкой с газоотводной трубкой. Затем при открытом кране или зажиме в верхнюю воронку заливается раствор кислоты. Когда уровень жидкости достигает вещества на прокладке, начинается химическая реакция с выделением газа. При закрытии крана давление выделяющегося газа выдавливает жидкость из реактора в верхнюю часть воронки. Реакция прекращается. Открытие крана приводит к возобновлению реакции. Поместим в реакционную колбу кусочки цинка. В качестве кислоты воспользуемся серной кислотой. При контакте цинка и серной кислоты протекает реакция:
Zn + H2SO4 = ZnSO4 + H2
Водородом можно заполнить мыльный пузырь.
Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода. Соберем выделяющийся водород. С учетом того, что водород намного легче воздуха, для сбора водорода сосуд, в котором собирается газ, необходимо располагать вверх дном, или производить собирание методом вытеснения воды. Как обнаружить водород? Заполним пробирку водородом, держа ее вверх дном, по отношению к газоотводной трубке. Поднесем пробирку отверстием к пламени спиртовки – слышится характерный хлопок.
Хлопок – это признак того, что в пробирке содержится водород. При поднесении пробирки к пламени водород вступает в реакцию с кислородом, содержащимся в воздухе. При малых количествах реакция кислорода и водорода сопровождается хлопком. Более подробно об этой реакции будет рассказано в следующем параграфе.
Получение водорода в промышленности
Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
2H2O эл.ток → 2H2 + O2.
Данный метод позволяет получить чистый водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.
Электролиз – химическая реакция, протекающая под действием электрического тока Проведем электролиз воды. В стакан наполненный водой, опустим металлические электроды. Поверх электродов опустим в стакан пробирки, заполненные водой. Подсоединим электроды к источнику тока – батарейке. В пробирках наблюдается выделение газов – водорода и кислорода, которые вытесняют воду. Наблюдая за процессом электролиза, можно заметить, что в одной из пробирок газа собирается в два раза больше, чем в другой. Проанализировав уравнение реакции электролиза воды, можно сделать вывод, в какой пробирке выделяется водород, а в какой – кислород. Попробуйте это сделать самостоятельно.
Существуют и другие способы получения водорода. Железо-паровой метод долгое время широко применялся в промышленности. Через электрическую трубчатую печь проходит трубка из нержавеющей стали, заполненная железными стружками. Через трубку с железными стружками пропускают водяной пар. При температуре около 800°С пары воды взаимодействуют с железом, образуя оксид Fe3O4 (железную окалину) и газообразный водород:
3Fe + 4Н2О = 4Н2 + Fe3O4.
Можно получить Н2, пропуская Н2О через слой раскаленного угля. При этом образуется смесь двух газов – СО и Н2 (водяной газ):
Н2О + С = CO + Н2
В настоящее время водород получают взаимодействием углеводородов (в основном метана, СН4) с водяным паром или неполным окислением метана кислородом:
2СН4 + О2 = 2СО + 4Н2
Итог статьи:
- В лаборатории водород получают в аппарате Киппа
- Исходными веществами для получения водорода в лаборатории являются некоторые металлы и кислоты
- Собирать водород нужно методом вытеснения воды, или методом вытеснения воздуха, расположив пробирку вверх дном по отношению к газоотводной трубке
- Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток
- Обнаружить водород можно по характерному хлопку при поднесении пробирки с водородом к пламени
- Одним из промышленных способов получения водорода является электролиз воды
- Электролиз – химическая реакция, протекающая под действием электрического тока
Получение водорода в промышленности и в лаборатории
Задача 785.
Почему в периодической системе элементов водород относят как к I, так и к VII группе?
Решение:
Атом водорода содержит один электрон, его электронная конфигурация имеет вид: 1s 2 . Поэтому атом водорода способен как отдавать, так и присоединять по одному электрону. Таким образом, образом водород проявляет двойственную химическую природу, как окислительную, так и восстановительную способность. В большинстве реакций водород выступает в качестве восстановителя, образуя соединения, в которых степень его окисленности равна +1. в реакциях с активными металлами водород выступает в качестве окислителя, степень окисленности его при этом равна -1. Итак, водород, отдавая электрон, проявляет сходство с металлами I-й группы главной подгруппы периодической системы химических элементов, а, присоединяя электрон, — с неметаллами VII-й группы главной подгруппы. Поэтому водород в периодической системе обычно помещают в главной подгруппе I-й группы и, в тоже время, в скобках, помещают в главной подгруппе VII-й группы.
Задача 786.
Как получают водород в промышленности и в лаборатории? Привести уравнения реакций.
Решение:
а) Получение водорода в промышленности:
1. Получение синтез-газа:
3. Электролиз водного раствора едкого натра или едкого калия. Используют 25% NaOH или 34% КОН. Электроды изготавливают из листового никеля. При этом на катоде выделяется водород, а на аноде – кислород:
Катодный процесс: 2Н2О + 2 
Анодный процесс: 4ОН — — 4 
4. Вытеснение водорода из воды различными металлами. Метод основан на том, что активные металлы вытесняют водород из воды, например, натрий и кальций разлагают воду при обычных условиях, магний – при нагревании, цинк – при накаливании с водяным паром, железо – при нагревании около 700 о C . Чаще всего используют в промышленности для получения водорода так называемый железо-паровой метод:
5. Получение водорода из природного газа. В промышленности по этому методу природный газ смешивают с кислородом и водяным паром при нагревании данной смеси до 800-900 0 С в присутствии катализатора (пароводяная и кислородная конверсия):
6. Метод выделения водорода из коксового газа или из газов переработки нефти. Метод основан на глубоко охлаждении газовой смеси, при котором все газы кроме водорода сжижаются – водород остаётся в газовой фазе, которую под давлением собирают в баллоны.
7. Метод получения водорода при получении сажи из природного газа:
8. Метод получения водорода при пропускании паров воды над раскалённым углем при температуре 10000 о C (водяной газ, содержащий до 86% угарного газа и водорода):
б) Получение водорода в лабораторных условиях:
1. Метод растворения цинка в холодной соляной кислоте или в разбавленной серной кислоте:
2. Растворение алюминия с сильными щелочами:
3. Электролиз раствора КОН (электроды из листового никеля):
Катодный процесс: 2Н2О + 2 
Анодный процесс: 4ОН — — 4 
4. Действие порошком алюминия на кипящую воду в присутствии нескольких капель разбавленного перманганата калия:
5. В полевых условиях водород получают из смеси (порошок ферросилиция с сухим Са(ОН)2 и NaOH). При поджигании данной смеси сначала она начинает тлеть, а затем наблюдается выделение водорода:
Смесь называется гидрогенит.
Задача 787.
Можно ли для электролитического получения водорода использовать в качестве электролита водные растворы H2SO4, K2,SO4 KCl, CuSO4, NaOH? Ответ обосновать.
Решение:
Электродные потенциалы калия, натрия и меди соответственно равны -2,92 В, -2,714 В и +0,337 В, а водородного электрода в кислой в щелочной и в нейтральной средах соответственно равен 0,00 В, -0,83 В и -0,41 В. При этом на катоде происходит электрохимическое выделение водорода в зависимости от условий среды:
Катодный процесс:
В кислой среде: 2H + + 2 
В щелочной или нейтральной среде: 2Н2О + 2
Следовательно, при электролизе H2SO4 будет разряжаться ионы водорода и выделяться газообразный водород.
При электролизе K2SO4 и KCl происходит электрохимическое восстановление воды, результатом которого будет выделение водорода и гидроксид-ионов, потому что электродный потенциал калия (-2,92 В) значительно электроотрицательнее, чем потенциалы -0,41В и -0,83 В.
При электролизе раствора CuSO4 будет происходить разряд ионов меди и, при этом на катоде выделится металлическая медь, потому что электродный потенциал меди значительно положительнее, чем потенциал водородного электрода.
При электролизе NaOH происходит электрохимическое восстановление воды, результатом которого будет выделение водорода и гидроксид-ионов, потому что электродный потенциал натрия (-2,714 В) значительно электроотрицательнее, чем потенциалы -0,41 В и -0,83 В.
Таким образом, для электрохимического получения водорода можно использовать растворы H2SO4, K2SO4 KCl и NaOH.
Задача 788.
Железо-паровой метод получения водорода основан на обратимой реакции:
Fe + 4H2O = Fe3O4 + 4H2 ↑ . В каких условиях следует осуществлять этот процесс, чтобы реакция протекала до практически полного окисления железа?
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции следует, что из четырёх молекул парообразной воды образуется четыре молекулы газообразного водорода, т.е. реакция протекает без изменения числа молей газообразных веществ, поэтому равновесие системы не нарушается при изменении давления. В данном случае при удалении продукта реакции водорода из реакционной зоны равновесие системы согласно принципу Ле Шателье сместится вправо, в сторону увеличения образования водорода. Но лучше всего выводить из реакционной системы твёрдый продукт Fe3O4, что будет способствовать смещению равновесия вправо, если железную окалину направлять на регенерацию, допустим посредством накаливания окалины в струе паровоздушной смеси и, затем, возвратить образуемое металлическое железо в реакционную зону. Избыток металлического железа будет способствовать ускорению реакции и, следовательно, увеличению продукта реакции. Таким образом, отведение водорода и регенерация железа способствуют протеканию реакции до практически полного окисления металлического железа.
http://idaten.ru/chemistry/poluchenie-vodoroda
http://buzani.ru/zadachi/khimiya-glinka/1261-sposoby-polucheniya-vodoroda-zadachi-785-788