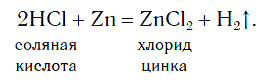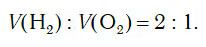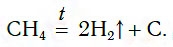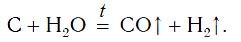Получение водорода
История открытия водорода История водорода начинается с XVI века, когда было замечено, что при действии кислот на железо и другие металлы выделяется некий неизвестный газ. Первоначально его назвали «горючим воздухом». Такое название газ получил из-за способности гореть. Во второй половине XVIII века английский ученый Генри Кавендиш получил водород при действии соляной кислоты HCl на цинк:
Zn + 2HCl = ZnCl2 + H2
Что же такое кислота с точки зрения химии? Кислота – это сложное вещество, в состав которого всегда входят атомы водорода. В формулах кислот атомы водорода принято писать на первом месте. Атомы, следующие в формуле за водородом, называют кислотным остатком. Так, в соляной кислоте HCl кислотный остаток – Cl.
Например, в серной кислоте H2SO4, кислотный остаток – SO4. Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток Генри Кавендиш изучил свойства «горючего воздуха». Он установил, что этот газ намного легче воздуха, а при сгорании на воздухе образует прозрачные капли жидкости. Этой жидкостью оказалась вода.
Генри Кавендиша считают первооткрывателем водорода. Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лораном Лавуазье. Антуан Лоран Лавуазье дал этому веществу латинское название (Hydrogenium), которое происходило от греческих слов «хюдор» – вода и «геннао» – рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у просто вещества H2. Русское слово водород – это точный перевод латинского названия Hydrogenium.
Получение водорода в лаборатории
Современный лабораторный способ получения водорода не отличается от того, которым его получал Генри Кавендиш. Это реакции металлов с кислотами. В лаборатории водород получают в аппарате Киппа (рисунок 152).
Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
- реакционная колба с резервуаром;
- воронка с длинной трубкой;
- газоотводная трубка.
Реакционная колба имеет верхнюю шарообразную часть с отверстием, в которое вставляется газоотводная трубка, снабженная краном или зажимом, и нижний резервуар в виде полусферы. Нижний резервуар и реакционная колба разделены резиновой или пластиковой прокладкой с отверстием, через которое проходит в нижний резервуар длинная трубка воронки, доходящая почти до дна. На прокладку через боковое отверстие шпателем насыпают твёрдые вещества (мрамор, цинк). Отверстие закрывается пробкой с газоотводной трубкой. Затем при открытом кране или зажиме в верхнюю воронку заливается раствор кислоты. Когда уровень жидкости достигает вещества на прокладке, начинается химическая реакция с выделением газа. При закрытии крана давление выделяющегося газа выдавливает жидкость из реактора в верхнюю часть воронки. Реакция прекращается. Открытие крана приводит к возобновлению реакции. Поместим в реакционную колбу кусочки цинка. В качестве кислоты воспользуемся серной кислотой. При контакте цинка и серной кислоты протекает реакция:
Zn + H2SO4 = ZnSO4 + H2
Водородом можно заполнить мыльный пузырь.
Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода. Соберем выделяющийся водород. С учетом того, что водород намного легче воздуха, для сбора водорода сосуд, в котором собирается газ, необходимо располагать вверх дном, или производить собирание методом вытеснения воды. Как обнаружить водород? Заполним пробирку водородом, держа ее вверх дном, по отношению к газоотводной трубке. Поднесем пробирку отверстием к пламени спиртовки – слышится характерный хлопок.
Хлопок – это признак того, что в пробирке содержится водород. При поднесении пробирки к пламени водород вступает в реакцию с кислородом, содержащимся в воздухе. При малых количествах реакция кислорода и водорода сопровождается хлопком. Более подробно об этой реакции будет рассказано в следующем параграфе.
Получение водорода в промышленности
Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
2H2O эл.ток → 2H2 + O2.
Данный метод позволяет получить чистый водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.
Электролиз – химическая реакция, протекающая под действием электрического тока Проведем электролиз воды. В стакан наполненный водой, опустим металлические электроды. Поверх электродов опустим в стакан пробирки, заполненные водой. Подсоединим электроды к источнику тока – батарейке. В пробирках наблюдается выделение газов – водорода и кислорода, которые вытесняют воду. Наблюдая за процессом электролиза, можно заметить, что в одной из пробирок газа собирается в два раза больше, чем в другой. Проанализировав уравнение реакции электролиза воды, можно сделать вывод, в какой пробирке выделяется водород, а в какой – кислород. Попробуйте это сделать самостоятельно.
Существуют и другие способы получения водорода. Железо-паровой метод долгое время широко применялся в промышленности. Через электрическую трубчатую печь проходит трубка из нержавеющей стали, заполненная железными стружками. Через трубку с железными стружками пропускают водяной пар. При температуре около 800°С пары воды взаимодействуют с железом, образуя оксид Fe3O4 (железную окалину) и газообразный водород:
3Fe + 4Н2О = 4Н2 + Fe3O4.
Можно получить Н2, пропуская Н2О через слой раскаленного угля. При этом образуется смесь двух газов – СО и Н2 (водяной газ):
Н2О + С = CO + Н2
В настоящее время водород получают взаимодействием углеводородов (в основном метана, СН4) с водяным паром или неполным окислением метана кислородом:
2СН4 + О2 = 2СО + 4Н2
Итог статьи:
- В лаборатории водород получают в аппарате Киппа
- Исходными веществами для получения водорода в лаборатории являются некоторые металлы и кислоты
- Собирать водород нужно методом вытеснения воды, или методом вытеснения воздуха, расположив пробирку вверх дном по отношению к газоотводной трубке
- Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток
- Обнаружить водород можно по характерному хлопку при поднесении пробирки с водородом к пламени
- Одним из промышленных способов получения водорода является электролиз воды
- Электролиз – химическая реакция, протекающая под действием электрического тока
ПОЛУЧЕНИЕ ВОДОРОДА ТЕРМИЧЕСКИМ РАЗЛОЖЕНИЕМ ВОДЫ
Общеизвестно, что водяной пар при высоких температурах разлагается на водород и кислород Эти газы могут быть сепарированы с помощью соответствующей методики, например, при использовании палладиевого филь-
тра. Данная методика обсуждалась выше в параграфе об очистке водорода монооксида углерода СО. Хотя на первый взгляд этот способ получения во рода может показаться привлекательным, однако его практическая реализа» достаточно сложна.
Представим себе такой эксперимент. В цилиндрическом сосуде под п шнем находится 1 кмоль чистого водяного пара. Вес поршня создает в cocj постоянное давление, равное 1 атм. Пар в сосуде нагревают до температ> 3000 К. Указанные значения давления и температуры были выбраны произвс. но в качестве примера.
Если в сосуде находятся только молекулы Н20, то количество свобол энергии системы можно определить с помошью соответствующих таблиц TeD динамических свойств воды и водяного пара Однако на самом деле по край мере часть молекул водяного пара подвергается разложению на составляг ее химические элементы, т. е. водород и кислород:
поэтому полученная смесь, содержащая молекулы Н20 , Н2 и 02, будет хар-«. теризоваться другим значением свободной энергии.
Если бы все молекулы водяного пара диссоциировали, то в сосуде оказалась газовая смесь, содержащая 1 кмоль водорода и 0,5 кмоля кислорода. Количе^ свободной энергии этой газовой смеси при тех же значениях давления (1 а и температуры (3000 К) оказывается больше количества свободной энер чистого водяного пара. Отметим, что 1 кмоль водяного пара был преобразован 1 кмоль водорода и 0,5 кмоля кислорода, т. е. общее количество вещества те: составляет А’оГ)||( =1,5 кмоля. Таким образом, парциальное давление водорода б> равно 1/1,5 атм, а парциальное давление кислорода — 0.5/1,5 атм.
При любом реалистичном значении температуры диссоциация водяного п будет неполной. Обозначим долю продиссоциировавших молекул перемен F. Тогда количество водяного пара (кмоль), который не подвергся разложен будет равно (1 — F) (считаем, что в сосуде находился 1 кмоль водяного пара). К личество образовавшегося водорода (кмоль) будет равно F, а кислорода — F Получившаяся смесь будет имеет состав
(l-F)n20 + FH2 + ^F02.
Общее количество газовой смеси (кмоль)
1 2 сти прямой реакции Н20 -» Н2 + — 02 , т. е. устанавливается равновесие.
Чтобы определить точку равновесия, необходимо найти значение F при [20]
Урок 26. Получение водорода и его применение
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.
Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
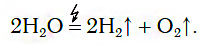
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
Существуют и другие промышленные способы получения водорода.
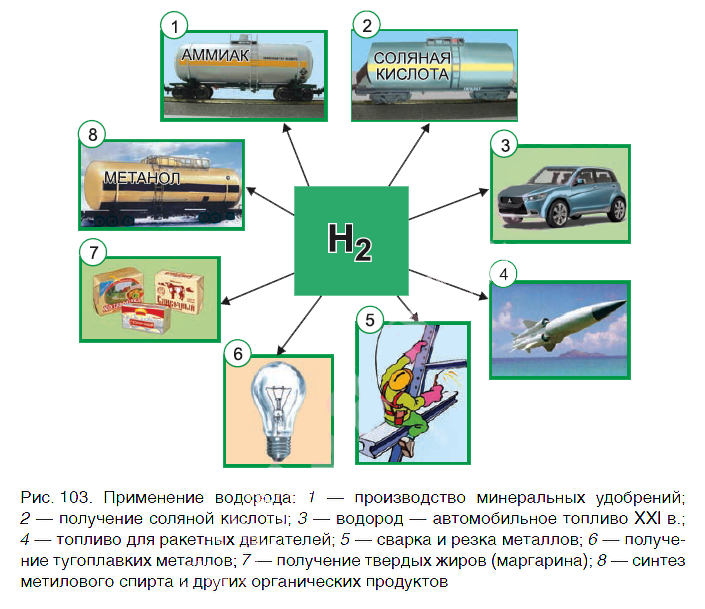
Применение водорода
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 о С. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
http://msd.com.ua/vozobnovlyaemye-istochniki-energii/poluchenie-vodoroda-termicheskim-razlozheniem-vody/
http://himi4ka.ru/arhiv-urokov/urok-26-poluchenie-vodoroda-i-ego-primenenie.html