Дихроматометрическое титрование
Дихроматометрией называется метод определения веществ, основанный на реакции их окисления дихромат-ионом. Стандартный потенциал редокс-пары
равен 1,33 В, имеет достаточно высокое значение, поэтому дихромат-ион способен окислить целый ряд веществ. Реальный потенциал редокс-пары возрастает с повышением концентрации ионов водорода в соответствии с уравнением Нернста, то есть с понижением рН среды окислительная способность дихромат-ионов увеличивается. Титрантом метода является водный раствор дихромата калия, чаще всего с эквивалентной концентрацией 0,1 моль/л .
Рабочий раствор дихромата калия можно приготовить по точной навеске. Дихромат калия удовлетворяет всем требованиям первичного стандарта, при хранении в закрытой ёмкости в тёмном месте расвор дихромата калия стабилен и не изменяет свой титр в течение длительного времени. Эквивалентное число в реакции окисления в кислотной среде z = 6. Эквивалентная масса М = Э = 49,031 г/моль
Приведём формулу расчёта кривых титрования железа (II) дихроматом калия. При титровании протекает реакция
До точки эквивалентности в растворе присутствуют как исходные ионы, так и ионы, образовавшиеся в ходе реакции
Уравнения Нернста для двух редокс-пар следующие
Расчёт потенциала до точки эквивалентности ведут по уравнению
В точке эквивалентности Е = Е1 = Е2
Проводя определённые алгебраические преобразования, получаем формулу :
Расчёт после точки эквивалентности ведут по уравнению (2).
По приведённым формулам строят кривую титрования железа (II) дихроматом калия (рис. 1).
Рис. Рассчитанная кривая ОВ титрования 100 мл кислого 0,05 моль/л раствора железа (II) раствором дихромата калия с молярной концентрацией эквивалента 0,05 иоль/л. Исходная концентрация ионов водорода [H + ] = 1 моль/л. ТЭ – точка эквивалентности.
Полученная кривая несимметрична относительно точки эквивалентности. Скачок на кривой титрования лежит в пределах от 0,95 до 1,3 В. Потенциал в точке эквивалентности равен 1, 223 В. Следовательно в качестве индикатора можно применять n-фенилантраниловую кислоту (Е = 1 В), ферроин (Е = 1,06 В), но нельзя использовать дифениламин, потенциал которого равняется 0,76 В и лежит за пределами скачка. Без индикаторов дихромат калия также не применяется, поскольку имеет недостаточно интенсивную окраску, непригодную для точной визуальной фиксации точки эквивалентности.
В аналитической практике титрование раствора Fe(II) раствором дихромата калия проводят в присутствии ортофосфорной кислоты для связывания образующегося железа (III) в прочный бесцветный фосфатный комплекс. В результате равновесие смещается в сторону образования Fe 3+ и скачок на кривой титрования расширяется в сторону более низкого потенциала и лежит в пределах от –0,68 В и до –1, 3 В. Следовательно в присутствии фосфорной кислоты ТВ можно применять в качестве индикатора также дифениламин.
Дата добавления: 2016-01-09 ; просмотров: 2439 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Окислительно-восстановительное титрование. йодато-, дихромато — и хлорйодиметрическое титрование
МОДУЛЬ № 2
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
ЙОДатО-, дИхромато — и хлорЙОДИМЕТРИЧЕСКОЕ
Цель: Дать сущность методов йодато — и дихромато — и хлориодометрического титрования, охарактеризовать титранты и применение методов в фармацевтическом анализе.
Методы, используемые на лекции:
1. По дидактическому назначению: лекция вводная, тематическая, объяснительная.
2. По роли в образовательном процессе: лекция вводная, установочная, обзорная, обобщающая.
3. По содержанию и системе построения: лекция информационная (традиционная).
4. По назначению лекция направлена на приобретение студентами знаний, на развитие творческой деятельности, а также на закрепление учебного материала. По типу познавательной деятельности на лекции применяются репродуктивные и проблемные методы изложения материала, используются наглядные методы обучения в виде презентации по данному разделу
1. Дидактические: презентация.
2. Материально технические: мел, доска, мультимедийный проектор, экран.
1. Организационный момент 3 мин (название темы и плана лекции).
2. Традиционное прочитывание лекции 40 мин — I час лекции.
4. Второй час лекции 40 мин.
5. Заключительная часть лекции — выборочная проверка студентов на лекции 21ф, 22ф группы 5 мин.
Йодатометрическое титрование. Сущность метода. Титрант метода, его приготовление, стандартизация.
1.3. Индикаторы метода, определение конечной точки титрования.
Иодатометрия, или йодатометрическое титрование ‒ это определение различных восстановителей титрованием раствором иодата калия KIO3. Метод – фармакопейный.
Сущность метода. В основе метода лежит полуреакция (1):
IO3- + 6e + 6H+ = I — + 3H2O (1)
Стандартный OB потенциал редокс-пары IO3-,Н+|I — при комнатной температуре равен 1,08 В, т. е. имеет довольно высокое значение.
В соответствии с полуреакцией (1) число электронов, принимающих участие в этой полуреакции, равно n = 6; фактор эквивалентности для иодат-иона в подобных ОВ процессах равен 1/z = 1/n = 1/6. Молярная масса эквивалента иодата калия равна
М(1/6 KIO3) = М(KIO3)/6 = 35,6668 г/моль.
Молярная концентрация с(KIO3) и молярная концентрация эквивалента с(1/6 KIO3) связаны соотношением
с(1/6 KIO3) = 6с(KIO3)
Иодат-ион способен в кислой среде, в зависимости от условий, восстанавливаться также до иода в соответствии с полуреакцией
IO3- + 5e + 6H+ = 0,5I2 + 3H2O
Стандартный ОВ потенциал редокс-пары IO3-,Н+|I2 при комнатной температуре равен 1,195 В.
Титрант метода, его приготовление, стандартизация. В качестве титранта метода применяют водный раствор иодата калия KIO3 обычно с молярной концентрацией эквивалента 0,1 моль/л.
Титрант можно готовить по точной навеске иодата калия высокой степени чистоты (обычно химически чистого, «х. ч.»). Безводный KIO3 устойчив при хранении.
Для приготовления раствора иодата калия с молярной концентрацией эквивалента 0,1 моль/л точную навеску (около 3,567 г) высушенного кристаллического иодата калия тонко растирают в ступке, растворяют в дистиллированной воде в мерной колбе вместимостью 1 л и доводят объем раствора до метки.
При необходимости титрант стандартизуют следующим образом.
К 20 мл стандартизуемого раствора иодата калия, помещенного в колбу с притертой пробкой, добавляют 100 мл дистиллированной воды, 25 мл разбавленной серной кислоты, 2 г кристаллического иодида калия и оставляют колбу на 10‒15 минут в темном месте. При этом протекает реакция
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O
Образовавшийся иод титруют стандартным 0,1 моль/л раствором тиосульфата натрия в присутствии индикатора – крахмала.
Стандартные растворы иодата калия хранят в сосудах из темного
стекла с притертыми пробками, в темном месте.
Индикаторы метода, определение конечной точки титрования. В иодатометрии при визуальном определении КТТ используют либо свежеприготовленный 1%-ный раствор крахмала либо не смешивающиеся с водой органические экстрагенты − хлороформ, тетрахлорид углерода, способные экстрагировать иод из водной фазы, окрашиваясь при этом в фиолетовый цвет. При первой избыточной капле иодата калия KIO3 выделяется иод I2, крахмал синеет.
6H+ + I — + IO3- = I2 + 3H2O
В качестве индикаторов используют и некоторые красители.
Применение иодатометрии. Методом иодатометрического титрования определяют различные вещества, обладающие восстановительными свойствами, например олово(II), сурьму(III), мышьяк(III), Hg22+, железо(II), иодиды, сульфиты, тиосульфаты, тиоцианаты, аскорбиновую кислоту, гидразин, гидразид изоникотиновой кислоты и др.
Способом обратного титрования, с иодатометрическим окончанием.
можно определять и окислители, такие; как PbO2, MnO2, пероксиды водорода и бария и т. п. Рассмотрим некоторые примеры.
Определение иодидов прямым титрованием. В основе определения иодид-ионов лежат реакции (2) и (3):
5I — + IO3- + 6H+ = 3I2 + 3H2O (2)
2I2 + IO3- + 6HCl = 5ICl + Cl — + 3H2O (3)
Для проведения определения к анализируемому раствору иодида прибавляют несколько капель СС14 или СНСl3 (для фиксирования окончания титрования). Смесь титруют стандартным раствором иодата калия.
Вначале титруемый раствор темнеет вследствие образования иода по реакции (2), а затем, по мере дальнейшего прибавления титранта, постепенно светлеет до бледно-желтой окраски остаточного иода. Смесь энергично встряхивают. Иод при этом переходит в органическую фазу, которая принимает фиолетовую окраску. Титрование продолжают при энергичном встряхивании смеси до обесцвечивания органической фазы.
Определение сурьмы (III) прямым титрованием. Для определения сурьмы (III) анализируемый соляно-кислый раствор, содержащий сурьму (III), титруют стандартным раствором иодата калия. При этом протекает реакция
5H[SbCl4] + 2КIO3 + 12HC1 = I2 + 5H[SbCl6] + 2KCl + 6Н2O
Выделившийся иод реагирует с прибавляемым титрантом с образованием монохлорида иода:
2I2 + КIO3 + 6НС1 = 5IC1 + КС1 + 3Н2O
Последнюю реакцию в условиях проведения титрования можно представить также в виде
2I2 + КIO3 + 11НС1 = 5НICl2 + КС1 + 3Н2O
В качестве индикатора используют либо крахмал, либо слой органического экстрагента, окрашивающегося иодом в фиолетовый цвет.
При определении аскорбиновой кислоты к анализируемому солянокислому раствору прибавляют небольшое количество 1%-ного раствора KI и крахмала (в качестве индикатора). Затем проводят титрование стандартным раствором иодата калия до появления устойчивой синей окраски раствора.
Аскорбиновая кислота C6H8O6 окисляется иодатом калия КIO3 до дегидроаскорбиновой кислоты C6H6O6, что схематически можно описать в виде
3C6H8O6 + КIO3 = 3C6H6O6 + KI + 3H2O
Количественно по ФС определяют кислоту аскорбиновую, используя в качестве титранта-окислителя 0,1 моль/л раствор иодата калия в присутствии иодида калия:
KIO3 + 5KI + 6HCl = 3I2 + 6KCl + 3H2O
После достижения точки эквивалентности первая капля прибавленного титранта окисляет иодид-ионы до иода:
5I- + IO3- + 6H+ = 3I2 + 3H2O
который в присутствии крахмала и окрашивает раствор в синий цвет.
В основе иодатометрического определения ряда других веществ лежат реакции:
2SnCl2 + КIO3 + 6НС1 = 2SnCl4 + ICl + KCl + 3H2О
2HAsО2 + КIO3 + 2НС1 + Н2О = 2H3AsО4 + ICl + KCl
2Hg2Cl2 + KIO3 + 6HC1 = 4HgCl2 + ICl +KC1 + 3H2O
Na2S2O3 + 2KIO3 + 2HC1 = Na2SO4 + 2IC1 + K2SO4 + H2O
2KNCS + 3КIO3 + 2HCI = 2ICN + ICl + 2K2SO4 + KCl + H2O
N2H4 ∙2HCI + КIO3 = ICl + N2 + KCl + 3H2O
Дихроматометрическое титрование, или дихроматометрия, ‒ метод определения веществ, основанный на реакции их окисления дихромат-ионами. Метод ‒ фармакопейный.
Сущность метода. В основе метода лежит полуреакция
Сr2О72- + 6е + 14Н+ = 2Сr3+ + 7Н2O
Стандартный ОВ потенциал редокс-пары Сr2О72-,Н+|Сr3+ равен при комнатной температуре E° = 1,36 В, т. е. имеет довольно высокое значение, поэтому дихромат-ионы способны окислять в кислой среде целый ряд веществ-восстановителей.
Реальный ОВ потенциал редокс-пары Сr2О72-,Н+|Сr3+ возрастает с повышением концентрации ионов водорода в соответствии с уравнением Нернста:
E = E° + (0,059/6) lg([Cr2O72-][H+]14 /[Cr3+]2),
вследствие чего окислительная способность дихромат-иона увеличивается с понижением pH среды. Поэтому дихроматометрическое титрование обычно проводят в сильнокислых растворах.
Кислую среду можно создавать, прибавляя не только серную, но также ортофосфорную или хлороводородную кислоту; при концентрациях НСl, не превышающих 2 моль/л, хлорид-ионы не окисляются дихромат-ионами. При более высокой концентрации НСl в растворе или при повышении температуры возможно частичное окисление хлорид-ионов дихромат-ионами до хлора, поэтому в этих условиях дихроматометрическое титрование в присутствии хлорид-ионов не проводят.
Титрант метода. Титрантом метода является водный раствор дихромата калия К2Сr2О7, чаще всего с молярной концентрацией эквивалента 0,1 моль/л. Титрант готовят по точной навеске дихромата калия высокой степени чистоты, предварительно дважды перекристаллизованного из воды и затем высушенного при
150−200 °С. При хранении в закрытой емкости в темном месте раствор дихромата калия стабилен и не изменяет свой титр в течение длительного времени.
Фактор эквивалентности дихромата калия в соответствии с вышенаписанной полуреакцией равен 1/6; молярная масса эквивалента составляет
M(1/6 К2Сr2O7) = М(К2Сr2O7)/6 = 294,185/6 г/моль = 49,031 г/моль.
Определение конечной точки титрования. Водные растворы дихромата калия имеют оранжевую окраску, однако ее интенсивность недостаточна для надежного определения изменения цвета титруемого раствора в ТЭ. К тому же в ТЭ присутствуют катионы Сr3+, образовавшиеся при восстановлении дихромат-иона и обладающие зеленой окраской, что также затрудняет определение изменения цвета титруемого раствора в ТЭ. Поэтому дихроматометрическое титрование обычно проводят в присутствии редокс-индикаторов − дифениламина, дифениламинсульфоновой кислоты, N-фенилантраниловой кислоты. Применение дихроматометрии. Прямым дихроматометрическим титрованием можно определять ряд восстановителей, таких, как железо (II) (включая определение ферроцианидов, содержащих ферроцианид-ион [Fe(CN)6]4-), сульфиты, иодиды, арсениты, аскорбиновую кислоту, метанол, суммы окисляющихся веществ в воде и почве и т. д.
Методом обратного титрования определяют некоторые окислители.
Так, определение железа(II) ведут прямым титрованием аликвоты анализируемого раствора стандартным раствором дихромата калия в кислой среде на основе реакции
6Fe2+ + Сr2О72- + 14Н+ = 6Fe3+ + 2Сr3+ + 7Н2О
При обратном дихроматометрическом определении окислителей, таких, как нитраты, хлораты, перманганаты и др., поступают следующим образом.
К аликвоте анализируемого раствора, содержащего определяемый окислитель, прибавляют известный избыток титрованного раствора железа (II). При этом железо (II) окисляется до железа (III), на что расходуется весь окислитель, присутствовавший в анализируемом растворе. Избыток непрореагировавшего железа (II) оттитровывают стандартным раствором дихромата калия, часто − в присутствии ортофосфорной кислоты для связывания образующегося железа (III) в фосфатные комплексы, вследствие чего реакция протекает с большей полнотой, а желтая окраска аквакомплексов железа (III) исчезает.
Так можно определять нитраты:
NO3- + 3Fe2+ + 4Н+ = 3Fe3+ + NO + 2H2O
Избыток железа(II) оттитровывают раствором дихромата калия:
6Fe2+ + Cr2O72- + 14Н+ = 6Fe3+ + 2Сr3+ + 7Н2O
Аналогично определяют хлораты:
ClO3- + 6Fe2+ + 6Н+ = 6Fe3+ + Сl — + 3Н2O
6Fe2+ + Сr2O72- + 14Н+ = 6Fe3+ + 2Сr3+ + 7Н2O
Методом обратного титрования определяют и некоторые восстановители, которые медленно реагируют с раствором дихромата калия. Так, например, при определении гидрохинона к аликвоте анализируемого раствора, содержащего гидрохинон, прибавляют известный избыток раствора дихромата калия и оставляют на некоторое время. Затем избыточный дихромат калия оттитровывают раствором, содержащим железо(II).
К преимуществам можно отнести то, что стандартный раствор титранта готовится по точной навеске и не требует последующей стандартизации; титрант стабилен даже при длительном хранении; титрование можно проводить в соляно-кислой среде.
Недостатки: несколько меньший по сравнению с перманганат-ионом стандартный ОВ потенциал редокс-пары и в связи с этим более ограниченная возможность определения восстановителей; менее удобная фиксация КТТ, необходимость использования редокс-индикаторов.
Хлориодиметрия, или хлориодиметрическое титрование, − метод определения восстановителей с применением титранта − раствора монохлорида иода(I) ICl. Метод − фармакопейный.
Сущность метода. В основе хлориодиметрического титрования лежит полуреакция
IСl + 2е = I — +Сl — (1)
Стандартный ОВ потенциал редокс-пары IСl|I — при комнатной температуре равен 0,795 В.
Монохлорид иода может также восстанавливаться по схеме
2IСl + 2е = I2 +2Сl — (2)
Стандартный ОВ потенциал редокс-пары IСl|I — при комнатной температуре еще выше и равен 1,19 В.
При титровании восстановителя X с учетом полуреакции (1) выделяются иодид-ионы. После того как все количество восстановителя прореагирует с ICl, прибавляемый избыточный ICl окисляет иодид-ионы:
IСl + I — = I2 + Сl — (3)
Суммарно (1) и (3) дают полуреакцию (2).
В соответствии с полуреакцией (1) число электронов, принимаемых одной молекулой ICl, равно n = 2. Поэтому фактор эквивалентности монохлорида иода равен 1/z = 1/n = 2; молярная масса эквивалента М(1/2 IСl) = М(ICl)/2 = 162,358/2 = 81,179 г/моль. Молярная концентрация с(IСl) и молярная концентрация эквивалента c(1/2 IСl) связаны соотношением
Как окислитель монохлорид иода эффективнее иода и более устойчив.
Титрант метода, его приготовление, стандартизация. В качестве титранта в хлориодиметрии применяют раствор монохлорида иода ICl с молярной концентрацией эквивалента, равной обычно 0,1 моль/л.
Монохлорид иода представляет собой твердое вещество красного цвета с температурой плавления 27 °С. Однако раствор титранта по навеске монохлорида иода не готовят. Монохлорид иода обычно получают непосредственно в сильнокислом растворе на основе реакции
2KI + КIO3 + 6НСl = 3ICl + 3КСl + ЗН2O
между иодидом и иодатом калия в соляно-кислых растворах.
Для получения раствора монохлорида иода смесь 5,53 г иодида калия и 3,55 г иодата калия помещают в стеклянную колбу с притертой пробкой и прибавляют 50 мл дистиллированной воды, 40 мл концентрированной HCl. Смесь перемешивают до полного растворения иода, первоначально образующегося при протекании реакции. Прибавляют 10 мл хлороформа, смесь переносят в делительную воронку и взбалтывают.
Если органический слой принимает фиолетовую окраску, то это означает, что в смеси имеется некоторое количество иода. В этом случае к смеси прибавляют по каплям 1%-ный раствор КIO3 при энергичном взбалтывании до полного обесцвечивания органического слоя.
Если органический слой бесцветный, то прибавляют по каплям 1%-ный раствор KI до появления слабо-розовой окраски этого слоя.
После полного расслоения органической и водной фаз отделяют водную фазу в мерную колбу на 1 л и доводят объем раствора до метки дистиллированной водой.
Полученный раствор монохлорида иода имеет лимонно-желтый цвет.
Стандартизацию раствора монохлорида иода проводят по стандартному раствору тиосульфата натрия. Для этого 25 мл раствора монохлорида иода, полученного, как описано выше, помещают в колбу для титрования с притертой пробкой, прибавляют 1 г иодида калия и оставляют смесь на
15 минут в темном месте. При этом протекает реакция
ICl + KI = I2 + KCl
Иод, выделившийся в количестве, эквивалентном количеству прореагировавшего монохлорида иода, титруют стандартным 0,1 моль/л раствором тиосульфата натрня в присутствии крахмала до исчезновения синей окраски раствора.
Стандартизованный раствор монохлорида иода хранят в сосудах из темного стекла с притертыми пробками, в темном месте.
Поскольку раствор монохлорида иода при хранении способен несколько изменять свой титр, то каждый раз перед применением определяют заново его титр по стандартному раствору тиосульфата натрия.
При титровании восстановителей в растворе накапливаются иодид-ионы в соответствии с полуреакцией (1). После ТЭ первая же капля избыточного титранта, содержащего монохлорид иода, взаимодействует с иодид-ионами по реакции (3) с образованием иода, который тотчас же в присутствии крахмала окрашивает раствор в синий цвет; титрование заканчивают.
Определение конца титрования проводят также потенциометрически.
Условия хлориодиметрического титрования. Титрование проводят в кислой, нейтральной или слабощелочной среде. В сильнощелочных растворах протекает побочная реакция:
ICl + 2OH — = IO — + Cl — +Н2O
Образующиеся гипоиодид-ионы IO — могут сами взаимодействовать с определяемым веществом-восстановителем.
В щелочной среде протекает и другая побочная реакция:
I2 + 2OН — = IO- + I — + Н2O
с участием иода, образующегося при титровании определяемого восстановителя. Поэтому титрование в щелочных средах дает неточные результаты.
Применение хлориодиметрии. Метод используют для определения различных восстановителей, ряда органических лекарственных препаратов − сульфамидных производных, барбитуратов, тиобарбитуратов, новокаина, риванола, других органических соединений.
При прямом титровании раствором монохлорида иода можно определять ртуть (I), олово (II), мышьяк (III), сурьму (III), железо (II), иодиды, сульфиты, тиоцианаты, аскорбиновую кислоту, гидразин и его производные, гидрохинон, метионин, тиокарбамид и его производные и т. д.
Как уже отмечалось выше, в хлориодиметрии определение конца титрования часто проводят потенциометрическим методом.
Проиллюстрируем сказанное некоторыми примерами.
Железо(II) при прямом титровании можно определять на основе реакции
2Fe2+ + ICl = 2Fe3+ + I — + Сl-
в кислой среде при pH = 0,5−1,0. Для достижения высокой полноты протекания реакции титрование ведут в присутствии небольшого избытка комплексона ЭДТА, который образует с продуктом реакции ‒ железом(III) ‒ устойчивый комплексонат FeY — и тем самым сдвигает равновесие вправо. Суммарно уравнение реакции можно представить в виде
2Fe2+ + ICl + 2H2Y2- = 2FeY- + I — + Сl — +4Н+
Здесь H2Y2- − сокращенное обозначение аниона этилендиаминтет-рауксусной кислоты. В данном случае ТЭ можно фиксировать потенциометрически.
Ферроцианиды титруют до феррицианидов на основе реакции
2[Fe(CN)6]4- + 2ICl = 2[Fe(CN)6]3- + I2 + 2Сl-
в слабощелочной среде (предпочтительно в присутствии NaHCO3).
Тиоцианаты (роданиды) титруют в нейтральной, слабокислой или слабощелочной среде. Реакции можно описать следующими уравнениями. В слабощелочной среде:
NCS- + 4ICl + 8OН — = SO42- + ICN + 3I — + 4Сl — + 4Н2O
В нейтральной или слабокислой среде:
NCS — + 7ICl + 4Н2O = SO42- + ICN + 3I2 + 7Сl — + 8Н+
Титрование гидрохинона С6Н4(ОН)2 до хинона С6Н4O2 также проводят либо в слабокислой, либо в слабощелочной среде согласно следующим реакциям.
В слабокислой среде:
C6H4(OH)2 + 2ICl = С6Н4O2 + I2 + 2HCl


В слабощелочной среде:
C6H4(OH)2 + ICl + 2OH — = С6Н4O2 + I — + Cl — +2H2O


Аскорбиновую кислоту (витамин С) можно определять прямым титрованием раствором ICl на основе реакции:
C6H8O6 + ICl = C6H6O6 + I — + Cl- + 2H+


Методами обратного и заместительного титрования определяют железо (II), ртуть (I), сульфиты, фенол, резорцин, салицилаты и др.
Так, при определении железа(II) к анализируемому раствору, содержащему железо(II), прибавляют в избытке раствор ICl. При этом протекает реакция:
2Fe2+ + 2ICl = 2Fe3+ + I2 + 2Cl-
Выделившийся иод оттитровывают.
При определении Hg2Cl2 навеску препарата, содержащего хлорид ртути(I), встряхивают 2−3 минуты с известным количеством раствора IC1, взятого в избытке, в соляно-кислой среде. При этом Hg2Cl2 растворяется. После его растворения прибавляют избыток 10%-ного раствора KI и оттитровывают выделившийся иод стандартным раствором тиосульфата натрия.
При анализе органических лекарственных препаратов, способных иодироваться, к анализируемому раствору, содержащему определяемое вещество, прибавляют избыток стандартизованного раствора IC1 и оставляют смесь на некоторое время для протекания реакции. Затем к смеси прибавляют избыток иодида калия и выделившийся иод оттитровывают стандартным раствором тиосульфата натрия в присутствии индикатора − крахмала.
Так поступают, например, при определении лактата этакридина на основе реакций:
Константа равновесия редокс-реакции
Рассмотрим окислительно-восстановительное равновесие
для которого можно записать полуреакции
где n – число электронов, участвующих в ОВ–реакции.
Если компоненты этой системы находятся в химическом равновесии,
то электродные потенциалы полуреакций равны (ЕА = ЕВ). Выразим электродные потенциалы полуреакций из уравнения Нернста, тогда при равновесии







где n – число электронов, участвующих в ОВ – реакции.
Для аналитических целей используются реакции, которые протекают
на 99,9 %, то есть:
Кравн = 

В случае одноэлектронного перехода, когда n1 = n2 = 1, необходимая минимальная разность потенциалов для протекания реакции на 99,9 % следующая:

В методах окислительно-восстановительного титрования в качестве титрантов – окислителей используют растворы брома, йода, солей
церия (IV), перманганата калия (KMnO4), бихромата калия (K2Cr2O7), бромата (BrO3 – ), йодата (IO3 – ), в качестве титрантов – восстановителей применяют растворы солей Fe 2+ ,Cr 2+ , Sn 2+ ,Ti 3+ , арсенит натрия (NaH2AsO3), оксалат – ион (C2O4 2- ), аскорбиновую кислоту (C6H8O6).
Название окислительно-восстановительного метода титриметрического анализа зависит от названия реагента, используемого в качестве титранта. Классификация методов окислительно-восстановительного титрования
1. Перманганатометрия: титрант KMnO4.
MnO4 — +8H + + 5e = Mn 2+ + 4H2O, 
Cr2O7 2- +14H + +6e=2Cr 3+ +7H2O, 
Основные уравнения: I2 +2e « 2I — , 
2S2O3 2- – 2e « S4O6 2- , 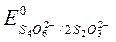
4. Броматометрия: титрант KBrO3.
Основное уравнение: BrO3 — +6H + +6e = Br — +3H2O, 
5. Нитритометрия: титрант NaNO2.
Основное уравнение для определения восстановителей:
NO2 — + 1e + 2H + = NO + H2O, 
Основное уравнение для определения окислителей:
NO2 — – 2e + H2O = NO3 — + 2H + , 
Основное уравнение взаимодействия с первичными аминами:
R-NH2 + NaNO2 + 2HCl ® [R-N + ≡N]Cl — + 2H2O + NaCl
Индикация точки эквивалентности
при окислительно-восстановительном титровании
При титровании, основанном на реакциях окисления или восстановления определяемого вещества, изменяется окислительно-восстановительный потенциал системы, наиболее резкое изменение наблюдается вблизи точки эквивалентности.
Окислительно-восстановительными индикаторами являются вещества, которые изменяют окраску при определенном окислительно-восстановительном потенциале, которого система достигает в процессе титрования, подобно тому, как при кислотно-основном титровании пользуются индикаторами, изменяющими окраску при определенном значении рН раствора.
В окислительно-восстановительных методах применяют несколько различных способов индикации точки эквивалентности.
1. Безындикаторное титрование. При этом в конце титрования наблюдается исчезновение или появление окраски, характерное для данного рабочего раствора или для данного определяемого вещества.
К этой группе можно отнести перманганатометрическое титрование,
в котором в качестве титранта используется раствор перманганата калия, являющийся одновременно рабочим раствором и индикатором. После достижения точки эквивалентности избыточная капля титранта придает титруемому раствору отчетливо видимую розовую окраску.
2. Использование специфических реактивов в качестве индикаторов.
В йодметрии (при титровании йодом или тиосульфатом натрия)
в качестве индикатора применяется свежеприготовленный 0,5-ный % раствор крахмала, который с йодом образует адсорбционное соединение интенсивно–синего цвета.
3. Индикаторы, изменяющие окраску в зависимости от окислительно-восстановительного потенциала системы (прил. 7).
Основным достоинством этой группы индикаторов является возможность применения их для различных окислительно-восстановительных методов. Практическое значение имеет лишь небольшое их число. Основные трудности использования связаны с влиянием рН раствора и недостаточной скоростью изменения окраски.
Индикаторы данной группы характеризуются равновесием окисленной формы (IndOx) и восстановленной формы (IndRed), которые имеют различную окраску.
Выражение для окислительно-восстановительного потенциала имеет вид
4. Электрохимическая индикация точки эквивалентности. Физико-химические методы анализа: потенциометрическая индикация точки эквивалентности, амперометрическая индикация точки эквивалентности.
Перманганатометрия
Титрантом является раствор перманганата калия KMnO4, являющийся сильным окислителем. Основное уравнение:
MnO4 — +8H + + 5e = Mn 2+ + 4H2O, 
М1/z(KMnO4)= 
В слабокислых, нейтральных и слабощелочных средах вследствие меньшего окислительно-восстановительного потенциала перманганат-ион восстанавливается до Mn +4 .
MnO4 — +2H2O + 3e = MnО2¯ + 4OH — , 
М1/z (KMnO4)= 
В щелочной среде раствор перманганата калия восстанавливается
до Mn +6 .
MnO4 — + 1e = MnO4 2- , 
М1/z (KMnO4)= 
Для исключения побочных реакций титрование перманганатом калия проводят в кислой среде, которую создают серной кислотой. Соляную кислоту для создания среды применять не рекомендуется, так как перманганат калия способен окислять хлорид-ион.
2Cl — – 2e = Cl2 , 
Наиболее часто перманганат калия применяют в виде раствора
с молярной концентрацией эквивалента
0,05 – 0,1 моль/дм 3 . Он не является первичным стандартом в силу того, что водные растворы перманганата калия способны окислять воду и органические примеси в ней:
Разложение растворов перманганата калия ускоряется в присутствии диоксида марганца. Поскольку диоксид марганца является продуктом разложения перманганата, этот осадок оказывает автокаталитический эффект на процесс разложения.
Твердый перманганат калия, применяемый для приготовления растворов, загрязнен диоксидом марганца, поэтому приготовить раствор из точной навески нельзя. Для того чтобы получить достаточно устойчивый раствор перманганата калия, его после растворения навески KMnO4 в воде оставляют в темной бутыли на несколько дней (или кипятят), а затем отделяют MnO2¯ фильтрованием через стеклянный фильтр (применять бумажный фильтр нельзя, так как он реагирует с перманганатом калия, образуя диоксид марганца).
Окраска раствора перманганата калия настолько интенсивна,
что индикатор в этом методе не требуется. Для того чтобы придать заметную розовую окраску 100 см 3 воды, достаточно 0,02 – 0,05 см 3 раствора KMnO4
с молярной концентрацией эквивалента 0,1 моль/дм 3 (0,02 М). Окраска перманганата калия в конечной точке титрования неустойчивая и постепенно обесцвечивается в результате взаимодействия избытка перманганата
с ионами марганца (II), присутствующими в конечной точке в относительно большом количестве:
Стандартизацию рабочего раствораKMnO4 проводят по оксалату натрия или щавелевой кислоте (свежеперекристаллизованной и высушенной при 105°С).
Используют растворы первичных стандартов с молярной концентрацией эквивалента С (½ Na2C2O4) = 0,1000 или 0,05000 моль/л.
C2O4 2- – 2e ® 2CO2 , 

При титровании происходит следующая реакция:
При комнатной температуре эта реакция протекает медленно и является автокаталитической (Mn 2+ является катализатором реакции взаимодействия перманганата калия с оксалатом натрия), поэтому для ускорения реакции раствор разбавляют горячей водой и ведут титрование при температуре
60–70°С. Первая порция титранта обесцвечивается медленно. После
её обесцвечивания и накопления Mn 2+ реакция протекает с достаточно высокой скоростью.
Молярную концентрацию эквивалента KMnO4 вычисляют по формуле

В методе перманганатометрии восстановители (щавелевую, муравьиную, сероводородную и некоторые другие кислоты, перекись водорода, соли железа (II), бромид–ион) определяют способом прямого титрования, а окислители – способом обратного титрования (определение K2Cr2O7 в техническом образце).
Перманганатометрия применяется для стандартизации нитрита натрия при определении сульфаниламидных препаратов (см. лаб. работу № 7).
Хроматометрия
Хроматометрией называют метод объемного анализа, основанный на использовании в качестве титранта раствора дихромата калия K2Cr2O7 или (реже) хромата калия K2CrO4.
Обычно титрование проводят в кислой среде (сернокислой, солянокислой или фосфорнокислой средах). Дихромат калия в кислой среде является довольно сильным окислителем.
Cr2О7 2- + 6 e + 14H + ® 2Cr 3+ + 7H2O, 

Соединения Cr (VI) обладают большей окислительной способностью, чем элементарный йод 

Продажный химически чистый дихромат калия можно применять для приготовления первичных стандартов, после перекристаллизации
и высушивания при 105–110°С. Наиболее часто дихромат калия применяют в виде раствора с молярной концентрацией эквивалента 0,1000 моль/дм 3 , приготовленного из точной навески при растворении в точном объеме воды.
Хотя растворы дихромата калия окрашены в оранжевый цвет, интенсивность окраски недостаточна для определения конечной точки титрования. В дихроматометрическом титровании применяют
ОВ – индикаторы: дифениламин (с переходом окраски от бесцветной до темно-фиолетовой), дифениламиносульфокислоту (с переходом окраски от зеленой до фиолетовой), фенилантраниловую кислоту (с переходом окраски от бесцветной до красно-фиолетовой). Конечную точку титрования (точку эквивалентности) можно зафиксировать инструментальными методами (потенциометрическое титрование, кондуктометрическое титрование и др.).
Дихромат калия способен окислять многие неорганические и органические вещества: Fe (II), W (III), Mo (V), Ti (III) спирты, гидрохинон, глицерин, аскорбиновую кислоту, тиомочевину и др.
Дихромат калия является первичным стандартом для многих окислительно-восстановительных методов:
· для йодометрии (см. лабораторную работу № 5);
· при титровании солью Мора.
Йодметрия
Йод имеет несколько степеней окисления и в растворе может существовать в виде нескольких частиц: I — , I2, IO3 2- .
Йод кристаллический плохо растворим в воде и хорошо растворим
в спирте. Для увеличения его растворимости в воде растворение ведут в йодиде калия, где он образует комплексное соединение – трийодид-ион I — ×I2 = I3 — , проявляющее окислительные свойства [[9]]:
I3 — + 2e « 3I — .
Эту реакцию чаще всего пишут в упрошенном виде, а именно:
I2 +2e « 2I — ; 
Раствор йода обычно готовят приблизительной концентрации
(0,05–0,1 моль/дм 3 ), а затем перед использованием его концентрацию устанавливают по подходящему стандартному раствору (тиосульфат натрия, оксид мышьяка (III)). Растворы йода неустойчивы, так как йод – это летучее вещество, а также действует на резиновые и корковые пробки. Йодид–ионы легко окисляются кислородом воздуха:
Эта реакция ускоряется на свету, при нагревании и в присутствии кислот, поэтому раствор йода хранят «на холоду» и в темных бутылях с притертой стеклянной пробкой.
Определение восстановителей (SO3 2- , S2O3 2- , S 2- , SCN — , AsO3 3- , Cr 2+ , HCHO, N2H2) проводят методом прямого титрования раствором I2 (йодиметрия).
Для случаев, когда вещество реагирует с раствором йода медленно, используют метод обратного титрования (по остатку): вводят фиксированный избыток йода в раствор, оставляют его на 5–7 минут (закрытый часовым стеклом), а затем остаток йода оттитровывают раствором тиосульфата натрия.
Для определения окислителей (Cu 2+ , Fe 3+ , Mn 3+ , Mn (IV), Pb (IV), As (V)) применяют титрование по замещению (йодометрия): к анализируемому раствору приливают раствор KI и выделившийся I2 титруют раствором тиосульфата натрия. Количество образовавшегося йода химически эквивалентно количеству окислителя:
2Cu 2+ + 4I — = 2CuI¯ + I2
Раствор тиосульфата натрия в иодометрическом методе является титрантом. Он проявляет свойства восстановителя:
2S2O3 2- — 2e « S4O6 2- , 
Тиосульфат натрия не является первичным стандартом в силу того,
что его растворы неустойчивы при хранении, мутнеют за счет поглощения CO2 из воздуха (выделяется элементарная сера):
В присутствии сильных кислот, на свету и при уменьшении концентрации тиосульфата натрия разложение ускоряется:
В присутствии серобактерий тиосульфат натрия разлагается на сульфит, сульфат и элементарную серу, поэтому его раствор с молярной концентрацией эквивалента
0,1 хранят в темных, закрытых бутылях.
Стандартизуют раствор тиосульфата натрия с использованием первичных стандартов (KIO3, КВrO3, K2Cr2O7), выделяющих при взаимодействии с избытком йодид-ионов известное количество йода, которое титруют раствором Na2S2O3.
Концентрацию тиосульфата рассчитываем по закону эквивалентов:

Существует несколько способов определения конечной точки при титровании йодом. При титровании бесцветных растворов достаточно интенсивной является собственная окраска трийодид-иона: 1 капля раствора йода молярной концентрации эквивалента 0,1 моль/дм 3 окрашивает 100 см 3 раствора в желтый цвет.
Наиболее широко используемым индикатором в йодметрии является свежеприготовленный 0,1– ный % раствор крахмала, придающий раствору, содержащему следы йода, интенсивную синюю окраску. Раствор крахмала при прямом титровании йодом добавляют в начале, а в остальных методах – в конце титрования, т.е. когда йода в растворе осталось малое количество (раствор из бурого стал бледно-желтым), так как крахмал, добавленный в раствор
с высокой концентрацией йода, разрушатся с образованием продуктов, являющихся не полностью обратимыми индикаторами. Титрование продолжают до исчезновения синей окраски крахмала.
Источники ошибок в йодометрических методах
1. Окисление йодид-иона кислородом воздуха:
скорость этой реакции очень мала, поэтому при титровании удалять растворенный кислород из всех растворов не обязательно. Для удаления растворенного кислорода из растворов к ним добавляют бикарбонат натрия или продувают углекислый газ.
2. Летучесть выделившегося йода. Для того чтобы избежать ошибок
за счет летучести йода, растворы хранят в закрытых сосудах и избегают
их нагревания, а при косвенном титровании после добавления KI колбы
с раствором закрывают часовым стеклом и оставляют в темноте на 5–7 минут,
а затем быстро титруют.
3. Разложение растворов тиосульфата натрия.
4. Щелочные растворы. В щелочных растворах происходит образование гипоиодита:
В связи с этим титрование тиосульфатом натрия необходимо вести при
рН=7–10, а если необходимо титрование в кислой среде, то титрование ведут очень медленно при тщательном перемешивании.
5. Преждевременное добавление крахмала. Правильный способ применения крахмала в качестве индикатора описан выше.
Йодатометрия
Йодат калия является источником йода, который получается при взаимодействии йодат-иона с йодидом калия:
Равновесие реакции смещено сильно вправо в кислых растворах и сильно влево в щелочной среде.
Йодат калия отвечает требованиям, предъявляемым к первичным стандартам, поэтому его растворы готовят из точной навески растворением
в точном объёме воды. Растворы йодата калия устойчивы продолжительное время. Йодатометрическим методом анализируют неорганические сильные кислоты:
лабораторная работа 5
Определение содержания меди (II) в растворе
методом йодометрического титрования
Цель работы:
1) закрепление теоретических знаний о методе йодометрического титрования;
2) освоение метода йодометрического титрования;
3) практическое применение титрования по замещению для определения массы меди (II) в растворе;
4) проведение математической обработки результатов определения содержания меди (II) в растворе, полученных двумя методами (комплексонометрия и йодометрия).
Реактивы
1. Раствор тиосульфата натрия Na2S2O3 с молярной концентрацией эквивалента
2. Н2О дистиллированная.
3. Раствор серной кислоты H2SO4 с молярной концентрацией 2 моль/дм 3 .
4. Раствор йодида калия KI с массовой долей 10 %.
5. Раствор дихромата калия K2Cr2O7 с молярной концентрацией эквивалента 0,1000 моль/дм 3 – первичный стандарт.
6. Раствор крахмала свежеприготовленный с массовой долей 0,1 %.
7. Смесь Брунса (раствор йодида калия KI с массовой долей 3 % и раствор тиоцианата калия KSCN с массовой долей 10 %).
Что делает отдел по эксплуатации и сопровождению ИС? Отвечает за сохранность данных (расписания копирования, копирование и пр.).
ЧТО ТАКОЕ УВЕРЕННОЕ ПОВЕДЕНИЕ В МЕЖЛИЧНОСТНЫХ ОТНОШЕНИЯХ? Исторически существует три основных модели различий, существующих между.
ЧТО ПРОИСХОДИТ ВО ВЗРОСЛОЙ ЖИЗНИ? Если вы все еще «неправильно» связаны с матерью, вы избегаете отделения и независимого взрослого существования.
Что вызывает тренды на фондовых и товарных рынках Объяснение теории грузового поезда Первые 17 лет моих рыночных исследований сводились к попыткам вычислить, когда этот.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
http://pandia.ru/text/81/230/5575.php
http://zdamsam.ru/a45856.html










