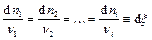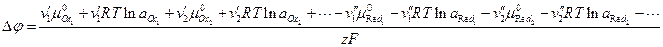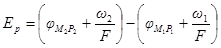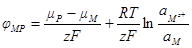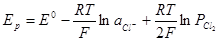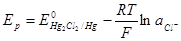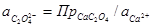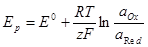Глава 3. Равновесные электродные процессы. Электродные потенциалы и ЭДС гальванических элементов. Потенциометрия
3.1.Электрохимический потенциал и равновесие на границе электрод/раствор. Условный электродный потенциал. Уравнение Нернста
В химической термодинамике для характеристики свойств систем, не содержащих заряженные частицы, и в которых изменение состава происходит в результате протекания химических реакций или фазовых превращений используют фундаментальное уравнение Гиббса, выраженное через характеристическую функцию 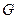
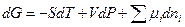
где 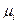
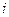
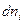
При рассмотрении явлений в гетерогенных системах, необходимо учитывать к какой фазе относятся величины 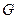
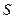
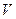
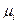
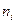
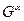
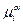
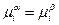
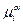
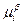
Если компонент 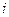
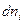
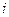
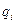
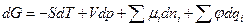
где — 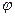
Внутренним потенциалом 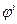
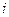
Термин «воображаемый» предполагает, что этот единичный заряд реагирует только на внешнее электрическое поле и не взаимодействует со средой.
Так как 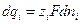
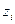
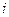
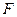
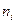
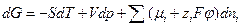
Все производные энергии Гиббса по обобщенным координатам имеют смысл обобщенных сил. Поэтому 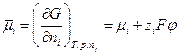
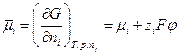
При перемещении одного моля реальных заряженных частиц 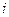
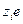
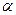
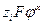
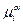
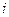
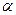
Фундаментальное уравнение Гиббса тогда запишется:
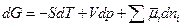
Рассмотрим равновесие на границе раздела фаз. Предположим, что на границе раздела фаз протекает электрохимическая реакция (электродная реакция)
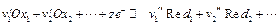
где 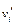
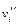
При протекании химической реакции количества отдельных реагентов изменяются пропорционально их стехиометрическим коэффициентам в уравнении реакции. Взаимную пропорциональность величин dni можно выразить совокупностью уравнений:
Таким образом, перераспределение количеств всех веществ в системе можно выразить с помощью единственной переменной, которая обозначается x и называется химической переменной. Дифференциал химической переменной определяется с помощью любого из приведенных выше уравнений:
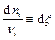
Тогда с учетом этого выражения для dG получим
dG = – SdT + Vdp + 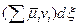
При постоянной температуре и постоянном давлении условием равновесия в системе является минимум энергии Гиббса. Это означает, что для равновесной системы
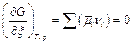
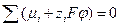
В этом уравнении суммируются электрохимические потенциалы и стехиометрические коэффициенты всех участников электрохимической реакции, независимо от того, в какой фазе они находятся.
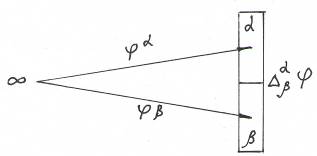
Равновесие на электроде характеризуется равенством электрохимических потенциалов компонентов во всех фазах. В случае их неравенства происходит переход заряженных частиц через границу раздела фаз, что вызывается стремлением системы к термодинамическому равновесию. В результате этого нарушается баланс электрических зарядов в каждой фазе, металл и раствор приобретают электрический заряд и на границе их раздела возникает скачок потенциала. Другими словами между фазами электрода возникает определенная разность потенциалов, обусловленная природой составляющих электрод компонентов, их концентрациями и значениями внешних термодинамических параметров.
Этот скачек потенциала называется гальвани-потенциалом (потенциалом электрода) и обозначается 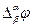
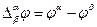
Рис. Возникновение скачка потенциала (гальвани-потенциала 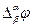
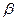
Рассмотрим механизм возникновения скачка потенциала на примере наиболее часто встречающихся электродов с границей раздела фаз металл – раствор. Существуют такие металлы, что если их опустить в воду или в раствор, то ионы металла переходят в прилегающий к поверхности металла слой воды или раствора по реакции 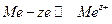
Этот переход происходит в том случае, если электрохимический потенциал иона металла в кристалле больше чем электрохимический потенциал сольватированного иона в растворе. Металл можно представить состоящим из положительно заряженных ионов металла и относительно свободных электронов. По мере перехода ионов в раствор, состояние системы постепенно изменяется. Металл приобретает отрицательный заряд, величина которого увеличивается по мере протекания электрохимической реакции. В связи с этим электрохимический потенциал ионов металла на поверхности уменьшается. Количество ионов в растворе возрастает, и их электрохимический потенциал увеличивается вследствие отталкивания одноименных ионов. В результате этого скорость перехода ионов в раствор уменьшается, а скорость обратного процесса – перехода ионов из раствора на металл возрастает. Наконец наступает такое состояние, при котором скорости обоих процессов становятся одинаковыми, то есть в системе наступает равновесие. При этом металл приобретает отрицательный заряд, которому соответствует определенный потенциал, а в растворе образуется избыток катионов, которые удерживаются у поверхности металлического электрода в результате действия электростатических сил и этому слою соответствует свой потенциал. Эти потенциалы называются внутренними потенциалами и обозначаются 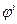
( например, 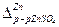
Для определения величины гальвани-потенциала, возникающего на границе раздела фаз 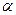
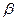
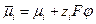
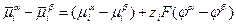
Из уравнения следует, что измерение гальвани-потенциала между точками в разных фазах возможно лишь при условии равенства химических потенциалов веществ в разных фазах, то есть при 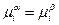
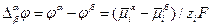
Отсюда следует, что на границе раздела двух фаз различного состава экспериментально определить гальвани-потенциал невозможно.
Величина гальвани-потенциала зависит от свойств фаз, образующих границу раздела и от концентрации ионов в растворе.
В общем случае, для электрохимической реакции
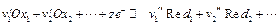
протекающей на границе раздела фаз, условие равновесия, в соответствие с (3.6) запишется:
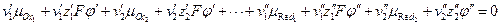
где 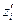
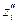
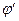
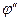
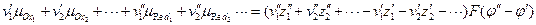
В соответствии с балансом зарядов 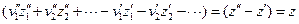
где 
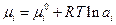
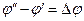
Так как стандартный химический потенциал компонента равен значению его стандартной энергии Гиббса, получим
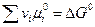
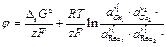
Объединив все постоянные величины в одну величину — j°, которая называется стандартным электродным потенциалом, получим выражение для разности потенциалов между фазами, составляющими электрод:
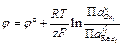
где j° — стандартный электродный потенциал; R – универсальная газовая постоянная;
T –температура, К; F – постоянная Фарадея; 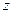
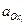
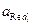
Полученное уравнение называется уравнением Нернста. Стандартный электродный потенциал j° — это величина, характерная для каждого электродного процесса, которая также зависит от температуры и природы растворителя. Стандартный электродный потенциал равен потенциалу электрода в котором отношение активностей всех участников электродной реакции равны единице. Уравнение Нернста связывает величину разности потенциалов между фазой раствора электролита и фазой проводника первого рода с активностями компонентов, участвующих в электродной реакции.
В качестве примера установления электрохимического равновесия рассмотрим наиболее простой случай – равновесие на границе металла с раствором, содержащим ионы этого металла. На электроде будет протекать следующая электрохимическая реакция:
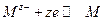
Равновесие устанавливается в результате перехода ионов металла из объема раствора на металл и обратно при условии выполнения равенства (3.6) .
Тогда условие равновесия для данной системы запишется:
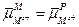
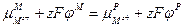
Из уравнения следует, что равновесный гальвани-потенциал на границе металл–раствор равен:
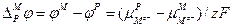
Для нейтральных атомов металла электрохимический потенциал равен химическому потенциалу — 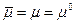
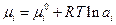
где 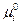
С учетом вышесказанного уравнение (3.11) будет иметь следующий вид:
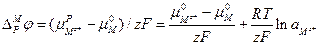
Объединив все постоянные величины в одну величину — j°, которая называется стандартным электродным потенциалом, получим выражение для разности потенциалов между фазами, составляющими электрод:
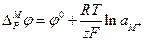
Комбинация констант R, F и температуры (RT / F) часто встречается в электрохимических уравнениях; она имеет размерность напряжения. Общепринято обозначать ее как b0. Часто уравнение Нернста записывается через десятичные логарифмы. Переход к десятичным логарифмам осуществляется путем умножения b0 на ln10 = 2,3 (это произведение обозначается как b). При 298 К значения b0 и b соответственно равны:
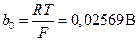
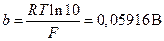
Значения постоянной b при других температурах могут быть легко рассчитаны.
Следует отметить, что в общем случае при записи уравнения Нернста под логарифмом остаются только те величины, которые могут варьироваться. Таким образом, при записи уравнения Нернста для разных случаев необходимо соблюдать несколько правил, связанных с применением выражения (3.9) для различных типов электродов:
1. Активности чистых компонентов, образующих отдельную фазу постоянного состава, (как правило, это твердые вещества) принимаются равными единице.
2. Активность растворителя принимается равной единице.
3. Вместо активностей газообразных веществ в уравнение входят относительные парциальные давления этих газов над раствором 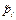
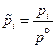
Использование парциальных давлений справедливо для случая не очень высоких давлений (порядка нескольких бар). В случае высоких давлений необходимо использовать фугитивности газов.
Дата добавления: 2016-01-09 ; просмотров: 2330 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Окислительно — восстановительный потенциал
Электродные потенциалы. ЭДС реакции
Окислительно — восстановительный потенциал является частным, узким случаем понятия электродного потенциала. Рассмотрим подробнее эти понятия.
В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту.
Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию, если, например, окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества.
Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Элемент Даниэля-Якоби
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Значение и знак (+ или -) электродного потенциала определяются природой раствора и находящегося в нем металла.
При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn 2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e — = Zn 2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu 2+ + 2e — = Cu
Таким образом, в элементе Даниэля-Якоби происходит такая реакция:
Zn + Cu 2+ = Zn 2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
2Fe 3+ + 2I — = 2Fe 2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник.
В сосуды, содержащие растворы Fe 3+ и I — , поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток.
Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe 3+ :
2I — — 2e — = I2
2Fe 3+ + 2e — = 2Fe 2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом.
Факторы, влияющие на значение окислительно-восстановительного потенциала
Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
1) Природа вещества (окислителя и восстановителя)
2) Концентрация окисленной и восстановленной форм.
При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
При Cок > Cвос, E > E° и наоборот, если Cок 2- , CrO4 2- , MnO4 — ) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H + . И наоборот, окислительно-восстановительный потенциал падает с уменьшением H + .
4) Температура
При увеличении температуры окислительно-восстановительный потенциал данной пары также растет.
Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С.
Такие таблицы дают возможность сделать некоторые выводы:
Что можно определить по значению окислительно-восстановительного потенциала
- Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например
E°(F2/2F — ) = +2,87 В – сильнейший окислитель
E°(K + /K) = — 2,924 В – сильнейший восстановитель
Окислительно-восстановительная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
- Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами.
- Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
практически протекает в прямом направлении, т.к.
E° (Sn 4+ /Sn 2+ ) = +0,15 В,
E° (Fe 3+ /Fe 2+ ) = +0,77 В,
т.е. E° (Sn 4+ /Sn 2+ ) 3+ /Fe 2+ ).
Cu + Fe 2+ = Cu 2+ + Fe
невозможна в прямом направлении и протекает только справа налево, т.к.
В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
- Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая.
- Пользуясь справочными данными, можно определить ЭДС реакции.
Как определить электродвижущую силу (ЭДС) реакции?
Рассмотрим несколько примеров реакций и определим их ЭДС:
- Mg + Fe 2+ = Mg 2+ + Fe
- Mg + 2H + = Mg 2+ + H2
- Mg + Cu 2+ = Mg 2+ + Cu
E° (Mg 2+ /Mg) = — 2,36 В
E° (Fe 2+ /Fe) = — 0,44 В
Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя
ЭДС = Е 0 ок — Е 0 восст
- ЭДС = — 0,44 — (- 2,36) = 1,92 В
- ЭДС = 0,00 — (- 2,36) = 2,36 В
- ЭДС = + 0,34 — (- 2,36) = 2,70 В
Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0.
Связь константы равновесия и окислительно — восстановительного потенциала
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu 2+ = Zn 2+ + Cu
Применяя закон действующих масс, можно записать
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn 2+ и Cu/Cu 2+ , находим
В состоянии равновесия E 0 Zn/Zn2+ = E 0 Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2+ = +0,34 + (0,59/2)lgCCu2+, откуда получаем
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 10 37,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E1 0 -E2 0 )n/0,059, где
K — константа равновесия
E1 0 и E2 0 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E1 0 > E2 0 , то lgK > 0 и K > 1.
Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E1 0 — E2 0 ) достаточно велика, то она идет практически до конца.
Напротив, если E1 0 0 , то K будет очень мала.
Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E1 0 — E2 0 ) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
Как составить схему гальванического элемента?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции:
- ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
- Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода.
Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод).
- Граница раздела фаз обозначается одной чертой — |
- Электролитный мостик на границе двух проводников обозначается двумя чертами — ||
- Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую.
Например, составим схему гальванического элемента, в котором осуществляется следующая реакция:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0
В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый.
Анод Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Катод
Типичные задачи на составление схем гальванического элемента и вычисление ЭДС реакции с решениями вы найдете здесь.
УРАВНЕНИЯ РАВНОВЕСНОГО ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА
Наличие электрохимического равновесия между металлом и электролитом дает возможность двоякого подхода к выводу уравнений для равновесного электродного потенциала. С одной стороны, применим термодинамический метод, с другой — кинетический, поскольку электрохимическое равновесие, как и всякое химическое равновесие, является динамическим *. Естественно, что при правильных предпосылках оба метода должны привести к одинаковым конечным результатам. Любой вывод уравнений равновесного потенциала исходит из предпосылки о том, что на электроде протекает только одна электрохимическая реакция в прямом и обратном направлениях. Другие электрохимические реакции или отсутствуют вообще, или протекают со столь малыми скоростями, что ими можно пренебречь. Оба подхода приводят в конечном итоге к развернутым выражениям для Гальвани-потенциала, который, как неоднократно отмечалось, не может быть ни измерен, ни рассчитан. Поэтому в электрохимии реально имеют дело не с Гальвани-потенциалами, а с так называемыми потенциалами в относительной шкале. Раскроем смысл, вкладываемый в это понятие, с помощью формулы, приведенной ранее:
(здесь принято, что 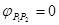
Таким образом, напряжение электрохимической системы сводится к разности двух сумм, каждая из которых относится к одному из электродов. Если бы можно было создать электрод, для которого выражение в скобках было бы равно нулю, то проблема измерения абсолютных потенциалов была бы решена, ибо, измерив напряжение системы, состоящей из исследуемого электрода и электрода с нулевым потенциалом, мы получили бы абсолютное значение потенциала исследуемого электрода. Однако создать электрод с нулевым потенциалом нельзя. Но если условно принять потенциал какого-нибудь из двух электродов (например, первого) равным нулю, то
и напряжение электрохимической системы будет равно потенциалу второго электрода относительно произвольно выбранного первого электрода с условно нулевым потенциалом. Такое значение потенциала второго электрода называется потенциалом электрода в относительной шкале потенциалов. Поскольку в дальнейшем
* Кинетический вывод уравнения равновесного потенциала будет дан в разд. 8.2.
потенциал электрода в относительной шкале всегда относится ко второму электроду, индекс 2 всюду будет опущен.
Электроды первого рода. Рассмотрим сначала случай электрохимического равновесия между металлом и его ионами в растворе. Поскольку на такого типа, электродах протекает электрохимическая реакция
Обозначив (μ 0 Р – μ 0 М)/zF через φ 0 имеем:
и в относительной шкале
Выразив все постоянные величины через Е° и помня, что aM= 1, получим:
Это уравнение по внешнему виду аналогично уравнению для Гальвани-потенциала, но константа Е° имеет другой физический смысл, чем φ°, и не может быть теоретически рассчитана.
Таким образом, получено выражение для равновесного потенциала электрода в относительной шкале как функция активности простых ионов металла, носящее название уравнения Нернста для электродов первого рода. К числу электродов первого рода относятся все электроды типа М z + /M, например: Bi 3+ /Bi, Cu 2+ /Cu, Sn 2+ /Sn, Zn 2+ /Zn, T1 + /T1 и др.
Ниже приведены значения предлогарифмического коэффициента при z = 1 для разных температур:
t, ºC 
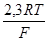
– 20 0,0502 100 0,0739
– 10 0,0522 150 0,0839
0 0,0541 200 0,0939
10 0,0561 250 0,1037
20 0,0581 300 0,1136
25 0,0591 400 0,1335
30 0,0601 600 0,1731
50 0,0641 800 0,2128
70 0,0680 1000 0,2524
Если активность металла не равна единице, например в случае амальгамного электрода, то уравнение равновесного потенциала примет вид:
Уравнение для амальгамных электродов впервые выведено В. А. Тюриным и называется уравнением Нернста — Тюрина.
Очень часто в электролите ионы металла находятся в виде комплексных ионов разного состава и заряда. В связи с этим концентрация каждого сорта ионов меньше, чем аналитическая концентрация ионов металла, и все формы находятся в равновесии друг с другом. Поэтому, если, например, ионы металла в растворе находятся не только в виде М z + , но и в виде М z + L, М z + L2, М z + L3, M z + L4 и т. д. (здесь L — лиганд, который может быть как нейтральной, так и заряженной частицей), то уравнение Нернста можно записать относительно любого сорта ионов



и т. д. В этих уравнениях активности соответствующих ионов могут быть определены с помощью методов, изложенных в разд. 4.2.
Для газовых водородного и хлорного электродов, электрохимические реакции которых можно представить уравнениями
уравнение Нернста имеет вид:
В большинстве случаев с достаточным приближением можно принять, что активность газовой фазы над раствором равна давлению газа. Тогда
Эти уравнения отличаются друг от друга знаками перед вторым и третьим членами правой части. С увеличением активности ионов гидроксония потенциал водородного электрода смещается в сторону более электроположительных значений, что характерно для всех электродов первого рода, обратимых относительно катиона. С увеличением же активности ионов хлора потенциал хлорного электрода смещается в более электроотрицательную сторону, что свойственно всем электродам первого рода, обратимым относительно анионов. С увеличением давления потенциал электродов, обратимых относительно катиона, будет сдвигаться в электроотрицательную сторону, а электродов, обратимых относительно аниона, — в электроположительную.
Электрохимическая реакция водородного электрода, записанная выше, справедлива лишь для кислых растворов. В щелочной среде
где Е°’ — стандартный потенциал при 
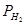
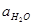

т. е. получаем формулу, идентичную формуле, выведенной для кислой среды. Разница между стандартными потенциалами водородного электрода в кислой и щелочной среде, равная при комнатной температуре 0,059 lg 10 –14 , составляет примерно 0,82 В. Эффект влияния активности воды начинает сказываться только в высококонцентрированных растворах кислоты и щелочи, когда отличие 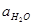
Рассмотрим теперь уравнения равновесного потенциала кислородного электрода. Вообще говоря, если насыщенную кислородом платину опустить в водный раствор кислоты или щелочи, то на ней должен установиться потенциал, определяемый электрохимически- ми равновесиями:
О2 + 2Н2О + 4е = 4ОН – (в щелочной среде)
Выражения для равновесного потенциала в этих случаях имеют вид:
Заменив, как и раньше, во втором из этих уравнений 
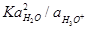
В водной среде обратимый кислородный потенциал трудно реализуется из-за малого тока обмена и образования нестабильного промежуточного продукта реакции — пероксида водорода, который разлагается химически с выделением кислорода.
Более сложным примером электродов первого рода является случай, когда электронным проводником служит не металл, а сплав. Представим для простоты бинарный сплав металлов M1 и М2 (причем металл m1 обладает более электроотрицательным по- тенциалом, чем металл М2) в контакте с электролитом, содержащим ионы первого металла 
Где 
Если сплав представляет собой твердый раствор или химическое соединение, то 
т. е. равновесный потенциал электрода оказывается функционально связанным и с активностью анионов труднорастворимого соединения. Аналогичное выражение получается, если потенциалопределяющую реакцию записать в виде:
AgCl + e = Ag + Cl –
Большое значение имеют электроды второго рода в качестве электродов сравнения. Важнейшими из них, кроме хлорсеребряного, являются: хлорталлиевый, каломельный, ртутносульфатный и оксиднортутный электроды. Электрохимические реакции этих электродов выражаются соответственно уравнениями
Т1С1тв + е = Т1 + Сl –
а равновесные потенциалы формулами:
Электроды третьего рода состоят из металла, погруженного в насыщенный раствор своей труднорастворимой соли, и малорас-творимой соли с тем же анионом, что и труднорастворимая соль. Раствор должен содержать также хорошо растворимую соль, имеющую общий катион с малорастворимой солью. Примером электродов такого рода является свинцовый электрод, погруженный в раствор солей хлорида кальция, оксалата кальция (малорастворимая соль) и оксалата свинца (труднорастворимая соль, растворимость которой много меньше, чем растворимость СаС2О4)*. Потенциал такого электрода можно выразить уравнением Нернста:
в котором активность ионов Рb 2+ должна быть заменена активностями других ионов с помощью выражений, следующих из произведений растворимости:

После подстановок и объединения постоянных величин, получаем
где 
Потенциал такого электрода обратимо реагирует на изменение активности чужеродных катионов.
Окислительно-восстановительные электроды состоят из индифферентного металла, погруженного в электролит, содержащий ионы какого-нибудь сорта в двух степенях окисленности Ох и Red, между которыми существует равновесие
Для этого случая
* Раствор должен быть насыщен двумя последними солями.
Уравнение равновесного потенциала окислительно-восстанови-тельного электрода выведено Петерсом и называется уравнением Нернста — Петерса.
Если, например, в подкисленном хлоридном растворе имеются ионы Fe 3+ и Fe 2+ , to >окйслитёльно-восстановительный потенциал будет определяться уравнением:
Потенциал электрода, как следует из уравнения, не зависит от кислотности раствора. Однако при уменьшении кислотности начнет существенно сказываться гидролиз соли трехвалентного железа, гидролизующегося значительно сильнее, чем соль двухвалентного железа. После достижения рН гидратообразования в разбавленных растворах активность ионов Fe 3+ будет уже определяться произведением растворимости Fе(ОН)3:
Подставив значение 
Т. е. сильную зависимость потенциала от рН.
Дальнейшее увеличение рН приведет к гидролизу и соли двухвалентного железа. Когда будет достигнуто значение рН гидрато-образования Fе(ОН)2, активность ионов двухвалентного железа также будет определяться произведением растворимости Fе(ОН)2:
Подставив и это выражение в уравнение равновесного потенциала, получим
т. е. более слабую зависимость потенциала от рН в области высоких рН и отсутствие зависимости от активности ионов Fе 3+ и Fe 2+ .
Зависимость окислительно-восстановительного потенциала от рН может и не быть связана с гидролизом солей. Так, при погружении платинового электрода в кислый раствор, содержащий мышьяковую и мышьяковистую кислоты, устанавливается равновесие, определяемое реакцией
и выражение для потенциала примет вид:
В это выражение входит и активность нейтральных молекул растворителя. При погружении платинового электрода в кислый раствор, содержащий MnSO4 и КМnО4, электродная реакция определяется равенством
и уравнение для потенциала будет иметь вид:
Если раствор концентрированный, то наряду с активностями ионов окисленной и восстановленной форм и ионов водорода следует учитывать и активность воды. Изменение активности, воды здесь сказывается на потенциале несколько сильнее, чем в предыдущем примере.
В приведенных уравнениях активности и фугативностн (давления) участников электрохимических реакций стоят под знаком логарифма, что приводит к Е → ±∞ при стремлении этих величин к нулю. Между тем реально бесконечно малые или большие потенциалы никогда не реализуются. Это связано с тем, что все формулы для равновесного потенциала выведены для условий равновесия электрохимической реакции. Если же активность ионов или фугативность газов, участвующих в реакции, равна нулю, то равновесия с другими компонентами не может быть. Вследствие этого экстраполяция активности и фугативности на нуль физически неоправданна.
При выводе уравнений равновесного потенциала не введены какие-либо ограничения относительно природы фазы с электронной проводимостью. Поэтому все полученные уравнения должны быть справедливы как для границы металл — электролит, так и для границы полупроводник (электронный) — электролит.
Наконец, при выводе уравнений отсутствовали ограничения, касающиеся природы проводников второго рода. Вследствие этого уравнения в равной степени применимы для водных и неводных растворов, расплавов и твердых электролитов.
http://zadachi-po-khimii.ru/obshaya-himiya/okislitelno-vosstanovitelnyj-potencial.html
http://lektsii.org/8-40276.html