Изменение концентрации вещества при смешивании двух газов/растворов
Предположим, имеется некая газовая смесь, состоящая из 2 или более газов, или, например, раствор вещества в воде или иной жидкости. Эту газовую смесь или жидкий раствор разбавляют другим газом или жидкостью — может быть, содержащей интересующую нас составляющую, а может быть, и не содержащий. При такой ситуации, часто возникает вопрос: как посчитать итоговую концентрацию вещества в получившейся смеси? Или же, наоборот, итоговая (требующаяся) концентрация известна, но нужно узнать, сколько газа/раствора нужно добавить к исходной смеси, чтобы получить нужную концентрацию.
На самом деле, эти вопросы обычно задаются в задачах, фигурирующих в школьных учебниках математики (точнее, того ее раздела, который именуют арифметикой) примерно, кажется, за 5-6 класс. Однако, подобные вещи без практики легко забываются, а самостоятельно, путем логических выкладок, когда мозг занят совсем другими вещами, восстановить подобные формулы бывает сложно (да и часто просто не хочется тратить на это время) — поэтому, мы решили написать эту страницу не только для «ленивых» посетителей нашего сайта, но отчасти и для себя.
Смешиваем 2 газа или жидкости, содержащих вещество — какова будет его концентрация в смеси?
Типичный пример проиллюстрирован на рисунке выше (или справа — смотря, какой у Вас монитор) : имеется 40-процентный (по объему) раствор этилового спирта в воде (водка) и пиво, которое мы условно будем считать 5-процентным (об.) раствором того же этилового спирта в той же воде. Предположим, что мы смешали 0,7 литра водки с 2 литрами пива. Какова будет итоговая концентрация, или объемное содержание, этилового спирта в получившейся смеси?
Отметим, что по формуле ниже можно рассчитать итоговую концентрацию не только по объему, но и по массе, а в некоторых случаях, эту формулу можно использовать и вообще для расчета итоговых величин другого, нежели концентрация, порядка.
, где
C — искомая концентрация вещества в смеси [%]
C1 — концентрация вещества в 1ой составляющей смеси [%]
V1 — объем 1ой составляющей смеси [единица измерения объема — например, л — или единица измерения массы]
C2 — концентрация вещества во 2ой составляющей смеси [%]
V2 — объем 2ой составляющей смеси [та же единица измерения, что для V1]
Для удобства проведения расчетов по вышеприведенной формуле, мы подготовили автоматический калькулятор:
Сколько нужно добавить, чтобы получить требуемую концентрацию?
Другой случай, обратный описанному выше: известен состав исходной газовой смеси или раствора, и известна требуемая финальная концентация вещества, которую нужно получить. Получить ее требуется путем добавления к исходной смеси газов/жидкостей другой смеси, содержащей требуемое вещество. Однако, неизвестно одно из двух: или сколько смеси с известным содержанием вещества нужно добавить, или насколько концентрированным должно быть известное количество добавляемого вещества. То есть, не известно или C2, или V2.
Рассмотрим случай с неизвестным объемом «добавки» V2, при известной ее концентрации C2. Путем несложных математических преобразований выше приведенной формулы получаем:
И, для Вашего удобства, калькулятор к ней:
Конечно, аналогичным образом, выведя формулу для определения концентрации второй составляющей C2, можно посчитать также, какое содержание нужного вещества должно быть в известном объеме V2 второй составляющей, чтобы в итоге получилась некая требующуяся концентрация C.
Основные методы решения задач на смешивание растворов
“Только из союза двоих, работающих вместе и при помощи друг друга, рождаются великие вещи.”
Антуан Де Сент-Экзюпери
Математика многообразна и многогранна. Существует ряд ситуаций в образовательном процессе, когда при изучении какой-либо темы по физике, химии, биологии и т.д. затрагиваются понятия математики, например, существуют задачи, которые решают как на уроках математики, так и на уроках химии. Способы решения задач представляют и учителя химии, и математики, но есть проблема: математики знают математику, а химики — химию. И не всегда способы совпадают.
В данной статье приводятся рекомендации по решению химических задач на смешение растворов разными способами: с помощью расчетной формулы, “Правила смешения”, “Правила креста”, графического метода, алгебраического метода. Приведены примеры решения задач.
1. Основные химические понятия
Приведем некоторые указания к решению задач на растворы.
Основными компонентами этого типа задач являются:
а) массовая доля растворенного вещества в растворе;
б) масса растворенного вещества в растворе;
в) масса раствора.
а) все получившиеся смеси и сплавы являются однородными;
б) смешивание различных растворов происходит мгновенно;
в) объем смеси равен сумме объемов смешиваемых растворов;
г) объемы растворов и массы сплавов не могут быть отрицательными.
Определения и обозначения.
Массовая доля растворенного вещества в растворе — это отношение массы этого вещества к массе раствора.
где 


Следствия формулы (1):



m1(в-ва), m2(в-ва), m(в-ва) — массы растворенных веществ в соответствующих растворах;
m1(р-ра), m2(р-ра), m(р-ра) — массы соответствующих растворов.
Основными методами решения задач на смешивание растворов являются: с помощью расчетной формулы, “Правило смешения”, “Правило креста”, графический метод, алгебраический метод.
Приведем описание указанных методов.
1.1. С помощью расчетной формулы
В наших обозначениях, получим формулу для вычисления массовой доли вещества (?) в смеси.
1. Масса полученного при смешивании раствора равна:
2. Определим массы растворенных веществ в первом и втором растворах:
m1(в-ва)= 

3. Следовательно, масса растворенного вещества в полученном растворе вычисляется как сумма масс веществ в исходных растворах:
m(в-ва) = m1(в-ва) + m2(в-ва) = 

4. Таким образом, массовая доля растворенного вещества в полученном растворе равна:
где 
Замечание: При решении задач удобно составлять следующую таблицу.
1-й раствор
2-й раствор
Смесь двух растворов
Масса растворов
m1 + m2
Массовая доля растворенного вещества
Масса вещества в растворе



1.2. “Правило смешения”
Воспользуемся формулой (4):
тогда
Отсюда
Таким образом, отношение массы первого раствора к массе второго равно отношению разности массовых долей смеси и второго раствора к разности массовых долей первого раствора и смеси.
Аналогично получаем, что при
Замечание: Формула (5) удобна тем, что на практике, как правило, массы веществ не отвешиваются, а берутся в определенном отношении.
1.3. “Правило креста”
“Правилом креста” называют диагональную схему правила смешения для случаев с двумя растворами.
Слева на концах отрезков записывают исходные массовые доли растворов (обычно слева вверху-большая), на пересечении отрезков — заданная, а справа на их концах записываются разности между исходными и заданной массовыми долями. Получаемые массовые части показывают в каком отношении надо слить исходные растворы.
1.4. Графический метод
Отрезок прямой (основание графика) представляет собой массу смеси, а на осях ординат откладывают точки, соответствующие массовым долям растворенного вещества в исходных растворах. Соединив прямой точки на осях ординат, получают прямую, которая отображает функциональную зависимость массовой доли растворенного вещества в смеси от массы смешанных растворов в обратной пропорциональной зависимости
Полученная функциональная прямая позволяет решать задачи по определению массы смешанных растворов и обратные, по массе смешанных растворов находить массовую долю полученной смеси.
Построим график зависимости массовой доли растворенного вещества от массы смешанных растворов. На одной из осей ординат откладывают точку, соответствующую массовой доли 



Замечание: Данный способ является наглядным и дает приближенное решение. При использовании миллиметровой бумаги можно получить достаточно точный ответ.
1.5. Алгебраический метод
Задачи на смешивание растворов решают с помощью составления уравнения или системы уравнений.
2. Примеры решения задач
В 100 г 20%-ного раствора соли добавили 300 г её 10%-ного раствора. Определите процентную концентрацию раствора.
Решение:
C помощью расчетной формулы
Путем последовательных вычислений
- Сколько растворенного вещества содержится:
а) в 100 г 20%-ного раствора; [100•0,2 = 20(г)]
б) в 300 г 10%-ного раствора? [300•0,1 = 30(г)]
Сколько вещества содержится в образовавшемся растворе?
20 г + 30 г = 50 г
Чему равна масса образовавшегося раствора?
100 г + 300 г = 400 г
Какова процентная концентрация полученного раствора?
Пусть х — процентная концентрация полученного раствора. В первом растворе содержится 0,2•100(г) соли, а во втором 0,1•300(г), а в полученном растворе х•(100 + 300)(г) соли. Составим уравнение:
0,2•100 + 0,1•300 = х•(100 + 300);
Задача 2. u(№10.26, [1])
Смешали 10%-ный и 25%-ный растворы соли и получили 3 кг 20%-ного раствора. Какое количество каждого раствора в килограммах было использовано?
а) C помощью уравнения:
Пусть х (кг) — масса 1-го раствора, тогда 3-х (кг) -масса 2-го раствора.
0,1•х (кг) содержится соли в 1-ом растворе,
0,25•(3-х) (кг) содержится соли в 2-ом растворе,
0,2•3 (кг) содержится соли в смеси.
Учитывая, что масса соли в 1-ом и 2-ом растворах равна массе соли в смеси, составим и решим уравнение:
0,1•х + 0,25•(3-х) = 0,2•3;
х = 1, 1кг-масса 1-го раствора
3 — х = 3 — 1 =2 (кг) — масса 2-го раствора.
Ответ: 1 кг, 2 кг.
б) С помощью системы уравнений
Пусть х (кг) — количество первого раствора, у (кг) — количество второго раствора. Система уравнений имеет вид:
Ответ: 1 кг, 2 кг.
Составим диагональную схему
Сосуд емкостью 5 л содержит 2 л р%-ного (по объёму) раствора соли. Сколько литров 20%-ного раствора такой же соли надо налить в сосуд, чтобы процентное содержание соли в сосуде стало наибольшим?
Решение (графический способ)
Заметим, что по условию, объём второго раствора не превышает трёх литров.
- Ели р 20, то при добавлении 2-го раствора, процентное содержание соли будет уменьшаться, т.е. прилить нужно 0 л.
Разбавление и смешение растворов и других веществ
Количественные соотношения, устанавливающиеся при разбавлении растворов водой, смешении растворов, газов или твердых материалов различных концентраций можно найти на основании материального баланса. Для случая смешения двух растворов одного вещества этот баланс представляется в виде следующего уравнения:
где G – количество смешанного раствора с концентрацией С;
G1 и G2 – количества смешанных растворов с концентрацией С1 и С2.
Из уравнения материального баланса определяется любая из искомых величин, если заданы остальные. Например:

Количества G1 растворяемого вещества (при С1=100%) и растворителя G2 (при С2=0), необходимое для получения раствора концентрации С (в %):
Для разбавления G1 частей раствора с начальной концентрацией С1 (%) до требуемой концентрации С (%), необходимо растворителя (воды) G2 (С2=0)
Количество кристаллогидрата G1, которое следует растворить в 100 частях воды для получения раствора с концентрацией, в расчете на безводное вещество, равной С %:

где М и Мк – молекулярные массы безводного вещества кристаллогидрата.
Если С>100 (М/Мк), то получить раствор заданной концентрации из кристаллогидрата невозможно.
Правило «креста»
Расчеты при разбавлении и смешении двух растворов или других веществ удобно производить с помощью так называемого правила креста, наглядное представление о котором дает приводимая ниже схема:
В точке С пересечения прямых записывают содержание вещества в смешанном растворе (в смеси) С (в %). Содержание вещества в исходных смешиваемых растворах С1 и С2 (в %) указывают с левой стороны креста, причем С1>С2. Разница С1-С соответствует количеству частей С2 %-ного раствора, необходимого для смешивания с С-С2 частями С1 %-ного разбавляемого раствора.
При разбавлении раствора водой С2=0.
Пример 1. Сколько нужно воды для разбавления 20 % раствора NaNO3 до 10%?
Решение. Пользуясь правилом креста, получим
Для разбавления раствора в два раза необходимо добавлять к нему равное количество воды. (Это ясно априори и наглядно иллюстрирует применение правила креста).
При смешении двух кислот различной концентрации или кислоты с водой расчет производят аналогично. Для приготовления растворов серной кислоты с применением олеума расчет ведут также на основе материального баланса моногидрата.
Пример 2. В каком соотношении следует смешать кислоты, содержащие 42 и 98% Н2SО4, чтобы приготовить кислоту концентрацией 92.5% Н2SО4?
Решение. По правилу креста
Следовательно, необходимо смешать 50.5 масс. ч. 98% Н2SО4 и 5.5 масс. ч. 42% Н2SО4.
Смешение двух растворов различных веществ


где a и b – соответственно весовые количества раствора вещества А и раствора вещества В, необходимые для приготовления смеси;
m – концентрация раствора вещества А (вес %);
m’ – процентное содержание вещества А в смеси;
с – весовое количество смеси;
n — концентрация раствора вещества В (вес %);
n’ – процентное содержание вещества В в смеси;
l – процентное содержание растворителя в смеси.
Пример 3. Определить какой концентрации (m) и в каком весовом количестве (а) следует взять H2SO4, чтобы при смешении ее с 75% HNO3 приготовить 1500кг смеси состава: 57% H2SO4, 30% HNO3 и 13% Н2О.
1) 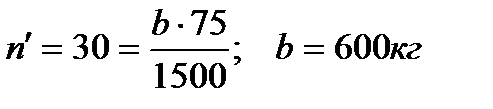
2) а=1500 – 600 = 900кг;
3)
Концентрирование раствора выпариванием растворителя:
где х – весовое количество растворителя, которое необходимо удалить выпариванием из а вес. ч. раствора с данной концентрацией m, чтобы получить раствор с требуемой концентрацией n;
а – весовое количество раствора до выпаривания растворителя;
b – весовое количество раствора после выпаривания растворителя;
m и n – концентрации раствора (в вес. %) до и после выпаривания х вес. ч. растворителя: n>m.
Смешение твердых материалов.
Расчеты при составлении смесей из двух твердых веществ, например при смешении удобрений, ничем не отличаются от расчетов смешения газов и жидкостей.
Пример 4. Сколько хлористого калия (92% КСl) и сильвинита (22% КСl) необходимо смешать для получения калийной удобрительной соли, содержащей 30% К2О?
Решение. Пересчитаем предварительно концентрацию калия в удобрительной смеси, равную 30% К2О, на процентное содержание КСl.
Применяя правило креста, получим:
Таким образом, для получения требуемой смеси необходимо взять 25.5 мас.ч. 92% КСl и 44.5 мас.ч. сильвинита.
Основные понятия и терминология.
1. Труд-это целесообразная деятельность человека, направленная на видоизменение и приспособление предметов природы для удовлетворения своих жизненных потребностей.
Труд (трудовая деятельность) предусматривает наличие трех элементов-
Если трудовая деятельность осуществляется на производстве, ее называют производственной деятельностью.
Производственная деятельность-совокупность действий работников с применением средств труда, необходимых для превращения ресурсов в готовую продукцию, включающих в себя производство и переработку различных видов сырья, строительство, оказание различного вида услуг. Производственная деятельность осуществляется в рабочей (производственной) зоне.
Рабочая (производственная) зона – пространство высотой до 2-х метров над уровнем пола или площадки, на которой находятся места постоянного или временного пребывания работающих (рабочие места).
Рабочее место – это часть рабочей зоны, в которой постоянно или временно находятся работающие в процессе трудовой деятельности.
Постоянным называется рабочее место, на котором работающий находится не менее половины своего рабочего времени или более 2-х часов своего рабочего времени непрерывно.
Если работа осуществляется в различных пунктах рабочей зоны, то рабочим местом считается вся рабочая зона.
Негативные факторы, возникающие в рабочей зоне,-это такие факторы, которые отрицательно действуют на человека, вызывая ухудшение состояния здоровья, заболевания или травмы.
Возникновение негативных факторов определятся таким свойством среды обитания (производственной среды), как опасность.
Опасность-это потенциальное свойство среды обитания, ее отдельных компонентов, проявляющееся в нанесении вреда объекту защиты, в качестве которого может выступать и сам источник опасности-человек. Опасность-это главное понятие в безопасности жизнедеятельности, в частности, в безопасности труда.
Центральная аксиома о потенциальной опасности жизнедеятельности-жизнедеятельность человека потенциально опасна.
Негативные производственные факторы называются опасными и вредными производственными факторами (ОВПФ).
Опасный производственный фактор (ОПФ) –воздействие которого на человека приводит к травме или летальному (смертельному) исходу. Поэтому ОПФ называют также травмирующим (травмоопасным) фактором. К ОПФ относят движущие машины и механизмы, подъемно-транспортные устройства и перемещаемые грузы, электрический ток, отлетающие частицы обрабатываемого металла и пр.
Вредный производственный фактор (ВПФ)-воздействие которого на человека приводит к ухудшению самочувствия или, при длительном воздействии, к заболеванию. Например, повышенная или температура в рабочей зоне, повышенные уровни шума, вибрации, электромагнитных излучений, радиации, загрязненность воздуха рабочей зоны пылью, вредными газами, вредными микроорганизмами, бактериями и пр.
Между опасными (травмирующими) и вредными произв-ми факторами существует определенная взаимосвязь. При высоких уровнях ВПФ они могут становиться опасными. Так, очень высокие концентрации вредных веществ могут привести к отравлению или даже к смерти. Так же- высокие уровни звука, радиации. Во многих случаях наличие в рабочей зоне ВПФ способствует появлению ОПФ. Например, повышенные влажность и температура, наличие токопроводящей пыли (вредные факторы) значительно повышают опасность поражения человека электрическим током (опасные факторы)
Травма-повреждение в организме человека, вызванное действием факторов внешней среды (механические, термические – ожоги, обморожения, химические, баротравмы (из-за быстрого изменения атмосферного давления), электротравмы, психические и т. д..Травмы бывают
-комбинированные ()сочетают несколько видов травм
-производственные (полученные в процессе трудовой деятельности на производстве
-бытовые (не связанные с работой – по дороге на работу и с работы, выполнение своих непоср. Обязанностей по заданию руководства)
Несчастный случай-неожиданное и незапланированное событие, сопровождающееся травмой.
Несчастный случай на производстве-случай воздействия на работающего производственного фактора при выполнении им трудовых обязанностей или задания руководителя работ.
Длительное воздействие на человека ВПФ может привести к профессиональному заболеванию.
Профессиональное заболевание-заболевание, причиной которого является воздействие на человека ВПФ в процессе трудовой деятельности (вибрации-виброболезнь, шума-тугоухость, радиации-лучевую болезнь и тд.
Безопасность-состояние деятельности, при которой с определенной достоверностью исключено проявление опасностей, а уровень риска не превышает приемлемый уровень. Это комплексная система мер защиты человека и среды его обитания от опасностей, формируемых конкретной деятельностью. Комплексную систему безопасности формируют нормативно-правовые, организационные, экономические, технические, санитарно-гигиенические и лечебно-профилактические меры.
Безопасность труда-состояние трудовой деятельности (труда), обеспечивающее приемлемый уровень ее риска. Для производственной деятельности применимо понятие производственной безопасности.
Безопасность труда обеспечивается комплексной системой мер защиты человека от опасностей, формируемых в рабочей зоне конкретным производственным процессом или
Нормативно-правовые меры-система законов, законодательных актов, норм, правил, регулирующих и безопасность и определяющих требования безопасности.
Организационные меры-организация рабочей зоны и рабочего места, режима труда и отдыха, продолжительности рабочего дня т. д.
Экономические меры-экономические механизмы, стимулирующие выполнение требований безопасности-материальная ответственность за их несоблюдение, материальное поощрение за организацию безопасных условий и т.д.
Технические меры-применение технических методов и средств, обеспечивающих безопасность трудовой деятельности.
Санитарно-гигиенические меры-направленные на обеспечение гигиены и санитарии.
Лечебно-профилактические меры-профилактические мед. Осмотры, лечебное и профилактическое питание, витаминизация и тд.
Охрана труда-система сохранения жизни и здоровья работников в процессе трудовой деятельности, включающая в себя правовые, социально-экономические, организационно-технические, санитарно-гигиенические, профилактические, реабилитационные и иные другие.
Безопасность труда обеспечивается методами и средствами производственной санитарии, гигиены труда, производственной безопасности.
Производственная санитария-система организационных мероприятий и технических средств, предотвращающих или уменьшающих воздействие на работающих ВПФ, возникающих в рабочей зоне в процессе ТД (освещение и вентиляция, микроклимат, защита от различного вида излучений).
Гигиена труда-область медицины, изучающая ТД человека и производственную среду с точки зрения их влияния на организм человека, разрабатывающая меры и гигиенические нормативы, направленные на оздоровление условий труда и предупреждение проф.заболеваний. Задачей гигиены труда является определение предельно-допустимых уровней ВПФ, классификация условий ТД, оценка тяжести и напряженности трудового процесса, рациональная организация режима труда и отдыха, рабочего места, изучение психофизиологических аспектов ТД и тд.
Производственная безопасность-система организационных мероприятий и техн. Средств, предотвращающих или уменьшающих вероятность воздействия на работающих ОПФ, возникающих в рабочей зоне в процессе ТД.
ПБ-это организационные мероприятия и тех.средства защиты от поражения эл.током, от мех. травмирования движ-ся механизмами, подъемно-транспортными ср-вами, обеспечение безопасности систем высокого давления , методы и средства обеспечения пожаровзрывобезопасности и тд.
Технические методы и средства, обеспечивающие производственную безопасность, наз-ся техникой безопасности.
http://urok.1sept.ru/articles/212299
http://lektsii.org/1-42311.html