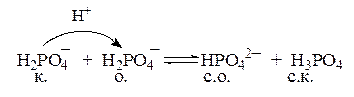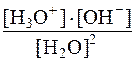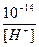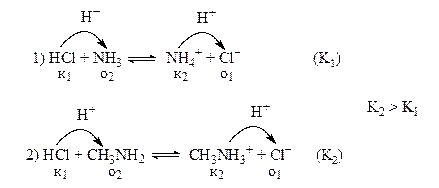Классификация кислот и оснований.
По теории Бренстеда и Лоури, как видно из примеров, понятия кислоты и основания значительно расширены. Кислотами и основаниями могут быть как молекулы, так и ионы.
| Типы частиц | кислоты | основания |
| Нейтральные молекулы | H2SO4, HNO3, HBr, HCl | H2O, NH3, C2H5OH, CH3NH2 |
| Катионы | NH4 + , H3O + , [Cr(H2O)6] 3+ | [Cr(H2O)5(OH)] 2+ , [Al(H2O)4(OH)2] + |
| Анионы | HSО4 – , HPО4 2– , HS – | Cl – , F – , Br – , OH – , СН3СОО – |
Из приведенных примеров видно, что есть вещества или частицы, способные проявлять свойства и кислот и оснований, например вода.
кислота сопр. осн-е основание сопр. к-та
Протолиты, способные как отдавать протон, так и принимать протон, т.е. обладающие как протонодонорными, так и протоноакцепторными свойствами, называются амфолиты.
К амфолитам относятся: вода, спирты, карбоновые кислоты, жидкий аммиак, гидрид анионы многоосновных кислот и т.д.
Характерной реакцией амфолитов является реакция кислотно-основного диспропорционирования или автопротолиза (самоионизации).
Автопротолиз воды. Ионное произведение воды.
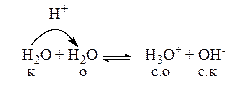
Вода – очень слабый электролит, следовательно образующиеся сопряженная кислота и сопряженное основание являются сильными. Поэтому равновесие этой протолитической реакции смещено влево.
Константа этого равновесия Кравн =
Количественная величина произведения концентрации ионов воды [H3O + ]×[OH – ] есть ионное произведение воды.
Оно равно: [H3O + ]×[OH – ] = Кравн. × [H2O] 2 = 1×10 – 14
Следовательно: КН2О = [H3O + ]×[OH – ] = 10 – 14
или упрощенно КН2О = [H + ]×[OH – ] = 10 – 14
КН2О – ионное произведение воды, константа автопротолиза воды или просто константа воды. КН2О зависит от температуры. При повышении t°С она увеличивается.
В химически чистой воде [H + ] = [OH – ] = 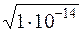
В растворе может быть [H + ] > [OH – ] – среда кислая или [H + ] – ] – среда щелочная
[H + ] = 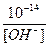
Водородный показатель рН
Для количественного выражения кислотности растворов используют показатель концентрации ионов водорода рН.
Водородный показатель – это величина, равная отрицательному десятичному логарифму концентрации свободных ионов водорода в растворе.
рН = – lg [H + ] ⇒ [H + ] = 10 – рН
рН = 7 – среда нейтральная ([H + ] = [ОН — ])
рН > 7 – среда щелочная (избыток ионов ОH — )
Для характеристики основности среды используется гидроксильный показатель рОН
рОН = – lg [ОH — ] ⇒ [ОH — ] = 10 – рОН
рН + рОН = 14 Þ рН = 14 – рОН и рОН = 14 – рН
Значение рН для химических реакций и
биохимических процессов организма.
Многие реакции для протекания в определённом направлении требуют строго определённой величины рН среды.
В норме в здоровом организме реакция среды большинства биологических жидкостей близка к нейтральной.
Кишечный сок – 6,4
Желудочный сок: а) в состоянии покоя – 7,3
б) в состоянии пищеварения – 1,5-2
Отклонение рН от нормы имеет диагностическое (определение болезни) и прогностическое (течение болезни) значение.
Временное отклонение рН крови от нормы на десятые доли приводит к серьезным нарушениям в организме. Длительное отклонение рН крови может оказаться смертельным. Отклонения рН крови могут быть 6,8 – 8, изменения вне этого интервала в любую сторону несовместимы с жизнью.
Формулы расчёта рН для растворов кислот и оснований.
| рН = – lg [H + ] | [H + ] = 10 – рН |
| рОН = – lg [ОH — ] | [ОH — ] = 10 – рОН |
| рН + рОН = 14 | [H + ]×[OH – ] = 10 – 14 |
Существуют различные методы определения рН: с помощью индикаторов и приборов-иономеров.
Совмещённые и изолированные протолитические равновесия.
Протолитические процессы – реакции обратимые. Протолитические равновесия смещены в сторону образования более слабых кислот и оснований. Их можно рассматривать как конкуренцию различных по силе оснований за обладание протоном. Говорят об изолированных и совмещённых равновесиях.
Если несколько одновременно существующих равновесий независимы друг от друга, их называют изолированными. Смещение равновесия в одном из них не влечёт за собой изменение положения равновесия в другом.
Если же изменение равновесия в одном из них приводит к изменению равновесия в другом, то говорят о совмещённых (сопряжённых, конкурирующих) равновесиях. Преобладающим процессом в системах с совмещённым равновесием является тот, который характеризуется бóльшим значением константы равновесия.
Пример:
Преобладающим будет второй процесс, т.к. его константа равновесия больше константы равновесия первого процесса. Равновесие во втором процессе смещено вправо в большей степени, т.к. метиламин более сильное основание, чем аммиак, NH4 + – более сильная кислота, чем СН3NН3 + .
Вывод: более сильное основание подавляет ионизацию более слабого основания. Следовательно, при добавлении небольшого количества соляной кислоты к смеси аммиака и метиламина протонированию в основном будет подвергаться метиламин.
И также: наиболее сильная кислота подавляет ионизацию слабых кислот. Так, соляная кислота, находящаяся в желудочном соке, подавляет ионизацию уксусной кислоты (поступающей с пищей) или ацетилсалициловой кислоты (лекарственное вещество).
Дата добавления: 2016-03-10 ; просмотров: 1608 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Тема №3 Протолитическое равновесие в водных растворах слабых кислот, слабых оснований и солей
ПРОТОЛИТИЧЕСКОЕ РАВНОВЕСИЕ В ВОДНЫХ РАСТВОРАХ СЛАБЫХ КИСЛОТ, СЛАБЫХ ОСНОВАНИй И СОЛЕЙ
Типовые задачи по данной теме
1. Расчет степени ионизации и концентрации ионов в водных
растворах слабых электролитов.
2. Расчет рН водных растворов слабых кислот и оснований.
3. Расчет концентрации слабых кислот и оснований по
величине рН раствора.
4. Расчет рН водных растворов солей.
Основные теоретические положения
Кислотно-основные реакции — это частный случай равновесия в гомогенной системе, поэтому расчеты равновесных концентраций компонентов реакции базируются на законе действующих масс и условии материального баланса.
Кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Согласно протолитической теории Бренстеда-Лоури кислота – это вещество, являющееся донором протонов, а основание — акцептором протонов. Вещества, способные и отдавать, и принимать протоны, называются амфолитами.
Кислоты могут быть молекулярными (HNO2, HCN, H2CO3), катионными (H3O+, NH4+, Al(H2O)63+) и анионными (HC2O4-, HCO3-, H2PO4-).
Основания могут быть молекулярными (NH3, CH3NH2), катионными (AlOH(H2O)5)2+, BaOH+) и анионными (CN-, CO32-, OH-).
Амфолиты могут быть нейтральными (H2O, NH2CH2COOH) и заряженными (HCO3-, HC2O4-, HS-, H2PO4-, AlOH(H2O)52+).
Растворы слабых кислот
Сила слабой монопротонной (одноосновной) кислоты НАn, ионизация которой в водном растворе протекает согласно уравнению
НАn + Н2О 
характеризуется константой кислотности Ка(НАn) или силовым показателем рКа(НАn):

При записи уравнения (1) в виде Н3О+ + Аn- 

Константа кислотности Ка(НАn) и константа протонирования Кн(Аn–) имеют постоянные значения при постоянной температуре и любой ионной силе раствора.
Обозначим молярную концентрацию слабой монопротонной кислоты НАn, ионизация которой в водном растворе описывается уравнением (1), через Са, а степень ее ионизации как αа. С учетом того, что в растворах слабых электролитов концентрация ионов мала, будем считать активности ионов равными их концентрациям (Ic = 0, f(An–) = f(H3O+) = 1).
Если кислота НАn не является очень слабой (Ка(НАn) > 10–6), а ее раствор не очень разбавленным (Са(НАn) > 10–4 моль/л), то конкурирующей реакцией автопротолиза воды можно пренебречь.
Тогда при подстановке значений
в формулу (2) получим формулу (4), связывающую Ка, Са и αа:

Если для раствора кислоты НАn отношение Са/Ка ≥ 400, то степень ее ионизации меньше или равна 5% (αа ≤ 0,05, 1 – α ≈ 1). В этом случае [HAn] = Са, Ка = Са αа2 и справедливы соотношения (5-7):

а(Н3О+) = 
pH = – 

Если для раствора кислоты НАn отношение Са/Ка 0,05, 1–α ≠ 1). В этом случае [НАn] ≠ Са и после преобразования формулы (4) получим соотношения (8,9):

а(Н3О+) = [H3O+] =Саαа= 
Выражения (5-9) справедливы для растворов средних солей, образованных остатками слабых оснований (NH4Cl, CuCl2, FeCl3 и т. п.) и для слабых полипротонных кислот (Н3PO4, H2SO3 и т. п.), для которых Ka(HmAn) » Ka(Hm-1An-).
Растворы слабых оснований
Сила слабого основания Аn-, ионизация которого в водном растворе описывается уравнением:
Аn — + Н2О 

Как было показано выше, для характеристики силы основания Аn — может использоваться константа протонирования Кн(Аn-):
Кн(Аn-) =
Аналогично предыдущим рассуждениям легко получить формулы для вычисления степени ионизации, равновесных концентраций и рН растворов слабых оснований.
Для слабого однокислотного основания Аn — с молярной концентрацией Сb и степенью ионизации αb ≤ 0,05 (Cb/Kb ≥ 400) в случае, когда ионизацией воды можно пренебречь, получаем:

a(OH-) = [OH-] = [HAn] = αbCb = 
рН = 14 — рОН = 14 – 
Если αb > 0,05 (Cb/Kb 400, то αа 5% и для расчета αа и рН воспользуемся формулами (8,9):

=
рН = – lg [H3O+] = – lg 2,33·10-2 = 1,63
Пример 3. Рассчитайте степень ионизации аммиака, концентрацию ионов аммония и оксония и рН 0,100 моль/л водного раствора аммиака.
Решение: Ионизация аммиака в водном растворе описывается уравнением:
NH3(b) + HOH = NH4+(a) + OH-
Константа основности Кb равна:

Так как Cb/Kb = 0,100/1,76·10-5 > 400, то степень ионизации аммиака αb
Протолитические равновесия в воде.
В жидкой воде осуществляется протолитическое равновесие, которое называется автопротолизом воды:
Вода – слабый электролит, поэтому за константу химического равновесия (3) можно приближенно принять концентрационную константу химического равновесия Кс, выраженную через равновесные концентрации участников реакции:
[H3O + ][OH — ]

Для автопротолиза воды можно записать:
Kw = [H + ][OH — ]. (5)
Величина Kw, называется константа автопротолиза воды или ионное произведение воды. Она постоянно при постоянной температуре. При комнатной температуре (25 0 С = 298,15К) числовое значение Kwравно:
Kw = 1,008*10 -14 ≈ 10 -14 .
Так как числовые значения Kwочень маленькие, то вместо них принято использовать отрицательный десятичный логарифм («силовой показатель») величины Kw. При комнатной температуре
р Kw = -lg Kw = -lg 10 -14 = 14. (6)
В чистой жидкой воде концентрации ионов водорода и ионов гидроксила одинаковы [H3O + ] = [OH — ]. Поэтому при t = 25ºC (298К) можно записать
[H3O + ] = [OH — ] = 10 -7 ,

pOH = — lg [OH — ] = — lg 10 -7 = 7
pKw = pH + pOH = 14. (8)
Таким образом, при комнатной температуре:
— в кислых водных растворах рН 7.
РН растворов слабых кислот
 |

са – исходная концентрация слабой одноосновной кислоты
РН растворов слабых оснований
 |


са – исходная концентрация слабой одноосновной кислоты
 |
Ионное произведение воды Кw равно произведению констант кислотности и основности сопряженной пары кислоты и основания.
Для показателя pKw получаем:
 |
ЭТАЛОНЫ РЕШЕНИЯ ЗАДАЧ
Задача 1
Определите значение рН, концентрацию ионов водорода и гидроксильных групп в чистой воде (нейтральный раствор) при температуре 50°С, если ионное произведение воды при этой температуре равно Kw = 5,50·10 -14 . Во сколько раз изменилась концентрация ионов водорода по сравнению с комнатной температурой?
В соответствии с уравнением ионное произведение воды Kw=[H3O + ][OH — ]. В рассматриваемом случае [H3O + ][OH — ]=5,50·10 -14 . Поскольку концентрации ионов гидроксония и гидроксильных групп в чистой воде одинаковы, то [H3O + ]=[OH — ]=(5,50·10 -14 ) 1/2 = 2,34·10 -7 моль/л.
Рассчитаем рН раствора: pH = — lg [H3O + ] = — lg (2,34·10 -7 ) = 6,63.
Это значение рН соответствует нейтральной среде воды и водных растворов при 50°С.
Известно, что при комнатной температуре для чистой воды Kw = 10 -14 , [H3O + ]=[OH — ]=10 -7 моль/л, рН = 7. Следовательно, при 50°С концентрация ионов водорода в чистой воде увеличилась по сравнению с их концентрацией при комнатной температуре в 2,34·10 -7 /10 -7 = 2,34.
Задача 2
Рассчитайте концентрацию формиат-ионов HCOO — в водном растворе муравьиной кислоты HCOOH c концентрацией кислоты с(HCOOH)=0,05 моль/л. Константа кислотной диссоциации муравьиной кислоты равна 1,8·10 -4 .
Муравьиная кислота как слабый электролит в водном растворе подвергается электролитической диссоциации:
c константой кислотной диссоциации Kа=[H3O + ][HCOO — ]/[HCOOH]. Равновесные концентрации ионов [H3O + ] и [HCOO — ] одинаковы, так как при диссоциации из одной молекулы муравьиной кислоты образуются по одному иону гидроксония и формиат-иону. Равновесную концентрацию муравтиной кислоты [HCOOH] можно принять равной ее исходной концентрации с(HCOOH) в растворе, поскольку степень ионизации мала, так что число молекул муравьиной кислоты, распавшихся на ионы, намного меньше общего числа молекул муравьиной кислоты в растворе. Поэтому Kа=[HCOO — ] 2 /c(HCOOH) или 1,8·10 -4 = [HCOO — ] 2 /0,05. Решая последнее уравнение относительно [HCOO — ], получаем:
[HCOO — ] = (0,05·1,84·10 -4 ) 1/2 = 3·10 -3 моль/л.
Задача 3
Рассчитайте рН водного раствора, содержащего в 1 л массу m(H3BO3) = 3,0 г ортоборной кислоты H3BO3. Константа кислотной диссоциации этой кислоты по первой степени равна K1 = 7,1·10 -10 , pK1 = 9,15. Диссоциацией по второй и третьей стадиям – пренебречь.
Ортоборная кислота H3BO3 в водном растворе на первой стадии диссоциации распадается на ионы по схеме:
c константой кислотности K1 = [H3O + ][H2BO3 — ]/[H3BO3]. В соответствии с уравнением можно записать для данного случая: рН=0,5[pK1 +pc(H3BO3)], где с(H3BO3) – исходная концентрация раствора ортоборной кислоты, выраженная в моль/л. Рассчитаем с(H3BO3). Очевидно с(H3BO3) = m(H3BO3)/M(H3BO3)=3,0/61,833=0,049 моль/л, где M(H3BO3) = 61,833 – молярная масса ортоборной кислоты.
Вычислим теперь рН раствора:
рН=0,5(9,15 – lg 0,049) = 5,23
Задача 4
Рассчитайте рН водного раствора пиридина С5H5N с концентрацией с(С5H5N)=0,20 моль/л. Константа основности пиридина равна Kb = 1,5·10 -9 , pKb=8,82.
В водном растворе пиридина устанавливается равновесие с образованием катиона пиридиния С5H5NH + :
Концентрационная константа этого равновесия выражается формулой Kb = [С5H5NH + ][OH — ]/[С5H5N]. Пиридин – однокислотное основание, поэтому в соответствии с выражением можно записать:
http://pandia.ru/text/80/167/16767.php
http://megalektsii.ru/s21159t8.html