Комплексные соединения
Материалы портала onx.distant.ru
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами . Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F — — фторо, Cl — -хлоро, ОН — — гидроксо, CN — — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование комплексных солей.
Если комплексообразователем является Fe 2+ или Fe 3+ , то координационные числа в обоих случаях равны шести:
Координационные числа ртути и меди, как правило, равны четырем:
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
- образования малорастворимого соединения с комплексообразователем:
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например , в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
Для комплексного иона [Ni(NH3)6] 2+ , диссоциирующего по уравнению
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni 2+ ]·[NH3] 6 / [[Ni(NH3)6] 2+ ] (1)
Величина, обратная Кн, называется константой устойчивости:
Она представляет собой константу равновесия процесса образования комплексного иона:
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGT о = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3 — в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag + в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2] + = 5,7× 10 — 8 при 298 К.
3) Величину ΔG o 298 процесса диссоциации комплексного иона.
[NO3 — ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag + и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2] + составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
Следовательно, [Ag + ] = 1,43× 10 — 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2] + уравнением:
Значит, при Т = 298 К получаем:
ΔG о 298 = — 8,314× 298× ln5,7× 10 — 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10 — 10 , Кн.[Ag(NH3)2] + = 5,7× 10 — 8 .
Решение. Осадок выпадет при условии: [Ag + ][Сl — ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag + и Сl — в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10 -3 , 1 и 0,25 М соответственно.
Найдем концентрацию [Ag + ] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10 — 10 .
Значит, [Ag + ] = 2,85× 10 — 10 моль/л, а [Сl — ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag + ][Сl — ] = 2,85× 10 — 10 × 0,25 = 7,1× 10 — 11 (моль/л) 2 .
Поскольку [Ag + ][Сl — ] = 7,1× 10 — 11 — 10 , то осадок не выпадет.
Задача 3. При какой концентрации ионов S 2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10 — 27 , Кн[Cd(CN)4] 2- = 7,8× 10 — 18 .
Решение. Осадок выпадет при условии: [Cd 2+ ][S 2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd 2+ и S 2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S 2- ] > ПР(CdS):[Cd 2+ ].
Комплексный ион диссоциирует незначительно:
[Cd(CN)4] 2- → Cd 2+ + 4CN —
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd 2+ и 4x моль/л ионов CN — . Суммарная концентрация ионов CN — равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4] 2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4] 2- = [Cd 2+ ] · [CN — ] 4 / [[Cd(CN)4] 2- ]
Следовательно, [Cd 2+ ] = 1,8·10 — 12 моль/л.
Выпадение осадка начнется при [S 2- ] > 7,9·10 — 27 : 1,8·10 — 12 > 4,39·10 — 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия;
2. Назовите следующие комплексные соединения
[Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II).
3. Составьте уравнение химической реакции:
4. Составьте уравнение химической реакции:
5 . Составьте уравнение химической реакции:
6. Составьте уравнение химической реакции:
7. Составьте уравнение химической реакции:
Диссоциация комплексных соединений
Многие комплексные соединения, имеющие внешнюю сферу, хорошо растворимы в воде. Все они являются сильными электролитами при диссоциации по первой ступени (так называемая первичная диссоциация).
Первичная диссоциация — это распад комплексного соединения на комплексный ион и ионы внешней сферы. Именно первая ступень диссоциации комплексного соединения определяет его принадлежность к тому или иному классу неорганических соединений:
Комплексные ионы так же подвергаются диссоциации (вторичная диссоциация), но все они являются слабыми электролитами:
[Ag (NH3)2] + 
[Ag(NH3)] + 
Суммарное уравнение: [Ag(NH3)2] + 
Константа диссоциации, найденная для суммарного уравнения, называется константой нестойкости комплекса:
Kн ([Ag(NH3)2]) + = 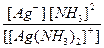
Чем меньше значение Кн , тем менее данный комплекс подвержен электролитической диссоциации, тем более он устойчив в растворе.
Диссоциация комплексных соединений
Константа нестойкости
В водных растворах комплексные соединения диссоциируют в две стадии. Первая стадия протекает по типу сильных электролитов, т.е. идет процесс полной диссоциации на внутреннюю и внешнюю сферу:
По второй стадии комплексный ион диссоциирует как слабый электролит обратимо, ступенчато и для каждой ступени есть своя ступенчатая константа:
[AgCN] ÛAg + + CN — К2
Суммарный процесс диссоциации комплексного иона можно представить схемой: [Ag(CN)2] — Û Ag + + 2CN — Кн
К равновесному процессу диссоциации комплексного иона применим закон действующих масс. Общая константа диссоциации комплексного иона запишется:

Практически пользуются общей константой, называемой константой нестойкости Кн, которая равна произведению промежуточных ступенчатых констант диссоциации комплексного иона Кн = К1×К2.
Константой нестойкости называется отношение произведения концентраций продуктов диссоциации комплексного иона в соответствующих степенях к равновесной концентрации неионизированных комплексных ионов. Причем чем меньше константа нестойкости, тем прочнее комплексный ион.
Величина, обратная константе нестойкости, называется константой устойчивости, или константой образования, Куст. = 1/Кн.
Значения констант нестойкости комплексных ионов и их показатели даются в справочниках (см. список рекомендуемой литературы), некоторые приведены в табл. IV. Показатель константы нестойкости равен десятичному логарифму константы, взятому с обратным знаком: рКн = -lgКн
Следует обратить внимание, что сравнивать прочность комплексов по величинам констант нестойкости можно только для однотипных комплексных ионов, т.е. дающих при диссоциации одинаковое число ионов. Например:
т.к. константа нестойкости цианида намного меньше, чем аммиаката, то можно говорить о его большей прочности:
Из двух аммиаков прочнее комплексный ион меди, т.к. его константа нестойкости меньше.
Зная величины констант нестойкости можно рассчитать концентрации ионов, входящих в состав внутренней сферы, судить о возможном направлении реакции при открытии ионов, о выборе реагентов для разрушения комплексных ионов.
Решение типовых задач
Задача 1. Вычислить равновесную концентрацию иона меди Cu 2+ и степень диссоциации комплексного иона в 0,01 М растворе [Cu(NH3)4]SO4, Кн = 9,3×10 -13 .
Решение. Запишем уравнение диссоциации комплексного иона:
Обозначим равновесную концентрацию иона меди [Cu 2+ ] = х моль/л, тогда равновесные концентрации остальных частиц равны [NH3] = 4x моль/л, [Cu(NH3) 



256х 5 = 9,3×10 -14 ;

получаем [Cu 2+ ] = 8,2×10 — 4 моль/л.



Задача 2.В каком из 0,1 молярных растворов комплексных солей дицианоаргентата (1) калия и хлорида диамминсеребра (1) концентрация ионов серебра больше и во сколько раз?
Решение. Запишем уравнения диссоциации комплексных ионов [Ag(NH3)2] + и [Ag(CN)2] — :
На основании этих равновесий запишем выражения констант нестойкости:


По таблице IV находим величины констант нестойкости: Кн / = 5,8×10 -8 , Кн // = 1,4×10 -20 . Сравнивая константы, т.к. комплексные ионы однотипные, делаем вывод, что концентрация ионов серебра в дицианоаргентате калия меньше, чем в хлориде диамминсеребра.
Для того, чтобы ответить на вопрос «во сколько раз концентрация ионов серебра в одном растворе больше, чем в другом?», можно провести последовательные вычисления концентрации ионов серебра для каждого из комплексных ионов, как в задаче 1.
Рассмотрим 2-ой путь решения.
Все обозначения и преобразования сделаем, как в задаче 1, обозначив для аммиаката концентрации одним штрихом, а для цианида – двумя штрихами:


0,1 — х / ≈ 0,1 и 0,1 — х // ≈ 0,1, т.к. степени диссоциации комплексных ионов малы.


Выразим х / и х // : 

Разделив х / на х // , получим: 





Задача 3. Вычислите равновесную концентрацию ионов ртути в 0,1 М растворе K2[HgJ4], содержащем 0,01 М KJ, Кн = 1,48×10 — 30 .
Решение. Запишем уравнение процесса диссоциации комплексного иона [HgJ4] 2 — :
[HgJ4] 2 — Û Hg 2+ + 4J —
константа нестойкости ионов ртути равна: 
Выражение для концентрации ионов ртути запишется:

Подставим равновесные концентрации комплексного иона [HgJ4 — 2 ] = 0,1 моль/л и ионов иода [J — ] = 0,01 моль/л, пренебрегая той малой частью, которая образуется при диссоциации комплексного иона, в выражение (1) и проведем вычисление концентрации ионов ртути в растворе:
[Hg 2+ ] = 
Задача 4. Произойдет ли разрушение комплекса, если к 0,02 М раствору K2[HgJ4] прилить равный объем 0,02 М раствора нитрата свинца?
Решение. Комплексный ион будет разрушаться, если будет выполняться условие [Pb 2+ ] × [J — ] 2 ≥ ПР (PbJ2). При этом ионы иода будут связываться в осадок, что вызовет смещение равновесия диссоциации комплексного иона вправо до полного его разрушения. Найдем концентрацию [Pb 2+ ] и [HgJ4] — 2 в растворе после смешивания. Концентрации уменьшаются в 2 раза и соответственно равны: [Pb 2+ ] = 0,01 моль/л, [HgJ4 -2 ] = 0,01 моль/л. Комплексный ион [HgJ4] — 2 диссоциирует по уравнению: [HgJ4] — 2 Û Hg 2+ + 4J —
константа нестойкости равна: 
обозначив концентрацию распавшихся комплексных ионов через х моль/л, тогда равновесные концентрации ионов будут равны: [Hg 2+ ] = х моль/л; [J — ] = 4х моль/л;
[HgJ4 2- ] = (0,01-х) ≈ 0,01 моль/л, т.к. х — 30 ; 256х 5 = 1,48 × 10 — 32 ;

Т.к. за х мы обозначили концентрацию продиссоциировавшей части комплексного иона, то [J — ] = 4х = 4×1,4×10 — 7 = 5,6×10 — 7 (моль/л). Находим произведение концентраций ионов свинца и йода в растворе:
[Pb 2+ ] × [J — ] 2 = 10 -2 × (5,6×10 — 7 ) 2 = 31,4×10 — 16 = 3,1×10 — 15 .
По таблице II находим произведение растворимости йодида свинца: ПР(PbJ2) = 1,1×10 — 9 . Так как 3,1×10 — 15 — 9 , то осадок не выпадает и комплексный ион не разрушается.
Задача 5. Вычислить растворимость бромида серебра (в моль/л) в 1 М растворе аммиака.
Решение. При растворении бромида серебра в растворе аммиака протекают следующие процессы: AgBr↓ Û Ag + + Br —
Суммарное уравнение процесса растворения:
Для данного процесса запишем константу равновесия:
Умножив числитель и знаменатель на равновесную концентрацию ионов серебра [Ag + ], получим после преобразований:

Вычислим Кр, взяв из таблиц значения ПР и Кн:

Обозначим равновесную концентрацию ионов брома [Br — ] = Р моль/л (т.к. она равна растворимости бромида серебра), тогда [Ag(NH3)2 + ] = Р моль/л, а равновесная концентрация аммиака 1-2Р ≈ 1, т.к. Р — 3 (моль/л).
Задача 6.Сколько миллилитров 1М раствора аммиака следует взять для полного растворения 0,1 г бромида серебра?
Решение. Растворимость бромида серебра вычисляем, как в задаче 5.

Вычислив количество вещества бромида серебра:

рассчитываем объем 1М раствора аммиака:

Задача 7. Сколько моль/л аммиака необходимо добавить к 0,02 М раствору нитрата серебра, чтобы понизить равновесную концентрацию ионов серебра до 1×10 — 7 моль/л?
Решение. Запишем общую схему диссоциации комплексного иона: [Ag (NH3)2] + Û Ag + + 2NH3.
Константа нестойкости его запишется: 
По условию концентрация ионов серебра [Ag + ] = 1×10 — 7 моль/л, а исходная концентрация ионов серебра в растворе AgNO3 равна [Ag + ]исх. = 
[Ag (NH3)2 + ] = [Ag + ]исх. — [Ag + ] = 2×10 — 2 — 1×10 — 7 ≈ 2×10 — 2 (моль/л).
Находим равновесную концентрацию аммиака:


Т.к. часть аммиака расходуется на образование комплекса и равна удвоенной концентрации ионов серебра, то общая концентрация аммиака равна:
http://helpiks.org/3-32178.html
http://megaobuchalka.ru/2/12697.html


