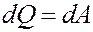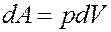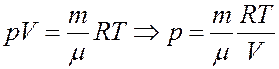Уравнение Пуассона
Определение и формула уравнения Пуассона
Уравнение Пуассона описывает адиабатический процесс, происходящий в идеальном газе. Адиабатический процесс — это процесс, в котором нет теплообмена между рассматриваемой системой и окружающей средой:
Уравнение Пуассона имеет вид:
Здесь V — объем, занимаемый газом, P — его давление, а значение k называется адиабатическим индексом.
Адиабатический индекс в уравнении Пуассона
Адиабатический индекс можно рассчитать как отношение изобарной теплоемкости газа к его изохорной теплоемкости:
В практических расчетах удобно помнить, что для идеального газа адиабатический индекс равен для двухатомного и для трехатомного .
Что относительно реальных газов, когда силы взаимодействия между молекулами начинают играть важную роль? В этом случае адиабатический индекс для каждого испытательного газа может быть получен экспериментально. Один из таких методов был предложен в 1819 году Климентом и Дезормом. Мы наполняем цилиндр холодным газом, пока давление в нем не достигнет Р1. Затем мы открываем клапан, газ начинает адиабатически расширяться, а давление в цилиндре падает до атмосферного ПА. После того, как изохорный газ нагрелся до температуры окружающей среды, давление в цилиндре повысится до P2. Тогда адиабатический индекс можно вычислить по формуле:
Адиабатический индекс всегда больше 1, поэтому при адиабатическом сжатии газа — как идеального, так и реального — температура газа всегда поднимается до меньшего объема, а при расширении газ охлаждается. Это свойство адиабатического процесса, называемого пневматическим кремнем, используется в дизельных двигателях, где горючая смесь сжимается в цилиндре и воспламеняется теплом. Напомним первый закон термодинамики: , где — внутренняя энергия системы, а А — выполненная на ней работа. Поскольку работа, выполняемая газом, идет только для изменения ее внутренней энергии — и, следовательно, температуры. Из уравнения Пуассона можно получить формулу для расчета газовой операции в адиабатическом процессе:
Здесь n — количество газа в молях, R — универсальная газовая постоянная, T — абсолютная температура газа.
Уравнение Пуассона для адиабатического процесса используется не только при расчетах двигателей внутреннего сгорания, но и при проектировании холодильных машин.
Стоит вспомнить, что уравнение Пуассона точно описывает только равновесный адиабатический процесс, состоящий из непрерывно меняющихся состояний равновесия. Если на самом деле мы открываем клапан в цилиндре так, чтобы газ расширялся адиабатически, то возникнет нестационарный переходный процесс с газовой турбулентностью, который будет испаряться из-за макроскопического трения.
Примеры решения проблем
Одноатомный идеальный газ был адиабатически сжат, так что его объем увеличился в 2 раза. Как изменится давление газа?
Адиабатический индекс для одноатомного газа равен . Однако его можно вычислить по формуле:
где R — универсальная газовая постоянная, а і — степень свободы молекулы газа. Для одноатомного газа степень свободы равна 3: это означает, что центр молекулы может выполнять поступательное движение вдоль трех координатных осей.
Поэтому адиабатический индекс:
Представьте себе состояние газа в начале и конце адиабатического процесса через уравнение Пуассона:
Давление уменьшится в 3.175 раз.
100 молей двухатомного идеального газа было адиабатически сжато при 300 К. В то же время давление газа увеличилось в 3 раза. Как изменился газ?
Степень свободы двухатомной молекулы равна i = 5, так как молекула может двигаться постепенно вдоль трех координатных осей и вращаться вокруг двух осей.
Рассчитайте диатомический адиабатический индекс:
Определите, как изменяется объем газа при адиабатическом сжатии, из уравнения Пуассона:
Это означает, что объем газа уменьшился в 2,19 раза.
Вычислите работу газа, используя следующую формулу:
Показатели адиабаты: определение и процесс
При изучении поведения газов в физике много внимания уделяется изопроцессам, то есть таким переходам между состояниями системы, во время которых сохраняется один термодинамический параметр. Тем не менее, существует газовый переход между состояниями, который не является изопроцессом, но который играет важную роль в природе и технике. Речь идет об адиабатическом процессе. В данной статье рассмотрим его подробнее, акцентируя внимание на том, что такое показатель адиабаты газа.
Адиабатический процесс

Согласно термодинамическому определению, под адиабатическим процессом понимают такой переход между начальным и конечным состояниями системы, в результате которого не существует обмена теплом между внешней средой и изучаемой системой. Такой процесс возможен при наличии следующих двух условий:
- теплопроводность между внешней средой и системой по той или иной причине является низкой;
- скорость процесса велика, поэтому обмен теплом не успевает происходить.
В технике адиабатный переход используют как для разогрева газа при его резком сжатии, так и для его охлаждения во время быстрого расширения. В природе рассматриваемый термодинамический переход проявляет себя, когда воздушная масса поднимается или опускается по склону холма. Такие подъемы и спуски приводят к изменению точки росы в воздухе и к возникновению осадков.
Уравнение Пуассона для адиабаты идеального газа

Идеальный газ представляет собой систему, в которой частицы движутся хаотично с большими скоростями, не взаимодействуют друг с другом и являются безразмерными. Такая модель является очень простой с точки зрения ее математического описания.
Согласно определению адиабатного процесса, можно записать следующее выражение в соответствии с первым законом термодинамики:
Иными словами, газ, расширяясь или сжимаясь, совершает работу P*dV за счет соответствующего изменения своей внутренней энергии dU.
В случае идеального газа, если воспользоваться уравнением его состояния (закон Клапейрона-Менделеева), то можно получить следующее выражение:
Это равенство называется уравнением Пуассона. Люди, которые знакомы с физикой газов, заметят, что если величина γ будет равна 1, то уравнение Пуассона перейдет в закон Бойля-Мариотта (изотермический процесс). Однако такое преобразование уравнений невозможно, поскольку γ для любого типа идеального газа больше единицы. Величина γ (гамма) называется показателем адиабаты идеального газа. Рассмотрим подробнее его физический смысл.
Что такое показатель адиабаты?
Показатель γ, который появляется в уравнении Пуассона для газа идеального, представляет собой отношение теплоемкости при постоянном давлении к аналогичной величине, но уже при постоянном объеме. В физике теплоемкостью называют величину теплоты, которую нужно передать данной системе или забрать у нее, чтобы она изменила свою температуру на 1 Кельвин. Будем обозначать символом CP изобарную теплоемкость, а символом CV — изохорную. Тогда для γ справедливо равенство:
Поскольку γ всегда больше одного, то он показывает, во сколько раз изобарная теплоемкость изучаемой газовой системы превышает аналогичную изохорную характеристику.
Теплоемкости CP и CV
Чтобы определить показатель адиабаты, следует хорошо понимать смысл величин CP и CV. Для этого проведем следующий мысленный эксперимент: представим, что газ находится в закрытой системе в сосуде с твердыми стенками. Если нагревать сосуд, то все сообщенное тепло в идеальном случае перейдет во внутреннюю энергию газа. В такой ситуации будет справедливо равенство:
Величина CV определяет количество теплоты, которое следует передать системе, чтобы изохорно нагреть ее на 1 К.
Теперь предположим, что газ находится в сосуде с подвижным поршнем. В процессе нагрева такой системы поршень будет перемещаться, обеспечивая поддержание постоянного давления. Поскольку энтальпия системы в таком случае будет равна произведению изобарной теплоемкости на изменение температуры, то первый закон термодинамики примет вид:
CP*dT = CV*dT + P*dV.
Отсюда видно, что CP>CV, так как в случае изобарного изменения состояний необходимо расходовать тепло не только на повышение температуры системы, а значит, и ее внутренней энергии, но и на выполнение газом работы при его расширении.
Величина γ для газа идеального одноатомного
Самой простой газовой системой является одноатомный идеальный газ. Предположим, что мы имеет 1 моль такого газа. Напомним, что в процессе изобарного нагрева 1 моль газа всего на 1 Кельвин, он совершает работу, равную величине R. Этим символом принято обозначать универсальную газовую постоянную. Она равна 8,314 Дж/(моль*К). Применяя последнее выражение в предыдущем пункте для данного случая, получаем такое равенство:
Откуда можно определить значение изохорной теплоемкости CV:
Известно, что для одного моль одноатомного газа значение изохорной теплоемкости составляет:
Из последних двух равенств следует значение показателя адиабаты:
Отметим, что величина γ зависит исключительно от внутренних свойств самого газа (от многоатомности его молекул) и не зависит от количества вещества в системе.
Зависимость γ от числа степеней свободы
Выше было записано уравнение для изохорной теплоемкости одноатомного газа. Появившийся в нем коэффициент 3/2 связан с количеством степеней свободы у одного атома. У него существует возможность двигаться только в одном из трех направлений пространства, то есть существуют только поступательные степени свободы.
Если система образована двухатомными молекулами, то к трем поступательным добавляются еще две вращательные степени. Поэтому выражение для CV приобретает вид:
Тогда значение γ будет равно:
Отметим, что на самом деле существует у двухатомной молекулы еще одна колебательная степень свободы, но при температурах в несколько сотен Кельвин она не задействуется и не вносит вклад в теплоемкость.
Если молекулы газа состоят из более, чем двух атомов, тогда у них будет 6 степеней свободы. Показатель адиабаты при этом будет равен:
Таким образом, при увеличении числа атомов в молекуле газа величина γ уменьшается. Если построить график адиабаты в осях P-V, то можно заметить, что кривая для одноатомного газа будет вести себя более резко, чем для многоатомного.
Показатель адиабаты для смеси газов
Выше мы показали, что величина γ от химического состава газовой системы не зависит. Однако она зависит от количества атомов, которое составляет ее молекулы. Предположим, что система состоит из N компонент. Атомная доля компонента i в смеси равна ai. Тогда для определения показателя адиабаты смеси можно использовать следующее выражение:
Где γi — это величина γ для i-го компонента.
Например, это выражение можно применить для определения γ воздуха. Поскольку он состоит на 99 % из двухатомных молекул кислорода и азота, то его показатель адиабаты должен быть очень близок к значению 1,4, что подтверждается при экспериментальном определении этой величины.
Первое начало термодинамики. Применение I начала термодинамики к изопроцессам. Адиабатный процесс. Уравнение Пуассона. Скорость звука в газах.
Первое начало термодинамики является обобщением закона сохранения и превращения энергии для тепловых процессов. Первое начало было установлено, после того как экспериментально была доказана взаимосвязь теплоты и работы.
Первое начало термодинамики: количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
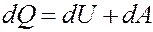
где dQ – элементарное количество теплоты, dA – элементарная работа, dU – приращение внутренней энергии.
Если dQ > 0 система получает теплоту, dQ 0 – система выполняет работу над внешними телами, dA 0, если тепловой поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
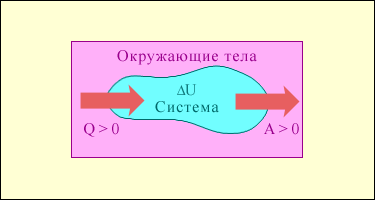 |
Рис.1. Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую.
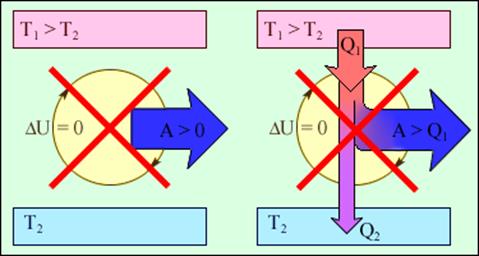
Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии (рис.2).
Рис.2. Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1.
Внутренняя энергия изолированной системы постоянная величина. Для такой системы dQ = 0, dA = 0, следовательно, dU = 0 и значит U = const.
Какие бы процессы не протекали в изолированной системе, ее внутренняя энергия остается постоянной.
Если незамкнутая система выполняет круговой процесс, т.е. в результате его система возвращается в первоначальное состояние, то dU = U2—U1 = 0, следовательно, из (1) dQ = dA. То есть вся теплота, полученная системой, идет на выполнение работы. Отсюда вытекает невозможность создания вечного двигателя первого рода.
Применим I начало термодинамики к изопроцессам.
1). Изотермический процесс: T = const.
Внутренняя энергия идеального газа определяется выражением:
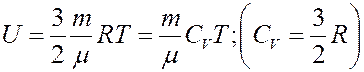
где CV – молярная теплоемкость при постоянном объеме. Определим изменение внутренней энергии.
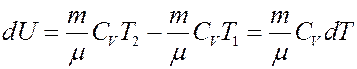
Если T = const, то dU = 0 и из I начала термодинамики получим:
Теплота, полученная системой, идет на выполнение работы над внешними телами. Определим величину этой работы (рис.3).
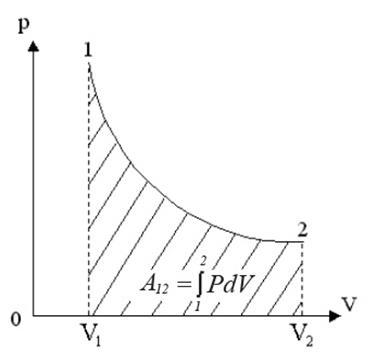
Рис.3. Работа при изотермическом процессе
Элементарная работа определяется выражением:
Из уравнения Клапейрона-Менделеева:
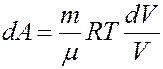
Проинтегрировав (4) найдем работу:
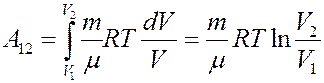
Работа численно равна площади под кривой 1 → 2. При расширении V2 > V1, и A12 > 0 система выполняет работу. При сжатии V2 V1 и A12 > 0, газ выполняет работу. При сжатии V2 T1, то Q12 > 0 газ получает тепло и его внутренняя энергия увеличивается, а если T2
| | | следующая лекция ==> | |
| Устройство пола из древесины | | | Политропический процесс. Теплоемкость. Принцип равномерного распределения энергии по степеням свободы и границы его применимости. |
Дата добавления: 2015-05-21 ; просмотров: 7354 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://1ku.ru/obrazovanie/58418-pokazateli-adiabaty-opredelenie-i-process/
http://helpiks.org/3-57186.html