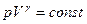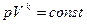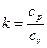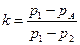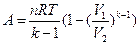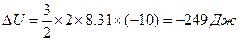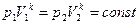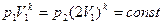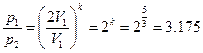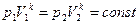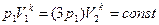Уравнение Пуассона
Определение и формула уравнения Пуассона
Уравнение Пуассона описывает адиабатический процесс, происходящий в идеальном газе. Адиабатический процесс — это процесс, в котором нет теплообмена между рассматриваемой системой и окружающей средой:
Уравнение Пуассона имеет вид:
Здесь V — объем, занимаемый газом, P — его давление, а значение k называется адиабатическим индексом.
Адиабатический индекс в уравнении Пуассона
Адиабатический индекс можно рассчитать как отношение изобарной теплоемкости газа к его изохорной теплоемкости:
В практических расчетах удобно помнить, что для идеального газа адиабатический индекс равен для двухатомного и для трехатомного .
Что относительно реальных газов, когда силы взаимодействия между молекулами начинают играть важную роль? В этом случае адиабатический индекс для каждого испытательного газа может быть получен экспериментально. Один из таких методов был предложен в 1819 году Климентом и Дезормом. Мы наполняем цилиндр холодным газом, пока давление в нем не достигнет Р1. Затем мы открываем клапан, газ начинает адиабатически расширяться, а давление в цилиндре падает до атмосферного ПА. После того, как изохорный газ нагрелся до температуры окружающей среды, давление в цилиндре повысится до P2. Тогда адиабатический индекс можно вычислить по формуле:
Адиабатический индекс всегда больше 1, поэтому при адиабатическом сжатии газа — как идеального, так и реального — температура газа всегда поднимается до меньшего объема, а при расширении газ охлаждается. Это свойство адиабатического процесса, называемого пневматическим кремнем, используется в дизельных двигателях, где горючая смесь сжимается в цилиндре и воспламеняется теплом. Напомним первый закон термодинамики: , где — внутренняя энергия системы, а А — выполненная на ней работа. Поскольку работа, выполняемая газом, идет только для изменения ее внутренней энергии — и, следовательно, температуры. Из уравнения Пуассона можно получить формулу для расчета газовой операции в адиабатическом процессе:
Здесь n — количество газа в молях, R — универсальная газовая постоянная, T — абсолютная температура газа.
Уравнение Пуассона для адиабатического процесса используется не только при расчетах двигателей внутреннего сгорания, но и при проектировании холодильных машин.
Стоит вспомнить, что уравнение Пуассона точно описывает только равновесный адиабатический процесс, состоящий из непрерывно меняющихся состояний равновесия. Если на самом деле мы открываем клапан в цилиндре так, чтобы газ расширялся адиабатически, то возникнет нестационарный переходный процесс с газовой турбулентностью, который будет испаряться из-за макроскопического трения.
Примеры решения проблем
Одноатомный идеальный газ был адиабатически сжат, так что его объем увеличился в 2 раза. Как изменится давление газа?
Адиабатический индекс для одноатомного газа равен . Однако его можно вычислить по формуле:
где R — универсальная газовая постоянная, а і — степень свободы молекулы газа. Для одноатомного газа степень свободы равна 3: это означает, что центр молекулы может выполнять поступательное движение вдоль трех координатных осей.
Поэтому адиабатический индекс:
Представьте себе состояние газа в начале и конце адиабатического процесса через уравнение Пуассона:
Давление уменьшится в 3.175 раз.
100 молей двухатомного идеального газа было адиабатически сжато при 300 К. В то же время давление газа увеличилось в 3 раза. Как изменился газ?
Степень свободы двухатомной молекулы равна i = 5, так как молекула может двигаться постепенно вдоль трех координатных осей и вращаться вокруг двух осей.
Рассчитайте диатомический адиабатический индекс:
Определите, как изменяется объем газа при адиабатическом сжатии, из уравнения Пуассона:
Это означает, что объем газа уменьшился в 2,19 раза.
Вычислите работу газа, используя следующую формулу:
Адиабатный процесс. Уравнение Пуассона
Раздел долгосрочного плана:
Раздел Основы термодинамики
Количество присутствующих: ______
Адиабатный процесс . Уравнение Пуассона.
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу)
10.3.3.2 – применять первый закон термодинамики к изопроцессам и адиабатному процессу
— применять первый закон термодинамики к адиабатному процессу ;
— применять первый закон термодинамики при решении задач
— дать определение адиабатного процесса ;
— применить первый закон термодинамики к анализу адиабатного процесса;
— применить первый закон термодинамики при решении задач .
Лексика и терминология, специфичная для предмета:
Предметная лексика и терминология:
The amount of heat
Тепло переданное системе
Жүйеге берілген жылу
Heat added to the system
Работа выполненная системой
Жүйемен жасалған жұмыс
Work done on the system
Серия полезных фраз для диалога/письма:
Теплоизолированная система – это система ….…….
Из определения адиабатного процесса можно сделать вывод, что количество теплоты получаемое или отдаваемое системой равно ………. при этом работа газа …… и его изменение внутренней энергии ….…..
Работа равна… так как …..
В течение всего урока прививать открытость, сотрудничество, уважение, толерантность в отношениях с одноклассниками через работу в парах
Привитие ценностей осуществляется посредством/через обсуждение ключевых моментов темы в группах.
Связь с математикой: работа с формулами, с графиками , физические величины и их единицы измерения.
Работа газа, изменение внутренней энергии, количество теплоты, первый закон термодинамики, графики и законы изопроцессов (предыдущие темы данного раздела).
Запланированные этапы урока
Запланированная деятельность на уроке
Учитель приветствует учащихся и предлагает поиграть.
Собрать правильно как можно быстрее обобщающую таблицу по изопроцессам.
Для учителя! Необходимо оставить целой строкой заголовки столбцов. Обобщающую таблицу с предыдущего урока разрезать на отдельные пазлы. Строки для адиабатного процесса, нужно убрать, так как эта тема ещё не изучена.
Учащиеся в парах собирают таблицу, учитель проверяет учащихся на правильность выполнения.
Учащиеся первыми справившиеся правильно с заданием, помогают учителю проверить правильность выполнения задания другими учащимися.
После игры, учитель обсуждает с ними, что в таблице были строки, относящиеся к другому процессу. Он спрашивает учащихся, помнят ли они название этого процесса. Является ли этот процесс изопроцессом?
Учитель совместно с учащимися формулирует тему урока и обсуждает цель обучения, цели урока и совместно они составляют критерии оценивания.
Далее они совместно составляют план работы.
- Ответит на проблемный вопрос !Является ли адиабатный процесс изопроцессом?», проанализировав последние две строки обобщающей таблицы.
- Сформулировать определение адиабатного процесса.
- Проверить правильность определения работая с текстом и составить опорный конспект для адиабатного процесса.
- Решить задачи с количественными и графическими данными.
Карточки на начало урока. docx
Для учителя! Чтобы не работать с большой таблицей. Ниже сделана таблица только для адиабатного процесса.
В таблице ниже описаны два типа адиабатного процесса.
Изменение внутренне энергии
Работа совершаемая системой
Система совершает механическую работу только за счет уменьшения своей внутренней энергии.
Внутренняя энергия системы увеличивается за счет работы внешних сил
(а)Определите изменяются или остаются постоянными
( i ) давление ___________________________
( ii ) объем _____________________________
( iii ) температура _______________________
( b ) Сделайте вывод, является ли адиабатный процесс изопроцессом. Поясните свой ответ
(с) ниже в строке записаны величины, входящие в первый закон термоджинамики. Подчеркните, какая из них всегда равна нулю.
Изменение внутренней энергии
Работа газа/над газом
( d ) Выделите в таблице математическую запись первого закона термодинамики для адиабатного процесса.
(е) Попробуйте сформулировать определение адиабатного процесса.
Общеклассное обсуждение задания.
Для учителя! Важно во время обсуждения обращать внимание, на основе каких ключевых фрагментов таблицы они сделали данное умозаключение.
Учитель просит оценить учащихся уровень выполнения задания. Спросив нескольких учащихся. Что у них получилось, и где они допустили ошибки.
Учитель сообщает учащимся, что важно проверить насколько правильно они дали определение адиабатного процесса, что за математическое уравнение записано втретьей строке и как адиабату отличить от изотермы.
Работа с источником
Задание. Прочитать текст.
Записать в тетрадь:
1) Определение адиабатного процесса
2) У равнение Пуассона
3) Нарисовать график адиабаты в сравнении с изотермой.
4) Записать условия, при которых реальные процессы, можно считать адиабатными.
Учащиеся индивидуально работают с текстом.
Для учителя! Информация с сайта представлена ниже, адаптирована под обозначения, используемые в школе и может быть распечатана для работы с указанием источника.
Информация с сайта:
Уравнение Пуассона описывает адиабатный процесс, протекающий в идеальном газе . Адиабатным называют такой процесс, при котором отсутствует теплообмен между рассматриваемой системой и окружающей средой Q =0
Уравнение Пуассона имеет вид:
Здесь V – объем, занимаемый газом, p – его давление , а k (γ) –величина, которая называется показателем адиабаты.
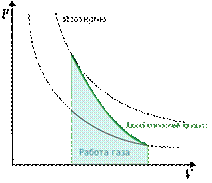
График адиабатного процесса:
 |
Показатель адиабаты в уравнении Пуассона
Показатель адиабаты можно рассчитать, как отношение изобарной теплоемкости газа к его изохорной теплоемкости:
В практических расчётах удобно помнить, что для идеального газа показатель адиабаты равен 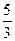
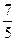
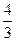
Как же быть с реальными газами, когда важную роль начинают играть силы взаимодействия между молекулами? В этом случае показатель адиабаты для каждого исследуемого газа можно получить экспериментально. Один из таких методов был предложен в 1819 году Клеманом и Дезормом. Мы наполняем баллон холодным газом, пока давление в нём не достигнет 


Показатель адиабаты всегда больше 1, поэтому при адиабатическом сжатии газа – как идеального, так и реального – до меньшего объема температура газа всегда возрастает, а при расширении газ охлаждается. Это свойство адиабатического процесса, называемое пневматическим огнивом, применяется в дизельных двигателях, где горючая смесь сжимается в цилиндре и воспламеняется от высокой температуры. Вспомним первый закон термодинамики: Q =Δ U + A , где Δ U — внутренняя энергия системы , а А – выполняемая над ней работа. Поскольку Q =0, то работа, осуществляемая газом, идёт только на изменение его внутренней энергии – а значит, температуры. Из уравнения Пуассона можно получить формулу для расчёта работы газа в адиабатном процессе:
Здесь n – количество газа в молях, R – универсальная газовая постоянная, Т – абсолютная температура газа.
Уравнение Пуассона для адиабатического процесса применяется не только при расчётах двигателей внутреннего сгорания, но и в проектировании холодильных машин.
Стоит помнить, что уравнение Пуассона точно описывает только равновесный адиабатный процесс, состоящий из непрерывно сменяющих друг друга состояний равновесия. Если же мы в реальности откроем кран в баллоне, чтобы газ адиабатически расширился, возникнет нестационарный переходной процесс с завихрениями газа, которые затухнут из-за макроскопического трения.
Реальный процесс можно считать адиабатный, если он протекает очень быстро и не успевает осуществиться теплообмен с окружающей средой.
Обсуждение работы с текстом.
Учитель делает необходимые уточнения в зависимости от уровня понимания темы учащимися.
1.На рисунке ниже, показаны графики двух процессов адиабатного и изотермического. Подпишите на рисунке название каждого процесса.
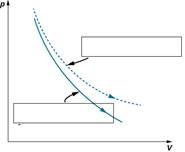 |
2. При адиабатическом сжатии газа была совершена работа 200Дж. Как и насколько изменилась при этом внутренняя энергия газа?
Объяснение: согласно первому закону термодинамики работа ,совершенная над газом равна изменению внутренней энергии, следовательно внутренняя энергия увеличится на 200Дж.
Ответ: увеличится на 200 Дж
3. В процессе адиабатического расширения газ совершил работу равную 3·10 3 Дж. Чему равно изменение внутренней энергии газа?
Объяснение: согласно первому закону термодинамики газ совершает работу за счет внутренней энергии, тогда внутренняя энергия уменьшится на 3·10 3 Дж.
Ответ: уменьшится на 3·10 3 Дж
- Одноатомный идеальный газ, взятый в количестве двух молей, расширился без теплообмена с окружающей средой. Температура газа в ходе расширения уменьшилась на 10 о С. Определить работу, совершённую газом. (249Дж)
Поскольку известно, что газ одноатомный, количество вещества и изменение внутренней энергии можно рассчитать по формуле
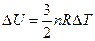
Поскольку работа совершается за счет изменения внутренней энергии то она равна 249 Дж.
5. Одноатомный идеальный газ адиабатически сжали так, что его объем увеличился в 2 раза. Как изменится давление газа?
Представим состояние газа в начале и конце адиабатного процесса через уравнение Пуассона:
Учтем изменение объема
Выразим отношение давлений
6. 100 молей двухатомного идеального газа адиабатически сжали при температуре 300 К. При этом давление газа увеличилось в 3 раза. Какую работу совершили внешние силы над газом?
Определим, как изменится объем газа при адиабатном сжатии, из уравнения Пуассона
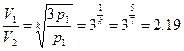
Адиабатный процесс. Изопроцессы в термодинамике
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На этом уроке мы будем работать с уже известными нам физическими понятиями, но в несколько иной области применения. А именно с изопроцессами в термодинамике. Мы рассмотрим, какие изменения в первый закон термодинамики (закон сохранения энергии в тепловых процессах) внесут протекания этих самых процессов при неизменном макроскопическом параметре газа. Также мы рассмотрим новый, ранее неизвестный процесс – адиабатный.
http://znanio.ru/media/adiabatnyj-protsess-uravnenie-puassona-2576744
http://interneturok.ru/lesson/physics/10-klass/osnovy-termodinamiki/adiabatnyy-protsess-izoprotsessy-v-termodinamike