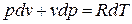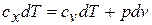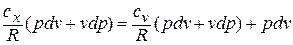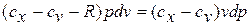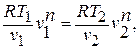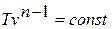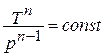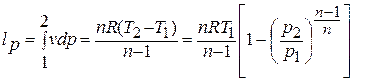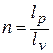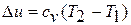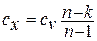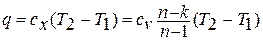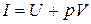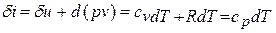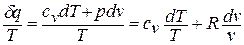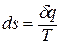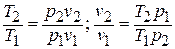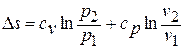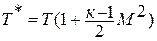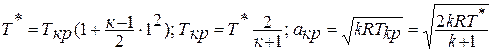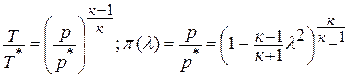Уравнение политропного процесса.
Продифференцируем уравнение состояния для 1 кг идеального газа:
Принимая теплоемкость не зависящей от температуры, получим уравнение первого закона термодинамики в дифференциальной форме:
Подставляя в это уравнение выражение для 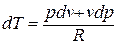
Разделяя переменные и произведя интегрирование, получаем
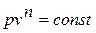
где 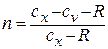
Зависимость между температурой и удельным объёмом определяется путём замены давления в уравнении политропного процесса его значением из уравнения состояния идеального газа:
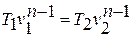
Исключая подобным же образом удельный объём, находим зависимость между давлением и температурой:

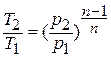
Деформационная работа, производимая 1 кг газа в политропном процессе, определяется по формуле:
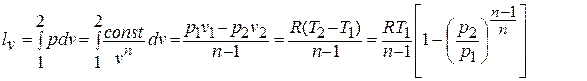
То есть отношение технической и деформационной работ равно показателю политропы:
Изменение внутренней энергии в политропном процессе находится общей формулой:
Теплоёмкость процесса 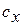
Количество теплоты в политропном процессе находится по формуле:
1.12. Энтальпия рабочего тела.
В термодинамике важную роль играет сумма внутренней энергии системы 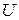
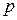
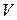
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния.
Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности . Величина
называемая удельной энтальпией ( 
Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния:
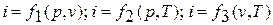
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Физический смысл энтальпии выясним на следующем примере. Рассмотрим расширенную систему, включающую газ в цилиндре и поршень с грузом общим весом G (рис.1.7). Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: 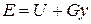
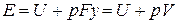

Уравнение 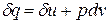
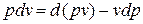
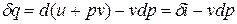
Рис.1.10. К определению физического смысла энтальпии
Из этого соотношения следует, что если давление термодинамической системы сохраняется неизменным, то есть осуществляется изобарный процесс (dp = 0), то 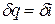
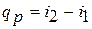
Это выражение очень часто используется в расчетах, так как огромное
количество процессов подвода теплоты в теплоэнергетике (в паровых котлах, камерах сгорания газовых турбореактивных двигателей, теплообменных аппаратах), а также целый ряд процессов химической технологии и многих других производствах осуществляется при постоянном давлении. Кстати, по этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, a не внутренней энергии.
Для идеального газа для вычисления энтальпии используется формула
Так как между энтальпией и внутренней энергией существует связь, выбор начала отсчета одной из них произволен: в точке, принятой за начало отсчета внутренней энергии, 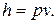

р = 610,8 Па, 
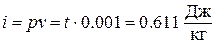
При расчетах практический интерес представляет изменение энтальпии в конечном процессе:
1.13. Энтропия рабочего тела.
Как уже указывалось, величина 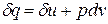
В математике доказывается, что дифференциальный двучлен всегда можно превратить в полный дифференциал путем умножения (или деления) на интегрирующий множитель (или делитель). Таким интегрирующим делителем для элементарного количества теплоты 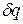
Покажем это на примере изменения состояния идеального газа в равновесных процессах:
Выражение 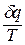
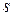
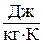
Для произвольного количества газа энтропия, обозначаемая через 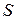
равна 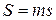
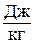
Таким образом, аналитически энтропия определяется следующим образом:
Эта формула справедлива как для идеальных, так и для реальных газов.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
Понятием «энтропия» (от греч. Entropia – поворот, превращение) будем называть в термодинамике направление теплообмена между рабочим телом термодинамической системы и внешней средой.
Значение энтропии для заданного состояния газа определяется интегрированием уравнения для энтропии:
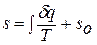

При температурах, близких к абсолютному нулю, все известные газы находятся в конденсированном состоянии. Вальтер Нернст (1864 – 1941), немецкий физик и химик, в 1906 году экспериментально установил, а Макс Планк (1858 – 1947), немецкий физик, в 1912 году окончательно сформулировал следующий принцип:
при температуре, стремящейся к абсолютному нулю, энтропия газа, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю,то есть 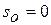
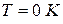
Этот закон называют третьим законом термодинамикиили тепловой теоремой В.Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
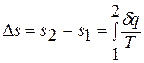
поэтому энтропию тоже отсчитывают от произвольно выбранного уровня.
Получим формулы, позволяющие вычислить изменение энтропии идеального газа. Для этого проинтегрируем уравнение для энтропии, полагая 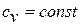
Имея в виду уравнение состояния, записанное для состояний «1» и «2», получаем:
После подстановки отношений 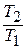
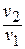
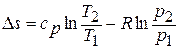
Поскольку энтропия есть функция состояния рабочего тела, написанными уравнениями можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями «1» и «2» и, в частности, от того, равновесный этот переход или нет.
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов 
на 
Из уравнения для изменения энтропии следует, что в равновесном процессе: 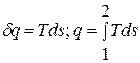

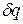
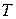
Рис.1.11. Графическое изображение теплоты в 
линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Формула для элементарного изменения энтропии показывает, что 
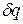
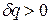
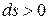

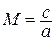
Данное отношение названо в честь Эрнста Маха (1838 – 1916), австрийского физика и философа; отношение является критерием( от греч. Kriterion – средство для суждения) – признаком, на основании которого производится оценка, определение или классификация чего — либо; мерило оценки; в данном случае критерий сжимаемости газа. Формула 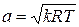
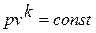
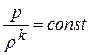
Дифференциальное уравнение этого процесса представляется так 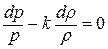
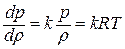
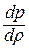
Отсюда выражение для полной энергии потока в сечении записывается так:
Число Маха, таким образом, является характеристикой сжимаемости рабочего тела. Например, при 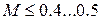
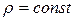
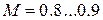
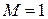

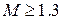
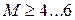
Принимая 
Если формулу для полной энергии потока разделить на 
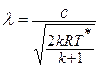
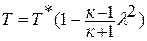
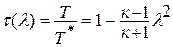
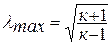
Если принять процесс торможения потока от температуры 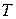
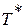
или плотности 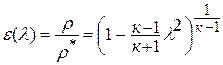
Уравнение сохранения энергии широко используется в авиационной практике для различных элементов двигателей. Например:
а) работа , подводимая к валу ротора компрессора 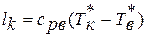
Политропный процесс | 20+ важных часто задаваемых вопросов и числовых значений
Content
Политропный процесс
Определение политропный процесс
Политропное уравнение | Политропное уравнение состояния
Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Это метод постоянной удельной теплоемкости, при котором учитывается поглощение тепла газом из-за повышения температуры на единицу.
Политропный индекс
- п nd закон термодинамики. Эти частные случаи используются в тепловом взаимодействии для астрофизики и химической энергии.
- п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
- n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
- 1 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
- γ st закон термодинамики,
Политропный против изэнтропического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Изэнтропический процесс, также известный как обратимый адиабатический процесс, представляет собой идеальный процесс, в котором не происходит передача энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу. Т.к. теплопередача равна нулю. дQ = 0
Согласно первому закону термодинамики,
Политропный процесс против адиабатического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Адиабатический процесс — это особое и специфическое состояние политропного процесса, при котором.
Подобно изэнтропическому процессу, в этом процессе также не происходит передачи энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу.
Политропная эффективность
«Политропический КПД, точно определяемый как отношение идеальной работы сжатия для изменения перепада давления в многоступенчатом компрессоре к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре».
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
Политропная голова
Политропный напор можно определить как напор, создаваемый центробежным компрессором при политропном сжатии газа или воздуха. Величина развиваемого давления зависит от плотности сжатого газа, и это зависит от изменения плотности газа.
γ = индекс адиабаты
zсредний = Средний коэффициент сжимаемости
η = политропная эффективность
Pd = Давление нагнетания
Ps = Давление всасывания
S = удельный вес газа
Ts = Температура всасывания
Политропный процесс для воздуха | Политропный процесс для идеального газа
Считается, что воздух является идеальным газом, и поэтому законы идеального газа применимы к воздуху.
………………………. Соотношение между давлением [P] и объемом [V]
………………………. Связь между объемом [В] и температурой [Т]
………………………. Связь между давлением [P] и температурой [T]
Примеры политропных процессов
1. Рассмотрим политропный процесс с индексом политропы. п = (1.1). Начальные условия: P1 = 0, В1 = 0 и заканчивается на P2= 600 кПа, В2 = 0.01 м 3 . Оцените проделанную работу и теплоотдачу.
Ответ: Работы, выполненные политропным процессом, предоставлены
Теплопередача определяется выражением
2. Поршневой цилиндр содержит кислород при 200 кПа объемом 0.1 м. 3 и при 200 ° С. Масса добавляется так, чтобы газ сжимался с PV. 1.2 = постоянная до конечной температуры 400 ° C. Подсчитайте проделанную работу.
Ответ: Выполненная политропная работа определяется
3. Рассмотрим аргон при 600 кПа, 30 ° C, сжатый до 90 ° C в политропном процессе с n = 1.33. Найдите проделанную работу на Газе.
Ответ: Выполненная политропная работа определяется
для аргона при 30 ° C составляет 208.1 Дж / кг. K
Принимая m = 1 кг
4. Предположим, что масса 10 кг ксенона хранится в баллоне при 500 К, 2 МПа, расширение представляет собой политропный процесс (n = 1.28) с конечным давлением 100 кПа. Посчитайте проделанную работу. Учтите, что система имеет постоянную удельную теплоемкость.
Ответ: Выполненная политропная работа определяется
для ксенона при 30 ° C — 63.33 Дж / кг. K
Принимая m = 10 кг
5. Рассмотрим цилиндр-поршень с начальным объемом 0.3, содержащий 5 кг газообразного метана при давлении 200 кПа. Газ сжимают политропно (n = 1.32) до давления 1 МПа и объема 0.005. Рассчитайте теплопередачу во время процесса.
Ответ: Политропная теплопередача определяется
6. Примите во внимание цилиндр-поршень, содержащий 1 кг метана при 500 кПа, 20 ° C. Газ политропно сжимают до давления 800 кПа. Рассчитайте теплопередачу с показателем n = 1.15.
Ответ: Политропная теплопередача определяется
Мы знаем, что R для метана = 518.2 Дж / кг. K
7. 1 кг гелия хранится в системе поршень-цилиндр при 303 К, 200 кПа сжимается до 400 К в обратимом политропном процессе с показателем степени n = 1.24. Гелий является идеальным газом, поэтому удельная теплоемкость будет фиксированной. Найдите работу и теплопередачу.
Ответ: Выполненная политропная работа определяется
R для гелия составляет 2077.1 Дж / кг.
Политропная теплопередача определяется выражением
8. Предположите, что воздух хранится в баллоне объемом 0.3 литра при 3 МПа, 2000 К. Воздух расширяется в соответствии с обратимым политропным процессом с показателем степени n = 1.7, объемное соотношение в этом случае составляет 8: 1. Рассчитайте политропную работу для процесса и сравните ее с адиабатической работой, если процесс расширения следует за обратимым адиабатическим расширением.
Ответ: Нам дается
Соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
Проделанная адиабатическая работа определяется выражением
Для процесса расширения Работа, выполняемая посредством обратимого адиабатического процесса, больше, чем Работа, выполняемая посредством обратимого политропного процесса.
9. В закрытом контейнере содержится 200 л газа при 35 ° C, 120 кПа. Газ сжимается в политропном процессе до температуры 200 ° C, 800 кПа. Найти политропную работу, совершаемую воздухом для n = 1.29.
Ответ: соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
10. Масса 12 кг газообразного метана при 150 ° C, 700 кПа подвергается политропному расширению с n = 1.1 до конечной температуры 30 ° C. Найти теплопередачу?
Ответ: Мы знаем, что R для метана = 518.2 Дж / кг. K
Политропная теплопередача определяется выражением
11. Узел цилиндр-поршень содержит R-134a при 10 ° C; объем 5 литров. Охлаждающая жидкость сжимается до 100 ° C, 3 МПа в соответствии с обратимым политропным процессом. рассчитать проделанную работу и теплоотдачу?
Ответ: Мы знаем, что R для R-134a = 81.49 Дж / кг. K
Выполненная политропная работа определяется выражением
Политропная теплопередача определяется выражением
12. Является ли политропный процесс изотермическим по своей природе?
Ответ: Когда n становится 1 для политропного процесса: согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
13. Обратим ли политропный процесс?
Ответ: политропные процессы внутренне обратимы. Вот несколько примеров:
п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV γ = C представляет собой постоянную температуру или изотермический процесс.
п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
n = Бесконечность: Представляет собой изохорный процесс или процесс постоянного объема.
14. Адиабатический политропный процесс?
Ответ: когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
14. Что такое политропная эффективность?
Ответ: Политропический КПД можно определить как отношение идеальной работы сжатия к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре. Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
15. Что такое гамма в политропном процессе?
Ответ: В политропном процессе, когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
16. что такое политропный процесс?
Ответ: Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Его также называют процессом с постоянной удельной теплотой, при котором тепло, поглощаемое газом, учитываемое из-за повышения температуры на единицу, является постоянным.
17. Какие выводы можно сделать для политропного процесса с n = 1?
Ответ: когда п = 1: PV n = C : Согласно предположению об идеальном газе, закон становится PV = C представляет собой постоянную температуру или изотермический процесс.
18. Что такое неполитропный процесс?
Ответ: Политропный процесс можно определить уравнением PV n = C показатель степени n называется индексом политропы. Когда,
- п 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа PV γ = C представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
- γn0). Как и в циклах сжатия пара, тепло теряется в горячее окружение. Изменение температуры происходит из-за изменения внутренней энергии, а не подводимого тепла. Произведенная работа превышает количество поданного или добавленного тепла. Таким образом, даже если при политропном расширении добавляется тепло, температура газа снижается.
21. В политропном процессе, когда PV n = константа, температура тоже постоянна?
Ответ: В политропном процессе, когда PV n = постоянная, температура остается постоянной только при показателе политропы n = 1. Для n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
Политропный процесс
Политропный процесс
- Обычно фактический процесс работы теплового двигателя происходит при наличии теплообмена, р, в, Т изменений. То есть он не является теплоизолирующим, изобарическим, изобарическим или изотермическим. Для расчета такого процесса соотношение между давлением и объемом обычно выражается уравнениями вида ФВ plvlj p1v Конст. 5. 37. Процесс в соответствии с этим уравнением называется. Политолог. Показатель степени уравнения p НИИ называется политропным indicator. В некоторых процессах величина n постоянна, но в разных процессах политропный показатель может принимать любое число.
Для идеального газа по уравнению pv-rt можно найти уравнение политропного процесса, соединив параметры t, t и t, p. Для этого нужно заменить давление или объем в уравнении 5. 37 соответственно и выразить их с помощью уравнения Клапейрона. После преобразования получены следующие уравнения политропного процесса tv — — t — t2v — const 5. 38 5. 39 ТП т п t2p2. Уравнение 5. 37 5. 38 5. 39 поэтому связь между параметрами в начале и конце политропного процесса может быть легко получена. −1 5.
Поскольку уравнение (16-7) должно быть справедливо также и для воздуха, то одновременно с потоком частиц пара должен существовать и поток частиц воздуха, но в обратном направлении. Людмила Фирмаль
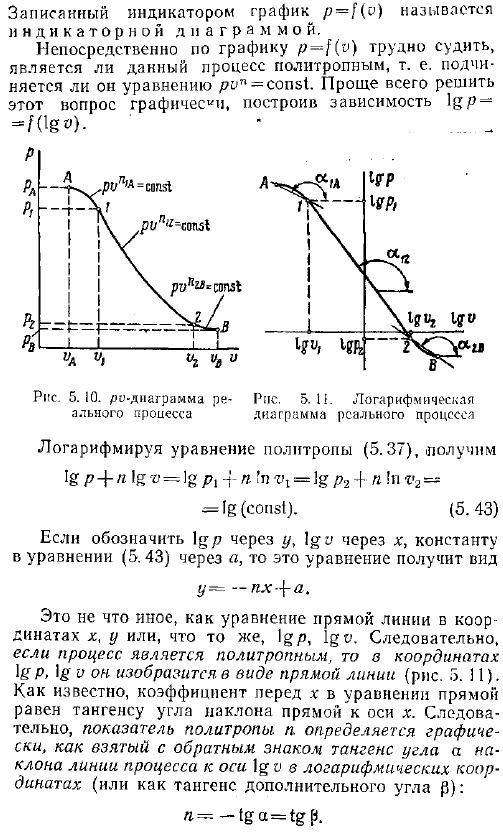
Сорок два. При изучении фактического процесса необходимо установить, является ли процесс политропой, и определить значение индекса политропы. Обычно при изучении работы тепловых машин двигателей, компрессоров и др. , давление и объем рабочей жидкости измеряются в процессе расширения и сжатия. По результатам таких измерений можно построить зависимость p f v рис. 5. 10.
При исследовании работы поршневой машины двигателя внутреннего сгорания, компрессора и др. , такой график рисуют приборы так называемые индикаторы, которые автоматически измеряют изменения давления и объема. Графика р о описывается индикатор называется индикаторной диаграммы. Из графика p-f v трудно непосредственно определить, является ли этот процесс политропой, то есть следует уравнению pon const. Проще всего решить эту проблему графически, построив зависимость lg fog —. — Логарифм уравнения политропа 5. 37, ig p 4-n log-o g pi-i- to r 1 ig p2 4-n in v2— ИГ константа. 5. 43 Если igp обозначается через y, а igo-через x, а константа уравнения 5.
Через a, то это уравнение принимает вид В j -зл-Н. Это то же самое, что и линейные уравнения координат x, y или igp, lgv. So, если процесс представляет собой политропу, то она рисуется в виде прямой линии, с координатами igp, ig рис. 5. 11. Как известно, коэффициент x в уравнении прямой линии равен касательной наклона линии к оси x-axis. As в результате политропный индекс n определяется как тангенс угла a от противоположного знака в логарифмических координатах и как наклон технологической линии к оси МПО или как тангенс дополнительного угла Как будет определено. Обратите внимание, что не все процессы являются политропами.
Например, вы можете видеть, что только процесс at 5. 11, раздел 1-2 процесса at2b, можно считать политропой с равными показателями. Л12 — tga12. Если в координатах лгп фактический процесс МПО не представлен прямой линией, то он разбивается на короткие отрезки, в которых линия практически заменяется прямой segment. In примерный рисунок, раздел 5. 11, al n 2b, также можно считать политропой с индексами n, равными n a — tg u1a и 2b — tg g2b. — Если известно, что процесс является политропным, то значение показателя n можно определить по формуле 2 из значения параметра газа в любой точке этого процесса 5. 43.
Выражает давление по объему из Формулы 3. 2, формулы 5. 37. Эта формула такая же по форме, как и соответствующая формула для процесса термоизоляции, отличающаяся только обозначением индекса теплопроводности. Volume. So, в результате интегрирования вы получите формулу, аналогичную форме 5. Сорок семь Из уравнения состояния pioi этих выражений можно заменить на rt. Выполнив такую замену в выражении 5.
- Мы получим другое выражение, для которого работает политропный процесс. 4 — Г2. 5. 48. Теплотворная способность политропного процесса определяется по следующей формуле 5. 49 Вот, Джей Кг-град — это теплоемкость газа в политропном процессе, то есть процессе, в котором n является постоянной величиной. Теплоемкость газа политропного процесса определяется по общей формуле 4. 3. Для этого необходимо подставить отношение изменения объема к изменению температуры в политропном процессе. Эта зависимость получается путем дифференцирования уравнения 5. 41 политропного процесса переменной Г, о. После логарифма формулы 5.
Отсюда л-т л-1. Подставляя это выражение в выражение 4. 3, вы получаете Если привести их к общему знаменателю с круглыми скобками, то получится формула для теплоемкости газа в политропном процессе. Из этой формулы видно, что было решено учитывать удельную теплоту независимо от температуры удельная теплота идеального газа в политропном процессе будет постоянной. В отличие от теплоемкости cp и c, теплоемкость газа в политропном процессе может быть отрицательной. Это тот случай, когда значение индекса политропа n больше 1 и меньше k, то есть k n.
Так как массосодержание водяного пара иц и воздуха составляют в сумме единицу, градиент массосодержания пара соответствует градиенту маососодержания воздуха. Людмила Фирмаль
Отрицательная теплоемкость означает, что, несмотря на подвод тепла к газу, температура снижается, а при отводе тепла, наоборот, он становится горячим. Это, казалось бы, аномальное поведение температуры объясняется тем, что политропный процесс 1 l, а следовательно, cn 0, получается сильным расширением с небольшим запасом heat. In кроме того, это ln qn, и изменение внутренней энергии отрицательно. Л Несмотря на то, что тепло подается 1 0, когда внутренняя энергия газа уменьшается, температура уменьшается.
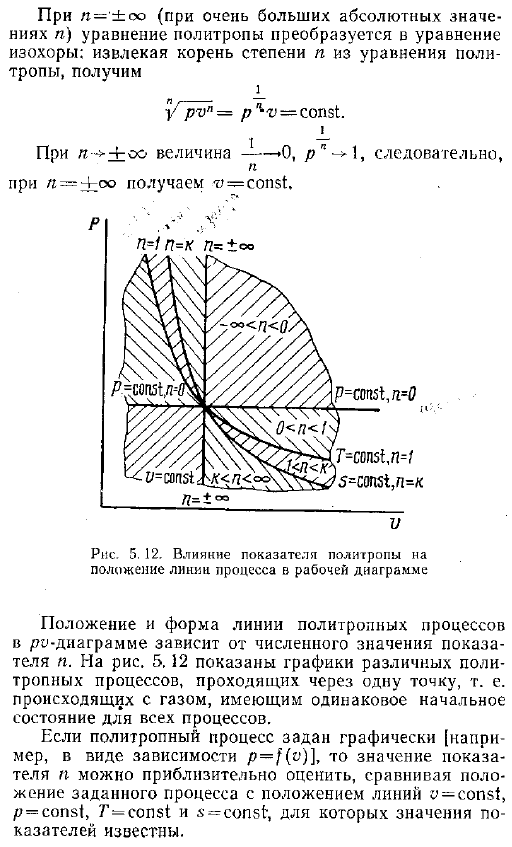
В процессе сжатия, если из рабочего тела удаляется меньше тепла, чем выполняется работа, то есть и В случае n избыточная энергия — qn увеличивает внутреннюю энергию газа, и температура повышается. Тепло удаляется н 0. Подставляя давление, выраженное в объеме по уравнению 3. 14 5. 37, показано, что работа газа, имеющаяся в политропном процессе, в n раз больше работы расширения в этом процессе, как это было сделано в адиабатическом процессе 5. 51 Рассмотренные ранее процессы изометрический, изобарный, изотермический, адиабатический-это частный случай политропного процесса. Каждое уравнение может быть представлено в виде swarm const со своим значением индикатора.
Фактически, в n-0 уравнение политропа принимает следующий вид pr 0 p-1 const или p const изобарный процесс. Если l 1, то политропное уравнение представляет собой изотермический процесс. Рv const и если l a, то политропы соответствуют адиабату. Роль const. В случае n- co где абсолютное значение n очень велико политропное уравнение преобразуется в однородное уравнение. Извлечение корней Порядка n из политропного уравнения дает ПВН Р v пост. Для n — oo значение равно −0 например — — — Лоо, вы получите.
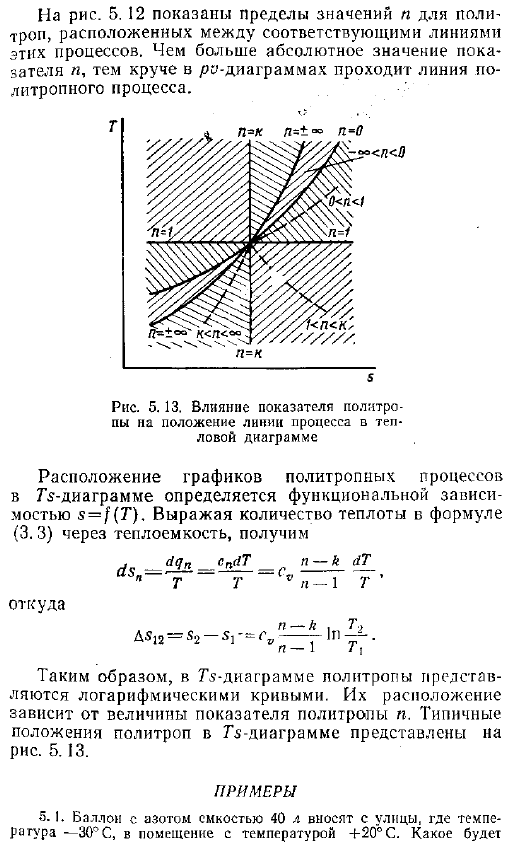
Процесс работы диаграммы расположение и форма линии RO-диаграммы политропного процесса зависит от порядкового номера изделия .На рисунке 5 .12 показан график различных политропных процессов, проходящих через 1 точку .То есть все процессы протекают в одном и том же начальном состоянии газа .Если политропный процесс задан графически например, в виде зависимости p f o, то значение показателя N аппроксимируется путем сравнения положения данного процесса с положениями линий y const, p const, T const и s const .Значение индикатора известно .На рисунке 5 .12 показано ограничение на значение N в политропы между соответствующими линиями этих процессов .Чем выше абсолютное значение показателя, тем круче линия политропного процесса .Рис .
Влияние индекса политропа на расположение технологической линии на диаграмме горячей проволоки Положение графика политропного процесса на диаграмме G определяется зависимостью функции s T .Если величина теплоты уравнения 3 .3 выражается в терминах удельной теплоты, то она выглядит следующим образом Откуда AS12 С2-с — сі, — г п г — Таким образом, в схеме ТС, политроп представлены логарифмические кривые .Их расположение зависит от величины политропного показателя n .на рисунке показано типичное положение политроп на диаграмме G .5 .13 .Пример 5 .1 .Возьмите баллон с емкостью 40 литров азота с улицы, где температура составляет −3 C, в помещение с температурой 20 C .Давление в баке и температура азота равны давлению в баке 98 dir Тепло, и равное cv 742 Дж Кг-град .Решение .О нагревании шара .- Меняйся, Трейс .— 297 Дж кг град- 2 .7 найти 9810S-0 .04 М ря, 7а-Д 5 .45-742 .10-1 293-243 −202 кДж .




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://ru.lambdageeks.com/polytropic-process/
http://lfirmal.com/politropnyj-process/