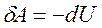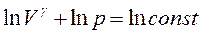Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Первый закон термодинамики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
Газ, находящийся в сосуде под поршнем, действует на поршень с силой , где — давление газа, — площадь поршня. Если при этом поршень перемещается, то газ совершает работу.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
Работа газа в изобарном процессе
Предположим, что газ расширяется при постоянном давлении . Тогда сила , с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние (рис. 1 ).
Работа газа равна:
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
Если и — начальный и конечный объём газа, то для работы газа имеем: . Изобразив данный процесс на -диаграмме, мы видим, что работа газа равна площади прямоугольника под графиком нашего процесса (рис. 2 ).
Рис. 2. Работа газа как площадь
Пусть теперь газ изобарно сжимается от объёма до объёма . С помощью аналогичных рассуждений приходим к формуле:
Но , и снова получается формула (1) .
Работа газа опять-таки будет равна площади под графиком процесса на -диаграмме, но теперь со знаком минус.
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
Работа газа в произвольном процессе
Геометрическая интерпретация работы газа (как площади под графиком процесса на -диаграмме) сохраняется и в общем случае неизобарного процесса.
Действительно, рассмотрим малое изменение объёма газа — настолько малое, что давление будет оставаться приблизительно постоянным. Газ совершит малую работу . Тогда работа газа во всём процессе найдётся суммированием этих малых работ:
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3 ):
Рис. 3. Работа газа как площадь
Работа, совершаемая над газом
Наряду с работой , которую совершает газ по передвижению поршня, рассматривают также работу , которую поршень совершает над газом.
Если газ действует на поршень с силой , то по третьему закону Ньютона поршень действует на газ с силой , равной силе по модулю и противоположной по направлению: (рис. 4 ).
Рис. 4. Внешняя сила , действующая на газ
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Так, в процессе расширения газ совершает положительную работу 0 \right )’ alt=’\left ( A> 0 \right )’ /> ; при этом работа, совершаемая над газом, отрицательна . Наоборот, при сжатии работа газа отрицательна , а работа, совершаемая поршнем над газом, положительна 0 \right )’ alt=’\left ( ‘ > 0 \right )’ /> .
Будьте внимательны: если в задаче просят найти работу, совершённую над газом, то имеется в виду работа .
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Опыт показывает, что эти способы независимы — в том смысле, что их результаты складываются. Если телу в процессе теплообмена передано количество теплоты , и если в то же время над телом совершена работа , то изменение внутренней энергии тела будет равно:
Нас больше всего интересует случай, когда тело является газом. Тогда (где , как всегда, есть работа самого газа). Формула (2) принимает вид: , или
Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
1. Изотермический процесс, .
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: . Тогда формула (3) даёт:
Всё подведённое к газу тепло идёт на совершение газом работы.
2. Изохорный процесс, .
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: . Тогда первый закон термодинамики даёт:
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
3. Изобарный процесс, .
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы (для которой справедлива формула (1) ). Имеем:
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе . Из первого закона термодинамики получаем: , или .
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет , поэтому 0′ alt=’\Delta U > 0′ /> : газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
Кривая, изображающая ход адиабатного процесса, называется адиабатой. Интересно сравнить ход адиабаты и изотермы на -диаграмме (рис. 5 ).
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
РАБОТА ПРИ ИЗОПРОЦЕССАХ
Изопроцессы – это равновесные процессы, происходящие с термодинамическими системами, при которых один из основных параметров состояния сохраняется постоянным.
7.1. Изохорный процесс (V = const)
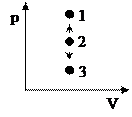  | Диаграмма этого процесса — изохора— в координатах (p,V) изображается прямой, параллельной оси ординат (ось p). Процесс 2-1 — изохорный нагрев, процесс 2-3 — изохорное охлаждение. 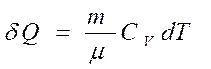 При изохорном процессе газ не совершает работу над внешними телами (δΑ = pdV = 0) и вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии (δQ = dU). Поскольку dUμ = Cv·dT, то для произвольной массы газа: При изохорном процессе газ не совершает работу над внешними телами (δΑ = pdV = 0) и вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии (δQ = dU). Поскольку dUμ = Cv·dT, то для произвольной массы газа: |
7.2. Изобарный процесс (р = const)
  | Диаграмма этого процесса — изобара— в координатах (p,V) изображается прямой параллельной оси абсцисс (ось V). При изобарном процессе работа газа при увеличении объема от Vl до V2 равна: 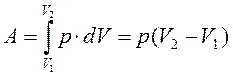 и определяется площадью заштрихованного прямоугольника. и определяется площадью заштрихованного прямоугольника. |
Используя уравнение Менделеева-Клайперона
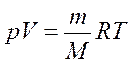
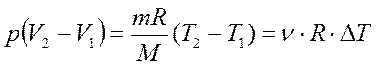
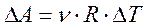
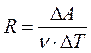
Физический смысл универсальной газовой постоянной R:
R численно равна работе изобарного расширения 1моля идеального газа при нагревании его на 1 К.
7.3. Изотермический процесс (Т = const)
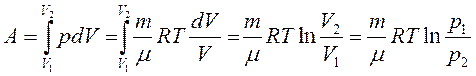  | Диаграмма этого процесса — изотерма — в координатах (p,V) представляет собой гиперболу. Изотермический процесс описывается законом Бойля-Мариотта (pV = const). Работа изотермического расширения газа: |
Так как при T = constвнутренняя энергия идеального газа не изменяется, то из первого начала термодинамики следует, что δQ = δA,то есть все количество теплоты, сообщаемое газу, расходуетсяна совершение имработы против внешних сил.
Поэтому, для того, чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
8. Адиабатический процесс (δQ = 0).
Адиабатическим называется процесс, при котором отсутствует теплообмен между системой и окружающей средой (δQ = 0).
К адиабатическим процессам можно отнести все быстропротекающие процессы (теплообмен не успевает совершиться), например, распространение звука в среде, циклы расширения и сжатия в двигателях внутреннего сгорания, в холодильных установках и т. д.
Из первого начала термодинамики следует, что при адиабатическом процессе
Используя 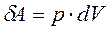
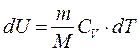
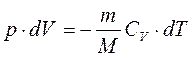
C другой стороны, из 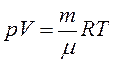
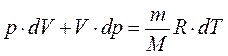
Разделив (2) на (1) получим:
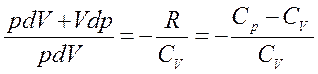
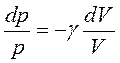
где 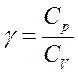
Откуда следует уравнение Пуассона – уравнение адиабатического процесса:
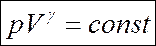 |
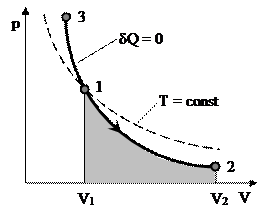
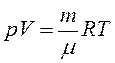
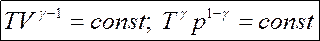 |
Диаграмма адиабатического процесса – адиабата — в координатах (p,V) изображается гиперболой.
Адиабата (pV γ = const) более крута, чем изотерма (pV = const). Это объясняется тем, что при адиабатическом сжатии (1 – 3) увеличение давления газа обусловлено не только уменьшением его объема, но и повышением температуры.
9. Работа газа в адиабатическом процессе
В адиабатическом процессе 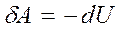
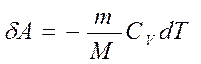
Если газ адиабатически расширяется от объема V1 до V2 , то его температура уменьшается от Т1 до Т2 и работа расширения идеального газа:
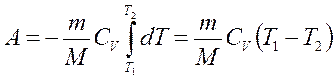
Откуда получаем, используя уравнение Менделеева-Клапейрона 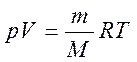
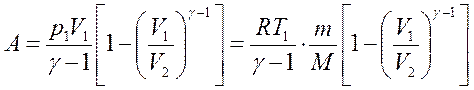
Работа адиабатического расширения 1-2 (заштрихованная площадь) меньше, чем при изотермическом процессе. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом расширении температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
10. Политропические процессы (С = const)
Процесс, в котором теплоемкость остается постоянной (С = const)называется политропическим.
Рассмотренные выше изохорный, изотермический, изобарный и адиабатический процессы — это частные случаи политропного процесса.
Уравнение политропы : pV n = const
где коэффициент 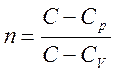
Значения теплоемкости и показателя политропы для разных процессов приведены в таблице:
| Процесс | С | n |
| Адиабатический | С = 0 | n = γ |
| Изотермический | С = ∞ | n = 1 |
| Изобарический | С = Ср | n = 0 |
| Изохорный | С = СV | n = ± ∞ |
Теплоемкость при изотермическом процессе бесконечно велика, поскольку температура не изменяется (dT = 0) при подводе тепла (δQ ≠ 0).
Теплоемкость при адиабатическом процессе равна нулю, поскольку нет подвода тепла (δQ = 0), хотя температура изменяется (dT ≠ 0).
11. Круговой процесс (цикл)
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние.
На (p,V)-диаграмме цикл изображается замкнутой кривой, где участок 1-2 соответствует расширению, а 2-1 — сжатию газа.
Дата добавления: 2014-12-20 ; просмотров: 16886 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://ege-study.ru/ru/ege/materialy/fizika/pervyj-zakon-termodinamiki/
http://helpiks.org/1-105624.html