Изотермический процесс
Вы будете перенаправлены на Автор24
Что такое изотермический процесс
Изотермическим процессом называется процесс, происходящий в неизменной массе газа при постоянной температуре.
\[p_1V_1=\nu RT\left(1\right),\] \[p_2V_2=\nu RT\ \left(2\right).\]
Закон Бойля-Мариотта
Разделим уравнение (2) на уравнение (1), получим уравнение изотермического процесса:
Уравнение (4) называют законом Бойля-Мариотта.
Этот процесс происходит с подводом тепла, если объем увеличивается, или его отводом, чтобы уменьшать объем. Запишем первое начало термодинамики, последовательно получим выражения для работы, внутренней энергии и количества теплоты изотермического процесса:
\[\delta Q=dU+dA=\frac<2>\nu RdT+pdV,\ \left(5\right).\]
Температура не изменяется, следовательно, изменение внутренней энергии равно нулю ($dU=0$). Получается, что в изотермическом процессе все подводимое тепло идет на совершение газом работы:
где $\delta Q\ $- элементарное тепло, подводимое к системе, $dA$- элементарная работа, которую совершает газ в процессе, i — число степеней свободы молекулы газа, R — универсальная газовая постоянная, d -количество молей газа, $V_1$- начальный объем газа, $V_2$- конечный объем газа.
Используем уравнение состояния идеального газа, выразим из него давление:
Подставим уравнение (8) в подынтегральное выражение уравнения (7):
Уравнение (9) — выражение для работы газа в изотермическом процессе. Уравнение (9) можно записать через отношение давлений, если использовать закон Бойля-Мариотта, в таком случае:
\[A=\nu RTln\left(\frac
Уравнение (11) определяет количество теплоты, сообщаемое газу массы m в изотермическом процессе$.
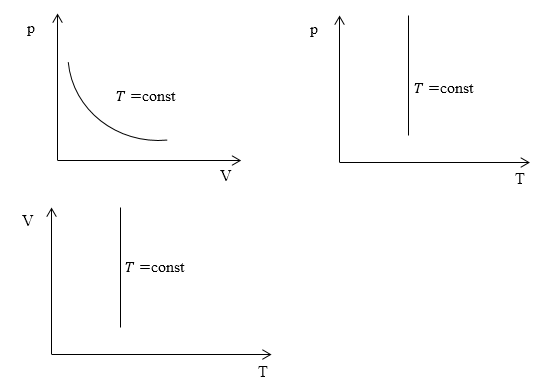
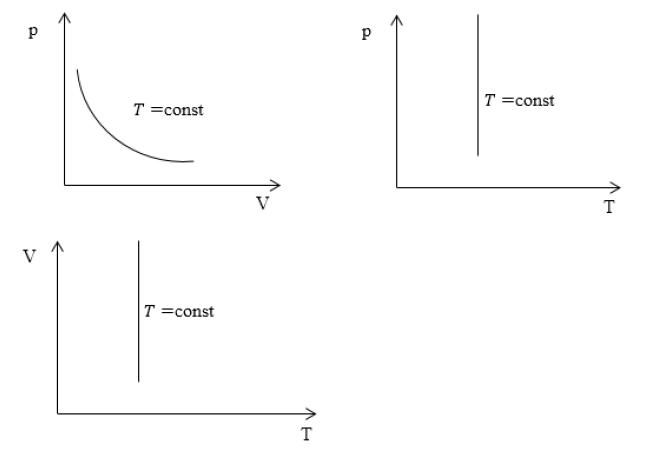
Изопроцессы очень часто изображают на термодинамических диаграммах. Так, линия, изображающая на такой диаграмме изотермический процесс, называется изотермой (рис.1).
Задание: Идеальный одноатомный газ расширяется при постоянной температуре от объема $V_1=0,2\ м^3$ до $V_2=0,6\ м^3$. Давление в состоянии 2 равно $p_2=1\cdot <10>^5\ Па$. Определить:
- Изменение внутренней энергии газа.
- Работу, которую совершает газ в этом процессе.
- Количество теплоты, получаемое газом.
Так как процесс изотермический, то внутренняя энергия газа не изменяется:
Из первого начала термодинамики, следовательно:
\[\triangle Q=A\ \left(1.1\right).\] \[A=\nu RTln\left(\frac
Запишем уравнение конечного состояния идеального газа:
Подставим выражение для температуры из (1.3) в (1.2), получим:
Так как все величины в данных находятся в СИ, проведем расчет:
Ответ: Изменение внутренней энергии газа в заданном процессе равно нулю. Работа, которую совершает газ в этом процессе $6,6<\cdot 10>^4Дж.$ Количество теплоты, получаемое газом в данном процессе, $6,6<\cdot 10>^4Дж$.
Готовые работы на аналогичную тему
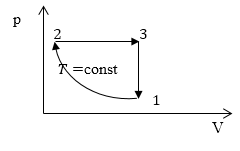
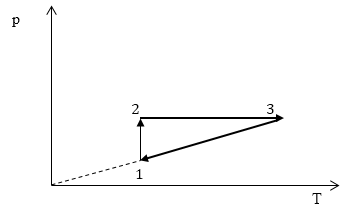
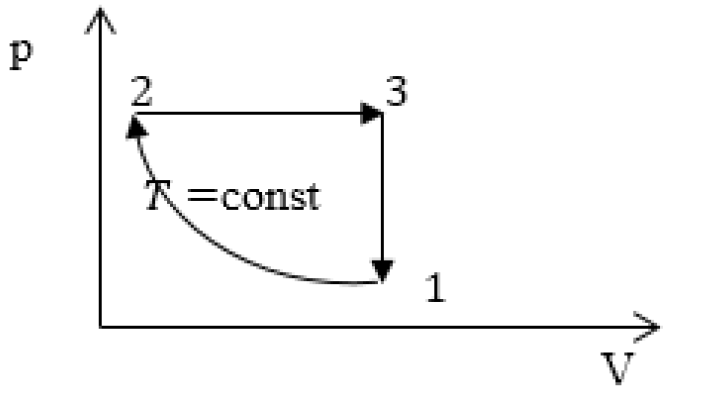
Задание: На рис 2. представлен график изменения состояния идеального газа массы m в осях p(V). Перенесите этот процесс в оси p(T).
Опишем данный на рисунке 2 круговой процесс.
1-2 изотермический процесс ($T=$const), в котором объем уменьшается (V$\downarrow $), давление растет (p$\uparrow $).
2-3 изобарический процесс ($p=$const), в котором V$\uparrow $, следовательно, из закона Гей-Люссака, T$\uparrow .$
3-1 изохорный процесс (V$=const$), в нем p$\downarrow $, следовательно, из закона Шарля T$\downarrow $.
Изобразим в осях p(T) вышеперечисленные процессы.
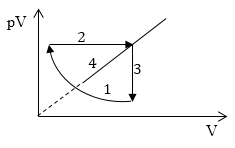
Задание: Какой график на рис. 4 представляет изотермический процесс?
Изотермический процесс описывается законом Бойля-Мариотта
Следовательно, на графике в осях $pV(V)$ изотерма представлена графиком 2.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 18 12 2021
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Изотермический процесс
Время чтения: 14 минут
Для изотермического процесса характерен определенный процесс, который происходит с газовым веществом, который в свою очередь имеет неизменную массу и постоянную неизменяемую температуру вещества.
Изотермический процесс для температуры газа, основные формулы и величины
Изотермический процесс характеризует состояние газа и данное состояние записывается следующими формулами:
Изотермический процесс для системы координат
Характерные изотермические процессы зачастую отражают на термодинамических графиках и диаграммах.
Если рассмотреть подробно график можно увидеть линию, именно ее и принято называть изотермой. Она непосредственно является основной характеристикой процесса.
Основной принцип закона Бойля-Мариотта
Разделим уравнение для второго состояния газа на выражение первого состояния и получим основное уравнение изотермического процесса.
\[\frac
Полученное уравнение и будет называться законом Бойля-Мариотта.
Данный процесс осуществляется с использованием тепловой энергии.
В случае, когда объем увеличивается, или отводится, для его уменьшения.
Составим первое значение термодинамики.
Затем постепенно получим уравнение для определения работы.
А также вычисления внутренней энергии и количества теплоты тела при изотермическом процессе.
Температура является неизменной, поэтому, изменение значения внутренней энергии будет равняться нулевому значению. \[(d \cup=0)\].
Из этого следует, что для изотермического процесса все подводимое тепло направлено на работу, которую совершает газ:
- \[\delta Q\] — тепло элементарного характера, которое подводится ко всей системе;
- dA — работа элементарного типа, совершаемая газом в изотермическом процессе;
- i — количество свободных степеней газовых молекул;
- R — газовое значение постоянной;
- d — значение молей для газа;
- V1— первоначальное значение объема газа;
- V2— окончательное значение объема газа.
Давление газа, которое зависит от уравнения газа в идеальном состоянии.
Подставим вышеуказанное выражение в подынтегральное выражение:
Составленное уравнение необходимо определения значения работы, которую совершает газ в изотермическом процессе.
Нет времени решать самому?
Наши эксперты помогут!
Примеры решения задач используя правило изотермического процесса
Пример №1
Основное содержание задания: газ идеального состояния, имеет способность расширяется, имея постоянную температуру, от объема.
Известно сила давления во втором состоянии и оно равняется \[p_<2>=1 \cdot 10^ <5>\mathrm<\Pi a>\].
- Величину изменения внутренней энергии газа;
- Значение работы, которую совершает газовое вещество в данном процессе;
- Какое необходимое количество теплоты получает газ в процессе работы.
Внутренняя энергия газа неизменна, так как процесс который рассматривается в задаче, является изотермическим:
Из основного закона термодинамики можно определить:
Составим и запишем уравнение, которое отражает окончательное (конечное) состояние газа:
Подставим в уравнение для температуры вышеизложенные формулы и получим решение:
Следовательно, все величины расположены в международной системе единиц (СИ), можно провести вычисления и определить неизвестные значения:
- значение изменения внутренней энергии газа в рассматриваемой процессе равно нулевому значению.
- работа, которая совершается в процессе газовым веществом равняется \[6,6 \cdot 10^ <4>\text < Дж >\].
- Необходимое количество тепловой энергии равно: \[6,6 \cdot 10^ <4>\text < Дж >\].
Пример №2
Задание: изображен график, где изменяется идеальное состояние массы газа равное m в координатных осях p (V).
Нужно перенесите данный процесс на координатные оси в p(T).
На данном графике изображен круговой процесс.
- Прямая 1-2 является изотермическим процессом с константой \[(T=\text < cons >t)\]. Следовательно значение объема будет уменьшается \[(\mathrm
\downarrow)\], а давления соответственно расти \[(p \uparrow)\]. - Прямая 2-3 отражает изобарический процесс \[(p=\text < const >)\]
const). Для данного процесса характерно увеличение объема \[\mathrm
- Прямая (отрезок) 3-1 является изохорным процессом объем будет постоянной величиной \[(\mathrm
=\text < const >)\], а \[p \downarrow\],а исходя из закона Шарля \[T \downarrow\].
Все перечисленные процессы изобразим на координатных осях p(T).
http://energoworld.ru/theory/osnovnyie-termodinamicheskie-protsessyi/
http://www.napishem.ru/spravochnik/fizika/izotermicheskiy-process.html