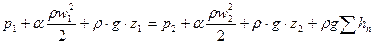Физическая химия: конспект лекций.
5. Процессы. Второй закон термодинамики.
Второй закон термодинамики, в отличие от первого закона термодинамики, изучает все процессы, которые протекают в природе, и эти процессы можно классифицировать следующим образом.
Процессы бывают самопроизвольные, несамопроизвольные, равновесные, неравновесные.
Самопроизвольные процессы делятся на обратимые и необратимые. Второй закон термодинамики называют законом направленности процесса в изолированной системе (закон роста S). Слово «энтропия» создано в 1865 г. Р. Ю. Э. Клаузиусом – «тропе» с греческого означает превращение. В 1909 г. профессор П. Ауербах назвал царицей всех функций внутреннюю энергию, а S – тенью этой царицы. Энтропия – мера неупорядоченности системы.
Обратимые и необратимые процессы.
Необратимые процессы идут без затраты работы, протекают самопроизвольно лишь в одном направлении, это такие изменения состояния в изолированной системе, когда при обращении процессов свойства всей системы меняются. К ним относятся:
1) теплопроводность при конечной разности температур;
2) расширение газа при конечной разности давлений;
3) диффузия при конечной разности концентраций.
Обратимыми процессами в изолированной системе называются такие процессы, которые можно обратить без каких-либо изменений в свойствах этой системы.
Обратимые: механические процессы в системе, где отсутствует трение (идеальная жидкость, ее движение, незатухающие колебания маятника в вакууме, незатухающие электромагнитные колебания и распространение электромагнитных волн там, где нет поглощения), которые могут возвратиться в начальное состояние.
Самопроизвольные – процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, Nа с большой скоростью движется по поверхности, так как идет выделение водорода проверить.).
Несамопроизвольные – процессы, которые не могут идти сами собой, на них затрачивается работа.
Равновесие делится на устойчивое, неустойчивое и безразличное.
Постулаты второго закона термодинамики.
1. Постулат Клаузиуса – не может быть перехода тепла от менее нагретого к более нагретому телу.
2. Постулат Томсона – теплота наиболее холодного тела не может служить источником работы.
Теорема Карно – Клаузиуса: все обратимые машины, совершающие цикл Карно с участием одного и того же нагревателя и одного и того же холодильника, имеют одинаковый коэффициент полезного действия, независимо от рода рабочего тела.
Аналитические выражения второго закона термодинамики.
1. Классическое уравнение второго закона термодинамики.
Q2 / Т2 – приведенное тепло холодильника;
Q1 /Т1= Q2 /Т2 – равенство приведенных теплот нагревателя и холодильника. Это второе уравнение термодинамики.
Если делим адиабатами на множество циклов Карно, то получим.
Это третье уравнение второго закона термодинамики для бесконечно малого цикла Карно.
Если процесс является конечным, то.
Это четвертое уравнение второго закона термодинамики Если процесс является замкнутым, то.
Это пятое уравнение второго закона термодинамики для обратимого процесса.
Интеграл по замкнутому контуру – интеграл Клаузиуса.
При необратимом процессе:
Это шестое уравнение второго закона термодинамики, или уравнение Клаузиуса, для обратимого процесса равно нулю, для необратимого процесса оно меньше 0, но иногда может быть больше 0.
Это седьмое уравнение второго закона термодинамики. Второй закон термодинамики – закон роста S.
Действие, обратное логарифму – потенцирование:
Первый закон термодинамики определяется постоянством функции U в изолированной системе. Найдем функцию, выражающую содержание второго закона, а именно, одностороннюю направленность протекающих в изолированной системе процессов. Изменение искомой функции должно иметь для всех реальных, т. е. необратимых процессов, протекающих в изолированных системах, один и тот же знак. Второй закон термодинамики в приложении к некруговым необратимым процессам должен выражатся неравенством. Вспомним Цикл Карно. Так как любой цикл можно заменить бесконечно большим числом бесконечно малых циклов Карно, то выражение:
Справедливо для любого обратимого цикла. Считая на каждом элементарном участке теплообмена Т = соnst, найдем, что:
И для всего цикла.
Энергия Гельмгольца Изохорно-изотермический потенциал.
Величина (V – ТS) является свойством системы; она называется энергией Гельмгольца. Была введена Гельмгольцем в 1882 г.
dF = dU – ТdS – SdТ,
dF = ТdS – рdV – SdТ,
F – полный дифференциал.
Увеличение объема приводит к тому, что изохорно-изотермический потенциал уменьшается (тот «минус», который стоит перед Р ). Повышение температуры приводит к тому, что F уменьшается.
Физический смысл изохорно-изотермического потенциала.
Убыль изохорно-изотермического потенциала равна максимальной работе, производимой системой в этом процессе; F – критерий направленности самопроизвольного процесса в изолированной системе. Для самопроизвольного процесса: АFТ г 0. Для равновесного процесса: ΔFТ,V = 0.
Изохорно-изотермический потенциал в самопроизвольных процессах уменьшается и, когда он достигает своего минимального значения, то наступает состояние равновесия (рис. 4).
Где 1 – самопроизвольный процесс;
2 – несамопроизвольный процесс;
3 – равновесный процесс.
Изобарно-изотермический потенциал.
1) G (Р, Т= соnst), энергия Гиббса.
G = U – ТS + РV = Н – ТS = F + РV,
Работа изобарно-изотермического процесса равна убыли изобарно-изотермического потенциала – физический смысл этой функции;
2) функция – полный дифференциал, однозначна, конечна, непрерывна.
dG = dU – ТdS – SdТ + рdv + vdр,
dG = ТdS – рdV – ТdS – SdТ + рdv + vdр,
Повышение температуры приводит к тому, что изобарно-изотермический потенциал уменьшается, так как перед S стоит знак «минус». Повышение давления приводит к тому, что изобарно-изотермический потенциал увеличивается, так как перед V стоит знак «плюс»;
3) G как критерий направленности процесса в изолированной системе.
Для самопроизвольного процесса: (ΔG)Р,Т 0. Для равновесного процесса: (ΔG)Р,Т = 0.
Изобарно-изотермический потенциал в самопроизвольных процессах уменьшается, и, когда он достигает своего минимума, то наступает состояние равновесия.
Где 1 – самопроизвольный процесс;
2 – равновесный процесс;
3 – несамопроизвольный процесс.
Совершается работа за счет ΔU и ΔН.
Противодействующие факторы. Энтальпийный фактор характеризует силу притяжения молекул. Энтропийный фактор характеризует стремление к разъединению молекул.
Энтальпия – Н Внутренняя энергия – U.
dН = dU + рdv + vdр,
dU = ТdS – SdТ + рdV + Vdр,
dН = –рdV + рdV + Vdр; U = ТdS + VdР.
Где 1 – самопроизвольный процесс,
2 – несамопроизвольный процесс,
3 – равновесный процесс,
Уравнения Гиббса – Гельмгольца – уравнения максимальной работы.
Они позволяют установить связь между максимальной работой равновесного процесса и теплотой неравновесного процесса.
Уравнение Гельмгольца (уравнение связывающее функции F и G с их температурными производными).

Уравнение Гиббса (уравнение связывающее функции F и G с их температурными производными).
Уравнения эти дают возможность рассчитать работу через температурный коэффициент функции Гельмгольца или через температурный коэффициент функции Гиббса.
Уравнение Клаузиуса-Клапейрона.
Оно позволяет применить второй закон термодинамики к фазовым переходам. Если рассчитать процессы, в которых совершается только работа расширения, то тогда изменение внутренней энергии.
Предположим, что 1 моль вещества переходит из первой фазы во вторую.
Нет условного равновесия,
Где dР/dТ – температурный коэффициент давления,
Где λфп – теплота фазового перехода.
Уравнение Клаузиуса-Клапейрона, дифференциальная форма уравнения.
Уравнение устанавливает взаимосвязь между теплотой фазового перехода, давлением, температурой и изменением молярного объема.
Эмпирическая форма уравнения Клаузиуса-Клапейрона.
Уравнение Клаузиуса-Клапейрона изучает фазовые переходы. Фазовые переходы могут быть I рода и II рода.
I рода – характеризуются равенством изобарных потенциалов и скачкообразными изменениями S и V.
II рода – характеризуются равенством изобарных потенциалов, равенством энтропий и равенством молярных объемов.
Алгебраическая сумма приведенных теплот для любого обратимого кругового процесса равна нулю.
Эта подынтегральная величина – дифференциал однозначной функции состояния. Эта новая функция была введена Клаузиусом в 1865 г. и названа энтропией – S (от греч. «превращение»).
Любая система в различном состоянии имеет вполне определенное и единственное значение энтропии, точно так же, как определенное и единственное значение Р, V, Ти других свойств.
Итак, энтропия выражается уравнением:
Где S – это функция состояний, изменение которой dSв обратимом изотермическом процессе перехода теплоты в количество Q равно приведенной теплоте процесса.
При независимых переменных U (внутренняя энергия) может обозначаться UВН и V (объем), или Р (давление) и Н(энтальпия). Энтропия является характеристической функцией. Характеристические функции – функции состояния системы, каждая из которых при использовании ее производных дает возможность выразить в явной форме другие термодинамические свойства системы. Напомним, в химической термодинамике их пять:
1) изобарно-изотермический потенциал (энергия Гиббса) при независимых переменных Т, Р и числе молей каждого из компонентов и.;
2) изохорно-изотермический потенциал (энергия Гельмгольца) при независимых переменных Т, V, ni;
3) внутренняя энергия при независимых переменных: S, V, ni;
4) энтальпия при независимых переменных: S, Р, пi;
5) энтропия при независимых переменных Н, Р, ni..
В изолированных системах (U и V= соnst) при необратимых процессах энтропия системы возрастает, dS > 0; при обратимых – не изменяется, dS = 0.
Связь энтропии с другими термодинамическими параметрами.
Для того, чтобы решить конкретную задачу, связанную с применением энтропии, надо установить зависимость между ней и другими термодинамическими параметрами. Уравнение dS = δQ/Т в сочетании с δQ = dU + РdV и δQ = dН – VdР дает уравнения:
Применительно к функциональной зависимости φ(Т, V, S) = 0, получим.
Теперь найдем зависимость энтропии от температуры из уравнений:
Вот эти зависимости:
Эти два уравнения являются практически наиболее важными частными случаями общего соотношения:
Пользуясь разными зависимостями, можно вывести другие уравнения, связывающие термодинамические параметры.
Самопроизвольные – процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, натрий с большой скоростью движется по поверхности, так как идет выделение водорода), а калий буквально «прыгает» по воде.
Несамопроизвольные – процессы, которые не могут идти сами собой, на них затрачивается работа.
Равновесие делится на устойчивое, неустойчивое и безразличное.
Постулаты второго закона термодинамики.
1. Постулат Клаузиуса – «Не может быть перехода тепла от менее нагретого к более нагретому телу».
2. Постулат Томсона – «Теплота наиболее холодного тела не может служить источником работы».
Теорема Карно-Клаузиуса: «Все обратимые машины, совершающие цикл Карно с участием одного и того же нагревателя и одного и того же холодильника, имеют одинаковый коэффициент полезного действия, независимо от рода рабочего тела».
Аналитические выражения второго закона термодинамики.
1. Классическое уравнение второго закона термодинамики.
Где Q /Т – приведенное тепло;
Q2 / Т2 – приведенное тепло холодильника;
Q1 /Т1= Q2 / Т2 – равенство приведенных теплот нагревателя и холодильника. Это второе уравнение термодинамики.
Если делим адиабатами на множество циклов Карно, то получим.
Это третье уравнение второго закона термодинамики для бесконечно малого цикла Карно.
Если процесс является конечным, то.
Это четвертое уравнение второго закона термодинамики.
Если процесс является замкнутым, то.
Это пятое уравнение второго закона термодинамики для обратимого процесса.
Интеграл по замкнутому контуру – интеграл Клаузиуса.
При необратимом процессе:
Шестое уравнение второго закона термодинамики, или уравнение Клаузиуса, для обратимого процесса равно нулю, для необратимого процесса оно меньше 0, но иногда может быть больше 0.
Это седьмое уравнение второго закона термодинамики. Второй закон термодинамики – закон роста S.
Термодинамическая вероятность.
Это формула Больцмана,
Где S – энтропия – степень разупорядоченности системы;
к– постоянная Больцмана;
W – термодинамическая вероятность системы макросостояний.
Термодинамическая вероятность – число микросостояний данной системы, с помощью которых можно реализовать данное макросостояние системы (Р, Т, V).
Если W = 1, то S = 0, при температуре абсолютного нуля –273°С все виды движений прекращаются.
Термодинамическая вероятность – это число способов, которыми атомы и молекулы можно распределить в объеме.
Потенциальная (техническая) работа
Потенциальной (технической) работой называется работа по перемещению сплошных масс (газа, пара или жидкости) из области одного давления (p1) в область другого давления (p2), т.е. потенциальная работа — это работа обратимого изменения давления.
Элементарная потенциальная работа простого тела определяется из соотношения

Удельная потенциальная работа в элементарном процессе 

Для определения интегральных значений полной ( 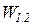


Как следует из соотношений (11), (12), работа определяется в координатах р–V площадью между кривой процесса и осью абсцисс независимо от вида рабочего тела и его свойств (рис. 2).
Рис. 2. Потенциальная работа обратимого изменения давления
В частном случае для изохорного процесса (v = idem) интегральные значения полной и удельной потенциальной работы определяются по следующим соотношениям:

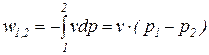
Потенциальная работа считается положительной при снижении давления ( 

Потенциальная работа в обратимом процессе ( 




Необратимые потери потенциальной работы ( 
Эффективная термодинамическая работа ( 







В условиях механических процессов (dEcz=G×cЕ×dcЕ+G×g×dz) уравнение распределения термодинамической и потенциальной работ формулируется следующим образом:


где cE – скорость движения тела, dz – изменение высоты центра тяжести тела в поле тяготения.
Внутренняя энергия тела
Внутренняя энергия представляет собой полный запас энергии тела и состоит из энергии поступательного и вращательного движения молекул, энергии внутримолекулярных колебаний, потенциальной энергии сил сцепления между молекулами, внутримолекулярной энергии, внутриатомной энергии.
Внутренняя энергия U является функцией состояния, она не зависит от пути процесса, а ее элементарное изменение обозначается символом полного дифференциала (dU).
Внутренняя энергия измеряется в Джоулях (Дж), а удельная внутренняя энергия (u) — в Дж/кг.
Для простых тел внутренняя энергия определяется как функция двух переменных (р,T; р,v или T,v).
Теплота
Теплота — количество энергии, передаваемой от одного тела к другому посредством теплопроводности, конвективного или лучистого теплообмена. Процесс передачи теплоты называется теплообменом.
Количество теплоты 

Количество теплоты 



Теплоемкость
Теплоемкостью называется количество теплоты, которое надо сообщить единице массы, количества или объема вещества, чтобы его температура повысилась на 1 градус.
Различают массовую теплоемкостьс, измеряемую в Дж/(кг×К), молярную 
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:


Теплоемкость газов зависит от термодинамического процесса, в котором подводится или отводится теплота. Если процесс задан условием
z = idem, то теплоемкость в этом процессе будет определяться следующим образом:
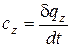
Эта теплоемкость называется истинной.
Экспериментальное определение теплоемкости обычно проводится в двух процессах: при постоянном объеме (изохорная теплоемкость cv ) и постоянном давлении (изобарная теплоемкость cp).
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Из уравнения (19) следует, что количество теплоты, подведенной к телу (или отведенной от него) в процессе 1–2 (изобарном или изохорном), определяется соотношением

Отсюда следует выражение средней теплоемкости газа

Для большинства газов значения средней теплоемкости в интервале температур от t1 до t2 приведены в специальных термодинамических таблицах.
Для некоторых газов в определенном интервале температур истинная теплоемкость изменяется по линейному закону

Подставив это выражение (22) в уравнение (21), получим
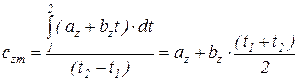
где сzm называется первой средней теплоемкостью. Она численно равна истинной теплоемкости при среднеарифметической температуре процесса.
2. Физическое состояние вещества,
фазовая диаграмма чистого вещества
Различают три агрегатных состояния простых систем: твердое, жидкое и газовое.
С помощью фазовой диаграммы можно проследить переход тела из одного агрегатного состояния в другое. Рассмотрим диаграмму фазовых состояний чистого вещества (рис.3).
Рис. 3. Диаграмма фазовых состояний чистого вещества
Линии фазовых превращений (испарение — I, плавление — II,
сублимации — III) отображают термодинамическое равновесие двухфазных систем и делят диаграмму на области различных агрегатных состояний.
Фазами системы называются области, ограниченные поверхностями раздела. На линиях фазовых превращений существует однозначная зависимость между давлением и температурой. Эти линии пересекаются в тройной точке, где вещество одновременно находится в трех агрегатных состояниях. Параметры тройной точки принадлежат к термодинамическим константам вещества.
Энергетической границей между жидкостью и паром является теплота испарения, а между твердым телом и жидкостью – теплота плавления. Так как процессы испарения и плавления протекают при постоянной температуре, то теплоты испарения, плавления и сублимации есть теплоты изотермических превращений. Теплота фазового перехода обозначается символом 
Наибольший интерес для проведения технических расчетов в термодинамике представляютгаз ижидкость. При увеличении давления термодинамическое различие в их свойствах заметно уменьшается и в критической точке исчезает полностью.
Критические параметры являются важнейшими термодинамическими постоянными вещества. Понятие критической температуры введено
Д. И. Менделеевым. Критическая температура 

В закритической области ( 
Условным признаком непрерывности однофазного состояния вещества является возможность перехода его из любого однофазного исходного состояния в другое однофазное состояние путем непрерывных изменений параметров состояния, минуя фазовые энергетические барьеры.
Поэтому в принципе, для простых тел (однородных систем) должно существовать единое уравнение состояния 
Лекция 2. Термодинамический процесс, работа процесса, внутренняя энергия.
Под термодинамическим процессом понимают последовательное изменение состояния рабочего тела, которое происходит под влиянием механического (сжатие или расширение) или термического (нагрев или охлаждение) воздействия окружающей среды.
Различают равновесные и неравновесные процессы. Под равновесным (идеальным) понимают процесс, который протекает с бесконечно малой скоростью так, что в каждый момент времени в рабочем теле успевает установиться равновесное состояние. Термодинамика изучает в основном равновесные процессы. Равновесные процессы называют обратимыми, так как они могут протекать сначала в прямом, а затем в обратном направлении через одну и ту же последовательность равновесных состояний. При этом вся система тел, принимающих участие в процессах, возвращается в свое первоначальное состояние без дополнительных затрат энергии.
Под неравновесным процессом понимают все действительные (реальные) процессы, в которых рабочее тело проходит через неравновесные состояния. Неравновесные процессы называют необратимыми.
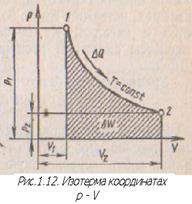
Обратимые (равновесные) процессы изображают графически и прямоугольной системе 
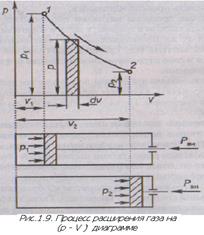
Представим, что в цилиндре находится 1кг газа с начальными параметрами 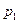
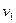
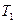
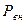
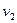
В 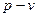
Внутренняя энергия газа. Рабочее тело, находясь в любом состоянии, обладает определенным запасом внутренней энергии. Под внутренней энергией понимают все виды энергии, связанные с внутренним движением молекул: кинетическую энергию поступательного и вращательного движения молекул, потенциальную энергию молекул. У идеального газа отсутствуют силы взаимодействия между молекулами и, следовательно, потенциальная энергия его молекул равна нулю. Значит, внутренняя энергия идеального газа зависит только от его температуры.
Поскольку в термодинамике все газы рассматриваются как идеальные, то их внутренняя энергия не зависит от давления и объема, является функцией только температуры. Поэтому изменение внутренней энергии не обусловлены характером процесса, а определяется только его начальной и конечной температурами.
Первый закон термодинамики. В технической термодинамике рассматриваются только процессы взаимодействия тепловой и механической энергии. Применительно к ним закон сохранения и превращения энергии называется первым законом <началом) термодинамики который сформулирован следующим образом:
Теплота может превращаться в механическую работу, а работа в тепловую лишь в строго эквивалентных количествах, причем количество теплоты, полученное рабочим телом от какого-либо источника тепла, равно сумме приращения внутренней энергии этого тела и количеством совершенной им работы.
Согласно закону сохранения энергии общий запас энергии рассматриваемой изолированной термодинамической системы при любых преобразованиях остается постоянным, т.е. 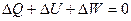
Выражение (1.10) называют основным уравнением первого закона термодинамики. Оно показывает, что при любых энергетических процессах алгебраическая сумма изменений запасов энергии тел, входящих в изолированную систему, равна нулю.
Термодинамические процессы. В простейшей термодинамической системе могутсовершаться разнообразные процессы, отличающиеся один от другого характером взаимодействия рабочего тела с тепловым и механическим аккумуляторами. Термодинамика изучает пять основных процессов идеальных газов: изохорный, происходящий при постоянном объеме рабочего тела (V = const); изобарный, происходящий при постоянном давлении рабочего тела (р = const); изотермический, происходящий при постоянной температуре рабочего тела (Т = const); адиабатный, протекающий без теплообмена между рабочим телом и окружающей средой ( 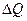
Изохорный процесс — Изохорные процессы происходят при нагревании или охлаждении газа в закрытых сосудах постоянного объема. Очень близок к изохорному процессу процесс
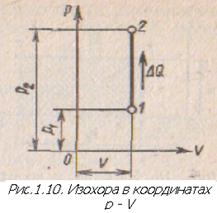
Графическое отображение изохорного процесса в системе координат 
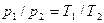
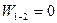
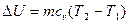
В изохорном процессе, протекающем без совершения работы, внутренняя энергия рабочего тела изменяется только за счет подвода или отвода теплоты, т. е. 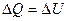
Изобарным называется процесс, совершаемый при постоянном внешнем давлении рабочего тела. В практике изобарные процессы наблюдаются при подводе теплоты к рабочему телу в газотурбинных двигателях, при получении водяного пара. Уравнение изобарного процесса 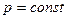
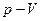
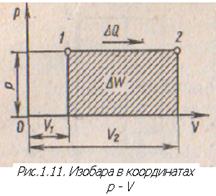
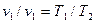
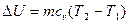
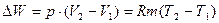
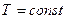
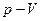
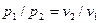
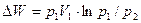
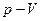
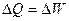
Адиабатным называется процесс, происходящий без теплообмена рабочего тела с аккумулятором тепловой энергии. Следовательно, условием осуществления адиабатного процесса является выражение AQ = 0, т. е. Q = const. Осуществление адиабатного процесса возможно лишь при заключении рабочего тела в сосуд с абсолютно теплонепроницаемыми стенками.
В практике термодинамических расчетов К адиабатным приближаются также процессы сжатия и расширения газов в быстроходных ДВС. Уравнение адиабатного процесса имеет вид 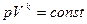


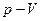
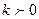
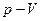
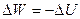
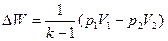
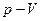
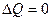
Политропный процесс. Политропным называется такой процесс изменения состояния газа, протекающий при одновременном изменении всех параметров газа и при наличии теплообмена. Уравнение политропного процесса имеет вид 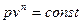
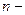
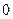
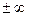
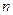
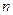
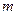
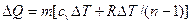

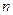
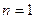
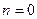
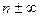
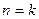
В политропных процессах изменение состояния газа и характер превращения энергии определяются двумя факторами: направлением процесса (сжатие или расширение) и значением показателя 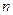
Второй закон термодинамики и термодинамические циклы.Первый закон термодинамики устанавливает количественное соотношение между различными видами энергии при их взаимном превращении. Однако он не дает ответа на вопрос о возможном направлении таких превращений и условиях, при которых преобразование энергии может быть реализовано.
В то же время установлено, что не все процессы, связанные с передачей и преобразованием различных видов энергии, равновозможны. Особое значение для практики имеет необратимость взаимного преобразования теплоты и механической работы. Опыт показывает, что преобразование механической энергии в тепловую всегда происходит полностью и самопроизвольно без каких-либо дополнительных условий или процессов. Однако обратное преобразование тепловой энергии, рассеянной в окружающей среде, в механическую работу самопроизвольно происходить не может. Переход этот возможен не полностью и лишь при соблюдении определенных условий. Установление условий и особенностей протекания процессов преобразования тепловой энергии в механическую составляет основное содержание второго закона термодинамики, который гласит, что теплота только тогда может быть преобразована в работу, когда в системе тел имеется перепад температур; совершаемая работа зависит от уровня этих температур; полный переход теплоты в работу невозможен. По другой формулировке самопроизвольный выход термодинамической системы из равновесного состояния практически невозможен.
Таким образом, сущность второго закона термодинамики состоит в том, что нельзя построить тепловой двигатель, который имел бы термический К.П.Д. равный единицы, т.е. невозможен так называемый «вечный двигатель».
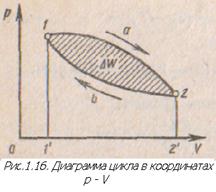
Для оценки совершенства термодинамического цикла с точки зрения степени преобразования теплоты в работу вводится понятие термического или термодинамического К.П.Д. Термическим К.П.Д. называется отношение количества теплоты, эквивалентное цикловой работе, к количеству подводимой за цикл теплоты. 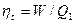
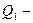
Общим в рассмотренных циклах тепловых двигателей является преобразование тепловой энергии в механическую. Такие циклы называются прямыми. В координатах р—V процесс изменения состояния рабочего тела при прямом цикле протекает по часовой стрелке. Линия расширения располагается выше линии сжатия.
Наряду с прямыми циклами существуют обратные, в которых процессы изменения состояния протекают против часовой стрелки, линия расширения располагается ниже линии сжатия. На совершение такого цикла необходимо затратить механическую работу. Обратные циклы осуществляются в холодильных установках и компрессорах. Если цикл состоит только из обратимых процессов, то он является обратимым.
Теплопередача.Процесс теплообмена — естественный процесс переноса (передачи) теплоты при наличии разности температур внутри твердого тела, в жидкой или газообразной среде, на границе твердого тела с окружающей его средой, в двух средах, разделенных перегородкой. Разность температур — это необходимое условие теплообмена, причем тепловой поток направлен от более высокой к менее высокой температуре. В общем случае температура неодинакова в различных точках тела или среды и зависит от времени, т. е. она является функцией координат и времени 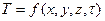
В зависимости от способа переноса (передачи) теплоты различают три вида теплообмена: теплопроводностью, конвекцией и излучением.
Теплопроводностью называется процесс распространения теплоты внутри тела при взаимном соприкосновении частиц (молекул, атомов, электронов). В металлах теплота передается посредством диффузии свободных электронов. В газах перенос энергии теплопроводностью происходит вследствие межмолекулярного взаимодействия при столкновениях молекул.
Конвекция. Теплообмен между поверхностью твердого тела и жидкой или газообразной средой при их непосредственном соприкосновении называется конвективным теплообменом или теплоотдачей. Этот процесс сопровождается перемещением массы среды, при котором частицами вещества (жидкости или газа) осуществляется перенос теплоты.
К числу важнейших факторов, которыми определяется интенсивность теплоотдачи, относится скорость потока среды. Движение среды может быть свободным, вызванным разностью плотностей нагретых и холодных масс жидкости (газа), и вынужденным, происходящим под действием насоса, вентилятора, эжектора. Соответственно этим условиям движения теплообмен осуществляется при естественной (свободной) или при вынужденной конвекции.
Теплопередачей называется теплообмен между двумя средами через разделяющую их однослойную или многослойную перегородку. Теплопередача состоит из трех процессов теплообмена: на границе раздела тело-среда с одной и другой стороны перегородки и переноса теплоты внутри перегородки. При теплопередаче вся теплота, переданная от среды с высокой температурой к поверхности перегородки, проходит через нее и отдается среде с более низкой температурой.
Основы гидродинамика.Гидравлика — наука, изучающая законы равновесия и движения различных жидкостей и методы применения этих законов для решения практических задач. Законы гидравлики используются при проектировании гидросистем автомобиля и двигателя, изучении явлений в процессе наполнения в цилиндрах двигателя и при истечении топлива в карбюраторе.
Гидравлика состоит из двух основных частей: гидростатики, изучающей законы равновесия жидкостей, и гидродинамики, изучающей законы движения жидкостей.
В понятие «жидкость» включают все тела, для которых свойственна текучесть, т.е. способность сильно изменять свою форму под действием сколь угодно малых сил. В это понятие включают как жидкости обычные, называемые капельными, так и газы. Важной особенностью капельных жидкостей является то, что они ничтожно мало изменяют свой объем при изменении давления. Газы же обладают большой сжимаемостью. Несмотря на это различие, законы движения капельных жидкостей и газов при определенных условиях можно считать одинаковыми.
Жидкости характеризуются следующими физическими свойствами: плотностью, удельным весом, удельным объемом, сжимаемостью, вязкостью.
Плотностью называют массу жидкости, заключенной в единице объема обозначают 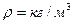
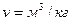
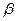
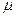
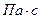
Для упрощения теоретических исследований и выводов введено понятие «идеальная жидкость» — воображаемая жидкость, которая абсолютно подвижна, несжимаема и не обладает вязкостью, т.е. при движении в ней не возникают силы внутреннего трения.
В гидродинамике изучаются явления в движущейся жидкости. Под потоком жидкости понимают движущуюся массу жидкости, полностью или частично ограниченную поверхностями.
В основе изучения гидродинамики лежит так называемая струйчатая модель движения. Эта схема предполагает, что поток жидкости состоит из бесконечно большого числа элементарных струек. Живым сечением потока называется площадь сечения потока, проведенного перпендикулярно к направлению линий тока и ограниченного его внешним контуром. Площадь живого сечения потока равна сумме площадей живых сечений элементарных струек. Расходом называется количество жидкости, протекающей через живое сечение потока в единицу времени. Средняя скорость— это условная скорость потока, которая считается одинаковой для всех частиц данного сечения, но подобрана так, что расход, определенный по ее значению, равен истинному значению расхода. Если несжимаемая жидкость движется без разрывов, то при установившемся движении объемный расход для всех живых сечений потока постоянен 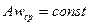
Уравнение Бернулли является вторым основным уравнением гидродинамики, которое устанавливает связь между скоростью и давлением в потоке жидкости. Для потока реальной вязкой жидкости уравнение Бернулли, написанное для двух произвольно взятых сечений 1 и 2 по ходу потока, имеет следующий вид:
где 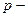
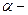
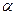
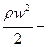

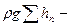
Энергетический смысл уравнения Бернулли заключается в том, что оно выражает закон сохранения механической энергии в жидкости.
Ламинарным называется слоистое течение без перемешивания частиц жидкости и без пульсаций скоростей и давления. Турбулентным называется течение, сопровождающееся интенсивным перемешиванием жидкости. Скорость потока, при которой один режим течения переходит в другой, называется критической.
Движение потока в закрытых руслах при полном заполнении поперечного сечения жидкостью называется напорным. Напорное движение возникает за счет разности давлений в начале и конце трубопровода. При движении потока возникают потери напора, связанные с потерей части энергии на преодоление гидравлических сопротивлений. Гидравлические потери зависят от режима движения жидкости, формы сечения русла и его изменения, характера поверхности стенок и вязкости жидкости.
http://lektsia.com/2x9c51.html
http://helpiks.org/7-32285.html