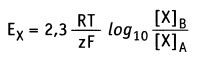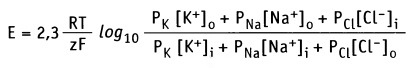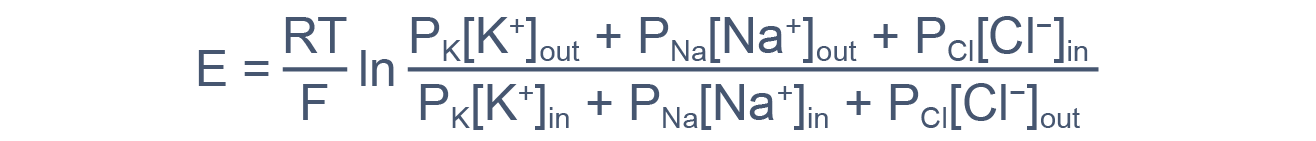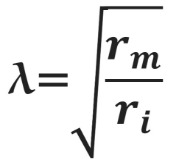Уравнение равновесного мембранного потенциала чье
• Мембранный потенциал возникает за счет электрохимического градиента, который существует по обеим сторонам мембраны, селективно проницаемой для ионов
• Величина мембранного потенциала как функции концентрации ионов рассчитывается по уравнению Нернста
• В клетке поддерживается отрицательное значение мембранного потенциала покоя. При этом внутренняя среда клетки, по сравнению с внешней, характеризуется несколько большим отрицательным зарядом
• Существование мембранного потенциала является необходимым условием генерации электрических сигналов, а также направленного транспорта ионов через мембрану
Важным свойством клеток является способность поддерживать такие внутриклеточные концентрации метаболитов, которые существенно отличаются от их содержания во внеклеточной среде. В случае ионов, различия в их концентрации по обеим сторонам мембраны приводят к различиям в электрическом заряде: внутриклеточная среда заряжена несколько более отрицательно, чем среда снаружи клетки. Совместное действие разности зарядов и концентраций проводит к возникновению электрохимического градиента. Электрохимический градиент поддерживается за счет действия селективных каналов и белков переносчиков в плазматической мембране.
Для того чтобы понять, каким образом возникает электрохимический градиент, вначале рассмотрим простой случай, когда мембрана оказывается проницаемой только для одного вида ионов. На рисунке ниже представлены два компартмента, А и В, разделенные тонкой мембраной. Эти компартменты содержат раствор КС1 разной концентрации. В растворе хлорид калия диссоциирован на гидратированные ионы К+ и Cl-. Поскольку оба компартмента содержат эквимолярные концентрации ионов, то каждый обладает нейтральным зарядом.
Если бы мембрана была непроницаема для ионов, то величина ее электрического потенциала, измеренная с помощью вольтметра, равнялась бы нулю.
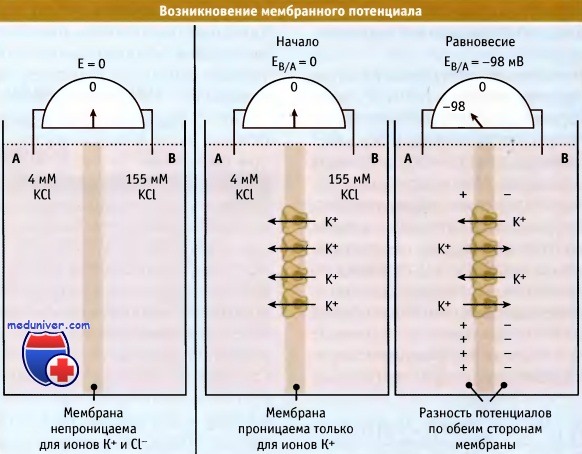
Теперь рассмотрим случай, когда мембрана проницаема только для ионов калия (например, когда в мембране находятся К+-каналы). Диффузия растворенных веществ по градиенту концентрации является энергетически выгодным процессом (выражается в виде отрицательной величины разности энергии AG). Поэтому ионы К+ будут диффундировать в сторону более низкой их концентрации, т. е. из компартмента В в компартмент А. При этом распределение заряда на мембране будет меняться. По мере накопления в компартменте А положительно заряженных ионов, возрастают силы отталкивания между ними. Эти силы затрудняют переход ионов К+ в компартмент А.
Когда в системе достигается электрохимическое равновесие, градиенты концентрации и электрических зарядов взаимно уравновешиваются, и движение ионов К+ через мембрану прекращается. При этом транспорт ионов К+ из одного компартмента сдерживается их транспортом из другого компартмента.
Однако в компартменте А содержится больше положительно заряженных ионов, чем в компартменте В. Этот избыток ионов К+ (в компартменте А) взаимодействует с избытком ионов Cl- (в компартменте В) через тонкую мембрану, в результате чего по обеим ее сторонам выстраиваются электрические заряды. Разница зарядов по обеим сторонам мембраны выражается в виде разности потенциалов и называется мембранный потенциал. Равновесный (мембранный) потенциал компартмента В по отношению к компартменту А имеет отрицательное значение.
Этот пример иллюстрирует необходимость наличия двух условий, необходимых для возникновения мембранного потенциала клетки, не равного нулю:
• различные концентрации ионов по обеим сторонам мембраны, которые приводят к разделению зарядов и
• мембрана, обладающая селективной проницаемостью по крайней мере к одному виду ионов.
Поэтому величина мембранного потенциала является функцией концентрации ионов. В состоянии равновесия эту функцию для ионов X можно выразить количественно с помощью уравнения Нернста:
• Е — равновесный потенциал (в вольтах)
• R — универсальная газовая постоянная (2 кал моль -1 К -1 )
• Т — абсолютная температура (К; 37 °С = 307,5 К)
• z — валентность ионов (электрический заряд)
• F — число Фарадея (2,3 х 10 4 кал вольт -1 моль -1 )
• [Х]А — концентрация свободных ионов X в компартменте А
• [Х]в — концентрация свободных ионов X в компартменте В
В формировании мембранного потенциала в клетках животных, главным образом, участвуют ионы К+, Na+ и Cl-. Ионы Са2+ и Mg2+ в меньшей степени участвуют в формировании мембранного потенциала покоя. Плазматическая мембрана обладает селективной проницаемостью к перечисленным ионам (т. е. мембрана содержит ионные каналы, селективные к каждому типу ионов). Это обстоятельство, а также мембранная проницаемость (Р) для каждого иона учитывается в уравнении Гольдмана-Ходжкина-Каца, которое представляет собой расширенную форму уравнения Нернста.
Для основных ионов это уравнение выражает мембранный потенциал как функцию их проницаемости и концентрации внутри (i) и снаружи (о) клетки:
Величина отрицательного мембранного потенциала покоя зависит от типа клеток и колеблется от -200 мВ до -20 мВ. В клетках млекопитающих мембранный потенциал покоя в основном создается при работе К+-каналов и ионного насоса, который называется Na+/К+-АТФаза. Основной вклад в формирование отрицательного мембранного потенциала вносит небольшой поток ионов К+ через плазматическую мембрану. Этот поток осуществляется через К+-каналы, лишенные воротного механизма (т. н. калиевые каналы покоя).
В отличие от большинства других К+-каналов, которым необходим сигнал для открытия, эти каналы в клетке, обладающей определенным потенциалом покоя, открыты постоянно. В покоящейся клетке также открыты несколько каналов для других ионов. Движение ионов К+ из клетки, по направлению электрохимического градиента, помогает клеточному содержимому поддерживать отрицательный заряд. Пока мы не знаем всех источников ионов калия, которые участвуют в этом процессе. В некоторых клетках, например у растений и бактерий, а также в митохондриях, мембранный потенциал покоя создается за счет градиента протонов, а не ионов К+.
Для того чтобы происходила диффузия ионов К+ из клетки через К+-каналы, их концентрация в клетке должна быть выше, чем в окружающей среде. Градиент концентрации создается в результате работы Na+/К+-АТФа-зы, которая закачивает в клетку два иона калия на каждые три иона натрия, которые этот ионный насос удаляет из клетки. Поэтому насос функционирует как генератор заряда: удаляется больше электрических зарядов, чем привносится к клетку. Таким образом, наряду с K+-каналами, лишенными воротного механизма, Na+/К+-АТФазы участвуют в создании отрицательного внутриклеточного потенциала. Если происходит инактивация Na+/K+-АТФаз, то концентрации ионов Na+ и К+ по обе стороны мембраны уравниваются. Это происходит потому, что липидный бислой очень плохо пропускает ионы. Иными словами, без прохождения первичных процессов активного транспорта с участием Na+/К+-АТФаз значение мембранного потенциала равнялось бы нулю.
Мембранный потенциал покоящейся клетки представляет собой довольно постоянную величину. Однако при связывании лигандов, механическом стрессе или при изменении электрического заряда происходит открытие специфических ионных каналов, и мембранный потенциал изменяется. Если ионные каналы находятся под контролем электрического заряда, то изменения мембранного потенциала влияют на прохождение через них ионов. Открытие и закрытие канала контролируются воротным механизмом (гейтингом). Мембранный потенциал зависит от тех ионов, для которых каналы в основном, открыты. Например, при открытии Na+- или Са2+-каналов происходит деполяризация мембраны.
При этом соответствующие ионы начинают поступать в клетку в направлении их электрохимического градиента. Это приводит к тому, что мембранный потенциал становится более положительным. Напротив, при реполяризации мембраны (гиперполяризации) потенциал становится еще более отрицательным. Это происходит при открытии калиевых каналов и выходе из клетки ионов К+ в направлении градиента, что и влечет за собой увеличение отрицательного мембранного потенциала. Движение ионов по ионным каналам происходит быстро и исчисляется миллисекундами. Для изменения мембранного потенциала достаточны лишь незначительные различия в концентрации ионов по сторонам мембраны, и основная концентрация их в клетке не меняется.
Поток лишь 10 -12 моль К+ через 1 см2 мембраны приводит к ее быстрой гиперполяризации и к установлению мембранного потенциала, равного -100 мВ. Локальное передвижение относительно небольших зарядов через мембрану позволяет цитозолю и внеклеточной среде оставаться электрически нейтральными и сводит к минимуму электрическое отталкивание зарядов.
С энергетической точки зрения, мембранный потенциал представляет собой некий энергетический резервуар, энергию которого можно использовать для выполнения определенной работы. По расположению отрицательно заряженных ионов в цитозоле и положительно заряженных на наружной стороне мембраны, клетка напоминает электрический конденсатор или батарею, т. е. приспособление, способное сохранять электрическую энергию и служить ее источником. Энергия высвобождается в виде ионов, мигрирующих по направлению их электрохимического градиента, и может использоваться в процессах транспорта других ионов или метаболитов против градиента концентрации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Мембранный потенциал покоя
Мембранный потенциал покоя (МПС) — это разность потенциалов между внешней и внутренней сторонами мембраны в условиях, когда клетка не возбуждено. Цитоплазма клетки заряжена отрицательно к внеклеточной жидкости неравномерным распределением анионов и катионов по обе стороны мембраны. Разность потенциалов (напряжение) для различных клеток имеет значение от -50 до -200 мВ (минус означает, что внутри клетка более негативно заряжена, чем снаружи). Мембранный потенциал покоя возникает на мембранах всех клеток — возбуждающих (нервов, мышц, секреторных клеток) и незбудливих.
МПС необходим для поддержания возбудимости таких клеток, как мышечные и нервовои. Также он влияет на транспорт всех заряженных частиц в любом типе клеток: он способствует пассивному транспорта анионов из клетки и катионов в клетку.
Образование и поддержания мембранного потенциала обеспечивают различные типы ионных насосов (в частности натрий-калиевый насос или натрий-калиевая АТФаза) и ионных каналов (калиевые, натриевые, хлорные ионные каналы).
Регистрация потенциала покоя
Для регистрации потенциала покоя используют специальную микроэлектродную технику. Микроэлектрод — это тоненькая стеклянная трубочка, с вытянутым концом, диаметром менее 1 мкм, заполненная раствором электролита (чаще хлорида калия). Рефернтним электродом служит серебряная хлорированная пластинка, расположенная в внеклеточном пространстве, оба электрода подключены к осциллографа. Сначала оба электрода занходяться в внеклеточном пространстве и разность потенциалов между ними отсутствует, если ввести регистрирующий микроэлектрод через мембрану в клетку, то осциллограф покажет скачкообразное смещение потенциала примерно до -80 мВ. Этот сдвиг потенциала называют мембранным потенциалом покоя.
Формирование потенциала покоя
К возникновению мембранного потенциала покоя приводят два фактора: во-первых, концентрации различных ионов отличаются внешне и всереднини клетки, во-вторых мембрана является полупроницаемой: одни ионы могут через нее проникать, другие — нет. Оба эти явления зависят от наличия в мембране специальных белков: концентрационные градиенты создают ионные насосы, а проницаемость мембраны для ионов обеспечивают ионные каналы. Важнейшую роль в формировании мембранного потенциала играют ионы калия, натрия и хлора. Концентрации этих ионов видризняюються по обе стороны мембраны. Для нейрона млекопитающих концентрация K + составляет 140 ммоль внутри клетки и только 5 мМ извне, градиент концентрации Na + почти противоположный — 150 ммоль снаружи и 15 мМ внутри. Такое распределение ионов поддерживается натрий-калиевым насосом в плазматической мембране — белком использующий энергию АТФ для закачки K + в клетку и скачивания Na + из нее. Также существует концентрационный градиент и для других ионов, например, хлорид аниона Cl -.
Концентрационные градиенты катионов калия и натрия — это химическая форма потенциальной энергии. В преобразовании энергии в электрическую участвуют ионные каналы — поры формируются скоплениями специальных трансмембранных белков. Когда ионы диффундируют через канал, они переносят единицу электрического заряда. Любой суммарный движение положительных или отрицательных ионов через мембрану будет создавать напряжение, или разность потенциалов по обе стороны мембраны.
Ионные каналы, участвующие в утовренни МПС имеют избирательную проницаемость, то есть дают возможность проникать только определенному типу ионов. В мембране нейрона в состоянии покоя открытые калиевые каналы (те, что в основном пропускают только калий), большинство натриевых каналов — закрыты. Диффузия ионов K + через калиевые каналы является решающим для создания мембранного потенциала. Так как концентрация K + значительно выше внутри клетки, химический градиент способствует оттоку этих катионов из клетки, поэтому в цитоплазме начинают преобладать анионы, которые не могут проходить через калиевые каналы.
Отток ионов калия из клетки ограничен самым мембранным потенциалом, поскольку при определенном его уровне накопление отрицательных зарядов в цитоплазме будет ограничивать движение катионов за пределы клетки. Таким образом, главным фактором в возникновении МПС является распределение ионов калия под действием электрического и химического потенциалов.
Равновесный потенциал
Для того, чтобы определить влияние движения определенного иона через полупроницаемую мембрану на формирование мембранного потенциала, строят модельные системы. Такая модельная система состоит из сосуда разделенной на две ячейки искусственной полупроницаемой мембраной, в которую встроены ионные каналы. В каждую ячейку можно погрузить электрод и померить разность потенциалов.
Рассмотрим случай, когда искусственная мембрана проницаема только для калия. По две стороны мембраны модельной системы создают градиент концентрации аналогичный таковому у нейроне: в ячейку, соответствующую цитоплазме (внутренняя ячейка), помещают 140 мМ раствор хлорида калия (KCl), в ячейку, соответствующую межклеточной жидкости (внешняя ячейка) — 5 ммоль раствор KCl. Ионы калия будут диффундировать через мембрану во внешнюю ячейку по градиенту концентрации. Но поскольку анионы Cl — проникать через мембрану не могут во внутренней ячейке возникать избыток отрицательного заряда, который будет препятствовать подали оттока катионов. Когда такие модельные нейроны достигнут состояния равновесия, действие химического и электрического потенциала будет сбалансирована, ни суммарной диффузии К + не будет наблюдаться. Значение мембранного потенциала, виинкае при таких условиях, называется равновесным потенциалом для определенного иона (Е ион). Равновесный потенциал для калия составляет примерно -90 мВ.
Аналогичный опыт можно провести и для натрия, установив между ячейками мембрану проникающей только для этого катиона, и поместив во внешнюю ячейку раствор хлорида натрия с концентрацией 150 мМ, а во внутреннюю — 15 мМ. Натрий будет двигаться во внутреннюю ячейку, ривоноважний потенциал для него составит примерно 62 мВ.
Количество ионов, должна диффундировать для генерации электрического потенциала очень невелика (примерно 10 -12 моль К + на 1 см 2 мембраны), этот факт имеет два важных последствия. Во-прешь, это означает, что концентрации ионов, которые могут проникать через мембрану, остаются стабильными снаружи и внутри клетки, даже после того как их движение обеспечил утоврення электрического потенциала. Во-вторых, мизерные потоки ионов через мембрану, потирбно для установления потенциала, не нарушают электронейтральности цитоплазмы и внеклеточной жидкости в целом, распределение зарядов происходит только в области, непосредственно прилегающей к плазматической мембраны.
Уравнение Нернста
Равновесный потенциал для определенного иона, например для калия, можно рассчитать по уравнению Нернста, что выглядит так:

где R — универсальная газовая постоянная, Т — абслоютна температура (по шкале Кельвина), z — заряд иона, F — число Фарадея, [K +] o, [K +] i — концентрация калия снаружи и внутри клетки соответственно. Поскольку описанные процессы происходят при температуре тела — 310 ° К, а десятичными логарифмами в исчислении пользоваться легче чем натуральными, это уравнение превращают следующим образом:
Подставляя концентрации К + в уравнение Нернста получаем равновесный потенциал для калия, составляет -90 мВ. Поскольку по нулевой потенциал принимается внешняя сторона мембраны, то знак минус означает, что в условиях равновесного калиевого потенциала внутренняя Сторн мембраны сравнительно более электроотрицательным. Аналогичные расчеты можно провести и для равновесного Натиева потенциала, он составляет 62 мВ.
Уравнения Голдмана
Хотя равновесный потенциал для ионов калия составляет -90 мВ, МПС нейрона несколько менее отрицательный. Эта разница отражает незначительное но постоянное следование ионов Na + через мембрану в состоянии покоя. Поскольку концентрационный градиент для натрия противоположный такого для калия, Na + движется внутрь клетки и сдвигает суммарный заряд на внутренней стороне мембраны в положительную сторону. На самом деле МПС нейрона составляет от -60 до -80 мВ. Это значение значительно ближе к Е K чем до Е Na, потому что в состоянии покоя в нейроне открыто много калиевых каналов и очень мало натриевых. Также на встанвлення МПС влияет движение ионов хлора. В 1943 году Дэвид Голдаман предложил усовершенствовать уравнение Нернста так, чтобы оно отражало влияние различных ионов на мембарнний потенциал, в этом уравнении учитывается относительная проницаемость мембраны для каждого типа ионов:
где R — универсальная газовая постоянная, Т — абслоютна температура (по шкале Кельвина), z — заряд иона, F — число Фарадея, [ион] o, [ион] i — концентрации ионов внутри и внутри клеток, Р — относительная проницаемость мембраны для соответствующего иона. Значение заряда в данном уравнении не сохраняется, но оно учтено — для хлора внешняя и внутренняя концентрация поменяны местами, так как его заряд 1.
Значение мембранного потенциала покоя для различных тканей
- Разделенными мышцы -95 мВ;
- Непосмугованих мышцы -50 мВ;
- Астроглией от -80 до -90 мВ;
- Нейроны -70 мВ.
Роль натрий-калиевого насоса в формировании МПС
Мембранный потенциал покоя может существовать только при условии неравномерного распределения ионов, обеспечивается функционированием натрий-калиевого насоса. Кроме того, этот белок делает также электрогенных властовости — он переносит 3 катионы натрия в обмен на 2 ионы калия, движущихся внутрь клетки. Таким образом, Na + -K + -АТФазы снижает МПС на 5-10 мВ. Подавление деятельности этого белка приводит к незначительному (на 5-10 мВ) мгновенного повышения мембранного потенциала, после чего он еще некоторое время будет существовать на достаточно стабильном уровне, пока будут сохраняться градиенты концентраций Na + и K +. Впоследствии эти градиенты начнут уменьшаться, вследствие проникнсоти мембраны к ионам, и через несколько десятков минут электрический потенциал на мембране исчезнет.
Мембранный потенциал
Химический состав живых клеток отличается от внешней среды, причем различия есть не только в сложных молекулах, таких как белки и нуклеиновые кислоты, но и в ионах. Например, во внеклеточной среде преобладают ионы натрия, а в клетке — ионы калия, причем последних на порядок больше. Сама по себе плазматическая мембрана клеток практически непроницаема для ионов, и поэтому для их переноса через мембрану существуют специальные транспортные механизмы — встроенные в мембрану белки. В геноме человека более 800 генов ионных каналов и транспортеров, а общую долю генов, вовлеченных в трансмембранный транспорт, оценивают в 10 % от всех генов, кодирующих белки [1] . В этой серии статей мы рассмотрим механизмы трансмембранного переноса ионов и разнообразие реализуемых ими клеточных функций. Мы также уделим внимание патологиям, вызванным мутациями в генах, кодирующих соответствующие каналы и транспортеры.
Потенциал покоя
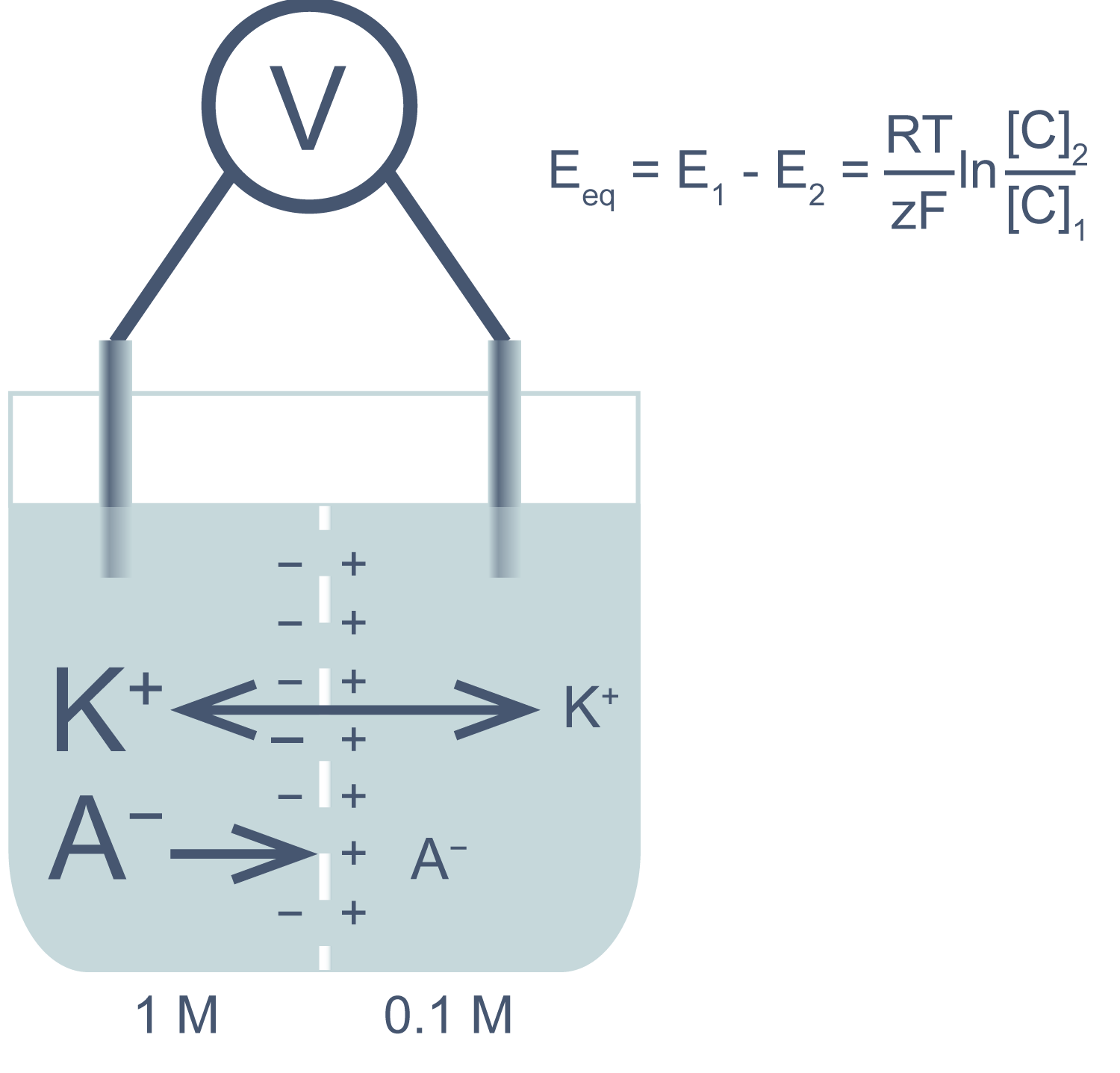
Представим себе электрохимическую ячейку — сосуд, разделенный пополам полупроницаемой мембраной, в левой части которого находится 1,0 М раствор KCl, а в правой — 0,1 М KCl. Через мембрану могут проходить катионы K + , но не анионы Cl − . Ионы K + в результате процесса диффузии будут переходить из левого отсека в правый по градиенту концентрации*, тогда как ионы Cl − , неспособные последовать за катионами, останутся в исходном отсеке. Благодаря такому разделению зарядов на мембране будет накапливаться электрохимический потенциал: избыток анионов с левой стороны мембраны и избыток катионов с правой. Этот потенциал можно измерить, опустив в отсеки электроды, подсоединенные к вольтметру.
Асимметричный поток катионов не будет продолжаться бесконечно: накопленный электрический потенциал (с избытком положительного заряда с левой стороны мембраны) будет противодействовать диффузии ионов калия в левый отсек. Через некоторое время поток ионов K + из правого отсека в левый сравняется по скорости с потоком из левого отсека в правый, и система достигнет равновесия. Для математического описания подобного равновесия применяют уравнение Нернста (рис. 1).
Рисунок 1 | Электрохимическая ячейка. V — вольтметр. Справа приведено уравнение Нернста, где Eeq — равновесный потенциал; E1 – E2 — разность потенциалов по обе стороны мембраны; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура (в кельвинах); F = 96485,55 Кл·моль –1 — константа Фарадея; z — степень окисления иона (его заряд); [C]1, 2 — равновесные концентрации ионов по обе стороны мембраны.
Если принять, что равновесные концентрации ионов K + в нашем примере равны начальным, разность потенциала на мембране при 25 °C приблизительно равна –58 мВ.
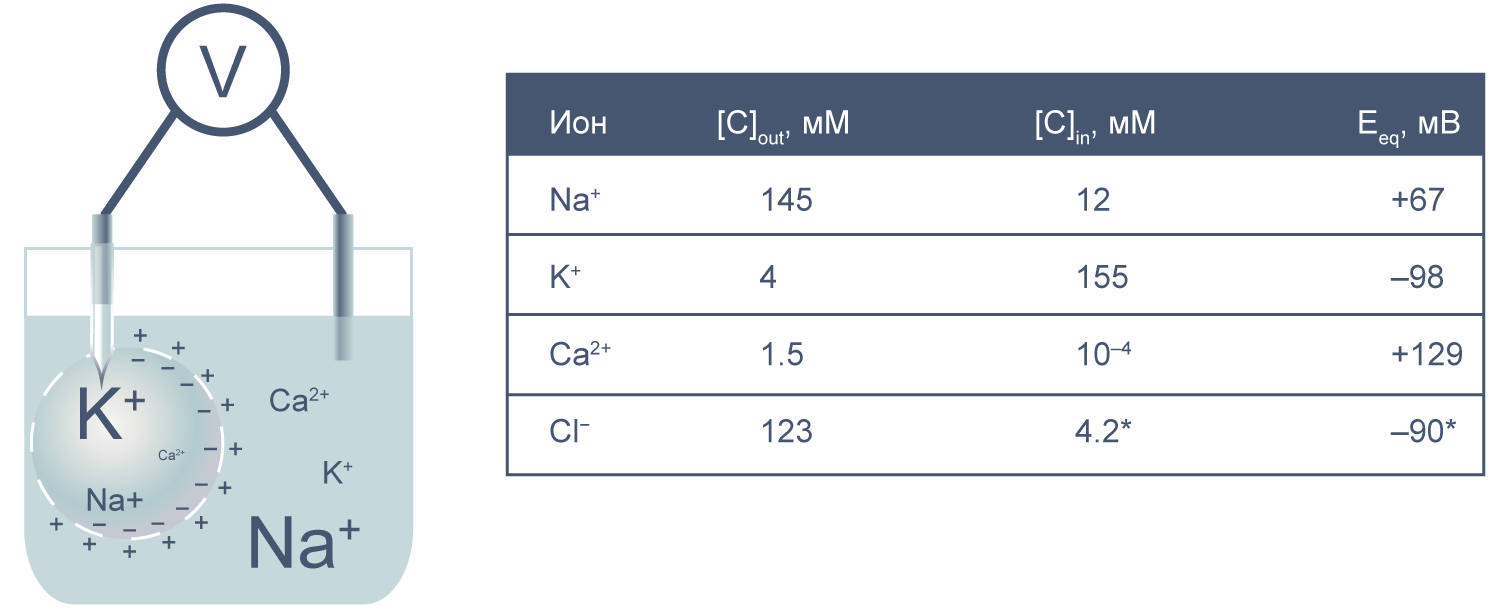
Рисунок 2 | Клетка как электрохимическая ячейка. Справа приведены концентрации основных ионов внутри и вне клетки [2] .
Теперь представим, что левая часть нашей электрохимической ячейки — это живая клетка, а правая — внешняя среда. Добавим к этой картине концентрации других физиологически значимых ионов. На мембране клетки также будет накапливаться электрохимический потенциал. Величину электрической составляющей мембранного потенциала измеряют относительно потенциала вне клетки, принимая его за ноль.
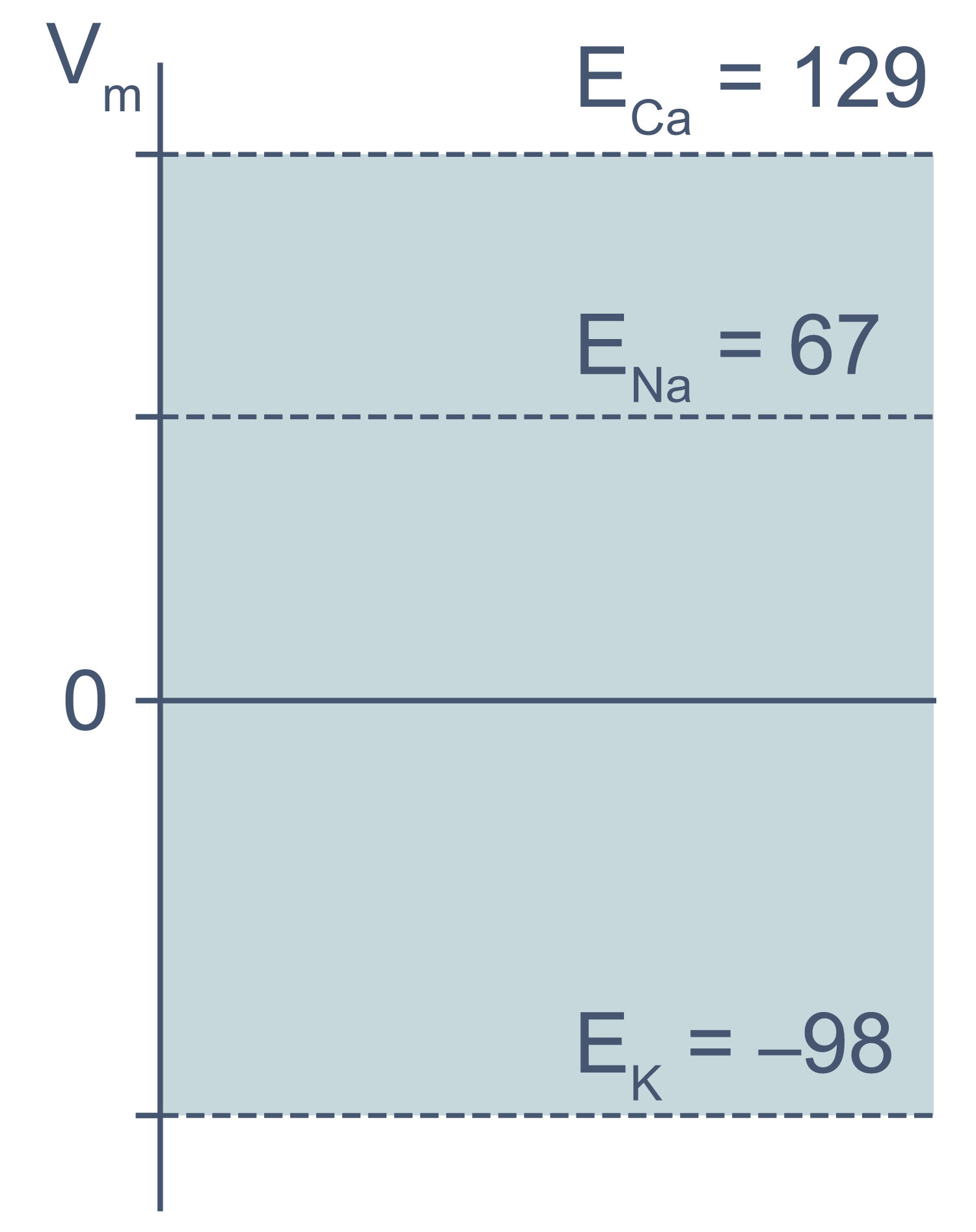
В первом приближении можно сказать, что мембрана клетки проницаема для калия и непроницаема для других катионов (Na + , Ca 2+ ) и анионов (в первую очередь для Cl – и отрицательно заряженных участков макромолекул). Ионы калия, выходя из клетки, создают потенциал покоя. Его величина достаточно близка к значению равновесного потенциала для K + , однако строго не равна ему, поскольку в реальности другие катионы и Cl – могут участвовать в формировании потенциала покоя в различных типах клеток. Вычислив равновесные потенциалы для основных ионов, мы получим динамический диапазон величины потенциала на мембране клетки: он не может быть более отрицательным, чем EK, и не может достигать более положительных значений на пике потенциала действия, чем ECa. Причина такого поведения кроется в том, что система стремится к равновесию, и при малейших отклонениях мембранного потенциала в сторону более отрицательных значений, чем EK, K + будет двигаться по электрохимическому градиенту внутрь клетки, возвращая мембранный потенциал к равновесному потенциалу для калия.
Рисунок 3 | Диапазон возможных значений мембранного потенциала от ЕK до ECa (показан голубым цветом).
Величина потенциала покоя зависит от типа клеток и равна около –30 мВ в невозбудимых клетках и около –80 мВ в возбудимых клетках (нейроны, мышечные и эндокринные клетки). Когда мембранный потенциал более отрицателен, чем потенциал покоя, говорят, что мембрана гиперполяризована, а когда он приближается к нулю или даже принимает положительные значения, говорят о деполяризации мембраны.
В общем случае мембранный потенциал можно вычислить согласно уравнению Гольдмана-Ходжкина-Катца, которое принимает в расчет все основные катионы и анионы:
где E — мембранный потенциал; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура; F = 96485,55 Кл·моль –1 — константа Фарадея; PX — проницаемость мембраны для иона X; [C]in, out — равновесные концентрации ионов внутри и вне клетки. N.B.: для анионов внеклеточная концентрация стоит в знаменателе, а внутриклеточная — в числителе.
Что же обеспечивает проницаемость мембраны для ионов? Заряженные частицы не могут самостоятельно пересекать гидрофобный внутренний слой плазматической мембраны, и поэтому требуются специальные белки, образующие гидрофильную пору, через которую ионы могут двигаться через мембрану. Такие белки называются ионными каналами. Основной вклад в поддержание потенциала покоя вносят калиевые каналы семейств Kir (inward rectifying K + channels — калиевые каналы внутреннего выпрямления) и K2P (two—pore domain K + channels — калиевые каналы с двумя поровыми доменами, которые часто называют каналами утечки), а каналы других семейств могут обеспечивать быстрое изменение мембранного потенциала в возбудимых клетках. Каналы могут селективно пропускать определенный тип ионов, например, K + (как каналы семейства Kir), или более широкий спектр веществ, как, например, коннексины — белки щелевых контактов.
Каналы бывают потенциал-зависимые (потенциал-управляемые), лиганд-зависимые, термо- и механочувствительные — в зависимости от стимула, который управляет открытием и закрытием канала. В роли стимула, таким образом, могут выступать изменения мембранного потенциала, химические агенты, температура, свет, механические и другие стимулы. Один и тот же канал может открываться под действием различных эндо- и экзогенных стимулов. Так, канал TRPV1 активируется повышением температуры более 43 °C [3] , кислым pH [4] и разнообразными химическими веществами: капсаицином (алкалоид из перцев рода Capsicum) [3] , эндоканнабиноидом анандамидом [5] , окситоцином [6] и др.
Физиологическая роль каналов крайне важна. К примеру, мутации в генах, кодирующих белки ионных каналов, лежат в основе патогенеза многих заболеваний человека: некоторых видов эпилепсии [7] , муковисцидоза [8] , некоторых аритмий [9, 10] и др. Ионные каналы служат мишенями действия многих лекарств, ядов и токсинов.
Однако для формирования потенциала покоя недостаточно одних лишь каналов, ведь нужно создавать и поддерживать концентрационные градиенты на мембране. Основной механизм поддержания градиентов концентрации калия и натрия — это Na/K-АТФаза, фермент, за счет гидролиза одной молекулы АТФ переносящий три Na + наружу и два K + внутрь клетки. Она осуществляет электрогенный транспорт: в каждом транспортном цикле при переносе одного дополнительного положительного заряда наружу генерируется некоторая разность потенциалов на мембране. Чтобы оценить этот вклад Na/K-АТФазы в поддержание потенциала покоя, можно заблокировать работу фермента алкалоидом оубаином. Тогда мембрана деполяризуется примерно на 10 мВ [11] .
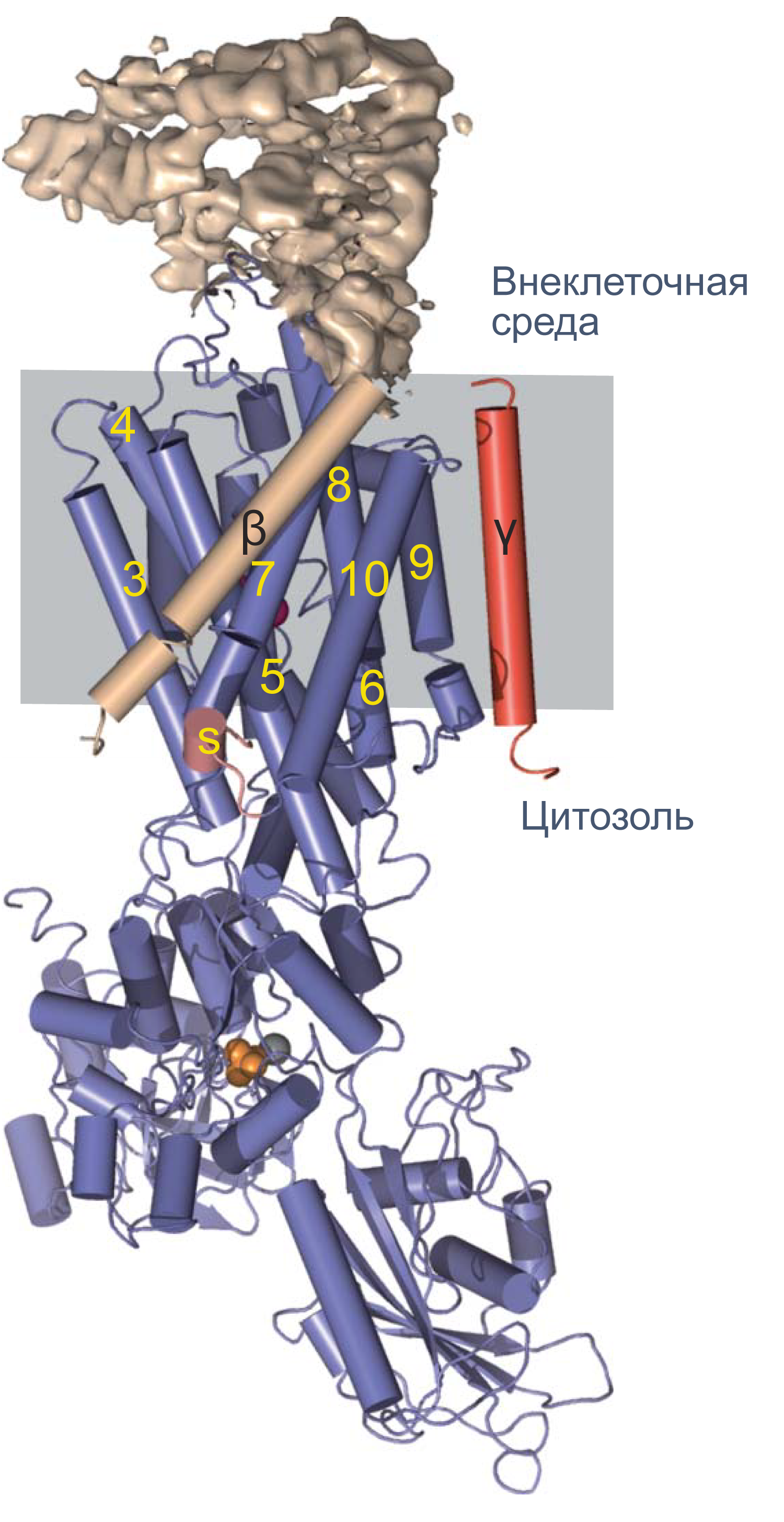
Рисунок 4 | Структура Na/K-АТФазы, полученная методом рентгеновской кристаллографии. Синим цветом показана α-субъединица, красным — γ-субъединица; β-субъединица показана бежевым цветом. Внеклеточная часть β-субъединицы показана в виде электронной плотности. Альфа-спирали изображены цилиндрами, бета-слои — плоскими стрелками [12] .
Активный и пассивный транспорт веществ через мембрану
Процессы транспорта веществ через мембрану можно классифицировать по источнику энергии для транспорта. Пассивный транспорт — это движение вещества через канал или транспортер по градиенту концентрации*, то есть за счет энергии электрохимического градиента. Таким способом через калиевые каналы пассивно движутся ионы калия, или осуществляется перенос глюкозы через транспортер GLUT4 (такой тип транспорта еще называют облегченной диффузией, а транспортеры, переносящие только один субстрат — унипортерами). Кроме пассивного транспорта, существует активный транспорт, при котором субстраты переносятся против градиента концентрации с затратой энергии, запасенной клеткой в виде АТФ (например, Na/K-АТФаза).
Некоторые транспортеры сопрягают перенос ионов или молекул против градиента концентрации с движением ионов по градиенту концентрации. Симпортеры переносят различные частицы в одном направлении (например, KCC2 — K—Cl cotransporter 2 — K/Cl котранспортер 2), а антипортеры, или обменники, — в противоположных (например, NHE-1 — Na/H exchanger 1 — Na/H обменник, участвующий в поддержании клеточного pH). Такой транспорт называется вторично-активным.
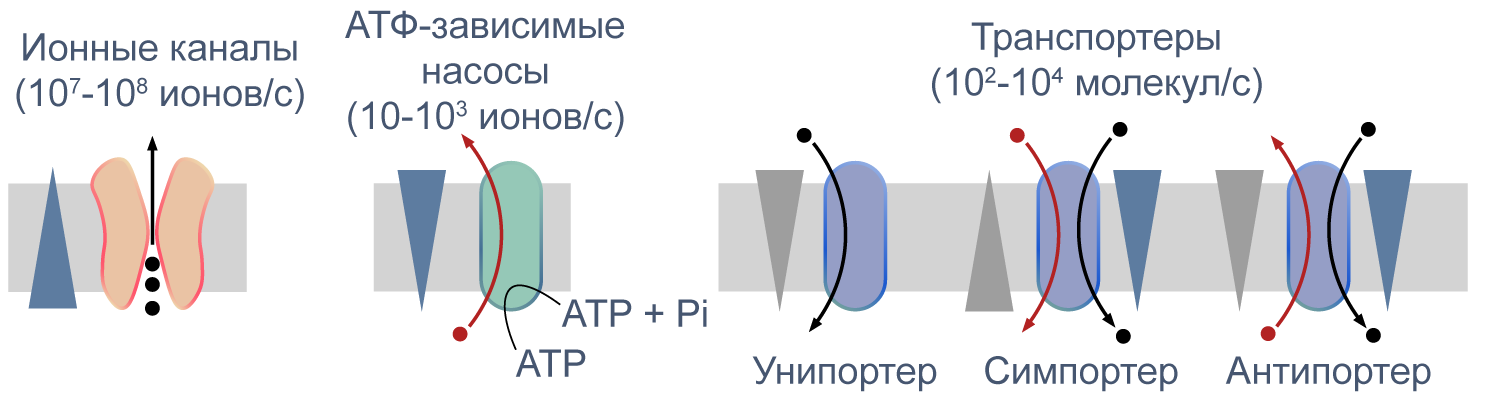
Рисунок 5 | Пассивный и активный транспорт веществ через мембрану. Треугольниками показаны концентрационные градиенты. Черными стрелками показано движение по градиенту концентрации, красными — против градиента концентрации. По [13], с изменениями.
В старой литературе можно встретить концепцию «белков-переносчиков»: до открытия молекулярной идентичности многих каналов и транспортеров (т. е. какая молекула опосредует данный ионный ток и какой ген ее кодирует) существовало представление о переносчиках как о челноках, связывающих субстраты с одной стороны мембраны, диффундирующих через мембрану и высвобождающих субстраты с другой стороны. Однако, когда стали известны аминокислотные последовательности транспортных белков, стало понятно, что все они часто содержат многочисленные трансмембранные домены и образуют сквозной путь через мембрану.
Различия между каналами, транспортерами и насосами заключаются в механизме их работы и регуляции. Каналы представляют собой более или менее селективную пору, через которую ионы могут свободно диффундировать, не вызывая конформационных изменений в белке канала. При токе через отдельный канал в 1 пА по нему проходят 6×10 6 одновалентных ионов в секунду. Транспортер, связываясь с субстратом, изменяет свою конформацию для переноса субстрата. При ко-транспорте повышается аффинность транспортера в новой конформации к второму субстрату, и субстраты переносятся через мембрану сопряженно. Насосы, также называемые АТФазами, (ауто)фосфорилируются АТФ, и это фосфорилирование значительно изменяет их конформацию и приводит к транслокации субстратов через мембрану. Электрическая проводимость насосов очень мала: Na/K-АТФаза переносит всего около 300 Na + и 200 K + в секунду.
Граница между молекулами каналов и транспортеров не всегда строга. Например, семейство хлоридных каналов и транспортеров ClC (англ. Chloride Channel) включает в себя гомологичные друг другу каналы (ClC-1, 2, Ka и Kb) и Cl/H-обменники (ClC-3–7), которые можно превратить в каналы, внеся мутацию в единственный остаток глутамата (т. н. gating glutamate — воротный глутамат) [14]. Na/K-АТФазу также можно превратить в простую пору, например, с помощью палитоксина [15] . Хлоридный канал CFTR относится к группе ABC-транспортеров, однако он использует энергию АТФ не для транспорта ионов, а для регуляции открытия и закрытия канала [16] . Кроме того, существуют данные о том, что везикулярный транспортер глутамата VGLUT1 кроме обмена глутамата на протоны также опосредует не сопряженный с обменом ток Cl − [17] .
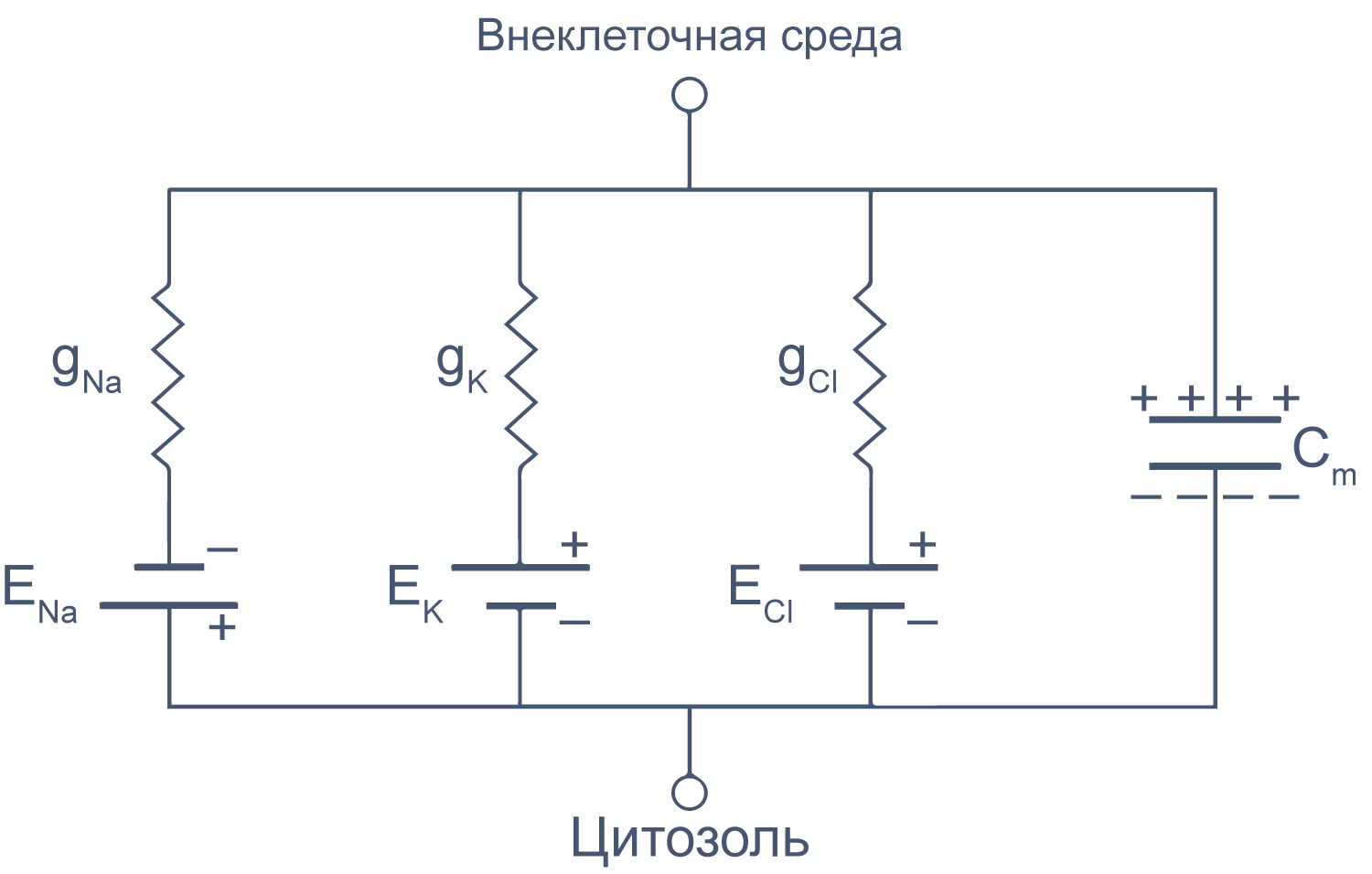
Клеточная мембрана как электрическая цепь
Липидный бислой мембраны можно представить как резистор (сопротивление) и конденсатор (емкость), соединенные параллельно. Величина сопротивления зависит от плотности каналов в мембране и их функционального состояния. Электроемкость возникает из-за разделения зарядов по обе стороны мембраны тонким слоем диэлектрика (гидрофобными хвостами фосфолипидов).
Рисунок 6 | Плазматическая мембрана, представленная в виде RC схемы. gNa, gK, gCl — проводимость** мембраны для ионов Na + , K + и Cl – , соответственно; ENa, EK, ECl — электродвижущая сила, или равновесные потенциалы для соответствующих ионов, Сm — электроемкость мембраны.
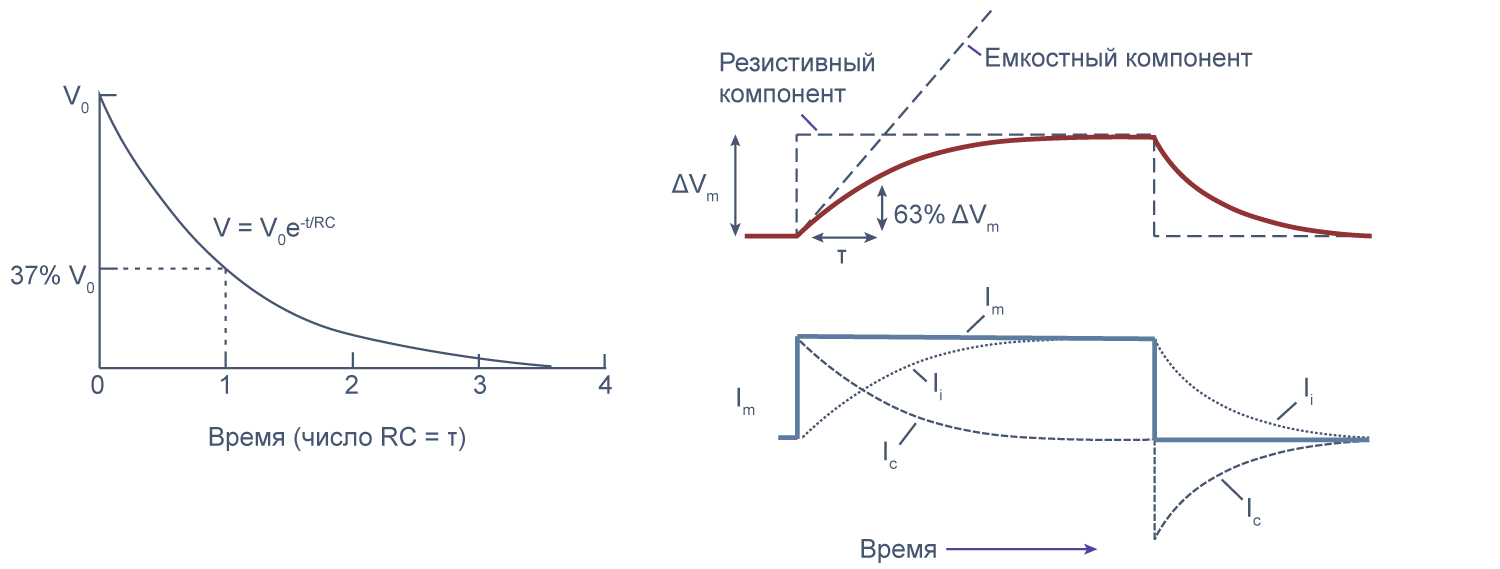
Можно считать, что проводимость (величина, обратная сопротивлению, измеряемая в сименсах) характеризует проницаемые для ионов компоненты структуры мембраны, а емкость — не проницаемые для ионов структуры. Удельная емкость мембраны составляет приблизительно 1 мкФ/см 2 или 0,01 пФ/мкм 2 *** и мало зависит от типа клеток [2] . Это позволяет оценить размер клетки по ее электрическим характеристикам. Высокая электроемкость клеточных мембран задерживает изменения потенциала в ответ на ток. Эту задержку можно выразить через постоянную времени τ, которая равна произведению емкости и параллельно соединенного с ней сопротивления (RC). Если конденсатор зарядить на некоторую величину, а затем дать ему разрядиться через резистор, то потенциал будет убывать экспоненциально согласно формуле V = V0e –t/RC , то есть за каждые τ = RC секунд потенциал будет падать в 1/e раз (на 37 % от исходной величины). Этот расчет применим и к клеточной мембране: падение напряжения при разрядке мембраны будет подчиняться экспоненциальному закону. То есть, если приложить гипер- или деполяризующий стимул, то мембранный потенциал через время τ достигнет 63 % конечного сдвига.
Рисунок 7 | Падение напряжения при разрядке мембраны. Изменение мембранного потенциала при деполяризации мембраны на ΔVm [22] , Ic — емкостный ток, Ii — ионный ток, Im — суммарный ток через мембрану. Пояснения в тексте.
Потенциал действия
Возбудимые клетки могут быстро изменять потенциал на мембране и этим запускать внутриклеточные процессы, например, мышечное сокращение или экзоцитоз везикул. Кратковременный локальный скачок мембранного потенциала от приблизительно –80 мВ (значения потенциала покоя) до 0…+20 мВ за счет изменения проницаемости мембраны для ионов называется потенциалом действия.
Для начала рассмотрим потенциал действия в аксонах нейрона на примере гигантского аксона кальмара. Выбор столь экзотического объекта обусловлен историческими причинами. Современная микроэлектродная техника — использование тонких стеклянных микропипеток, заполненных раствором электролита, — была предложена лишь в 1949 году Дж. Лингом и Р. Джерардом [18] . До этого поместить электрод, представлявший собой тонкую проволоку, внутрь клетки, не разрушив ее, можно было только в случае ее крупных размеров. Гигантский аксон кальмара стал идеальным модельным объектом для изучения потенциала действия: его диаметр может достигать 0,5–1 мм. Этот отросток служит для быстрой передачи нервных импульсов у беспозвоночных, у которых отсутствует миелинизация. Внутренним содержимым аксона легко манипулировать, заменяя ионный состав внутриклеточного раствора, а внутрь такого аксона можно поместить электрод для регистрации мембранного потенциала.
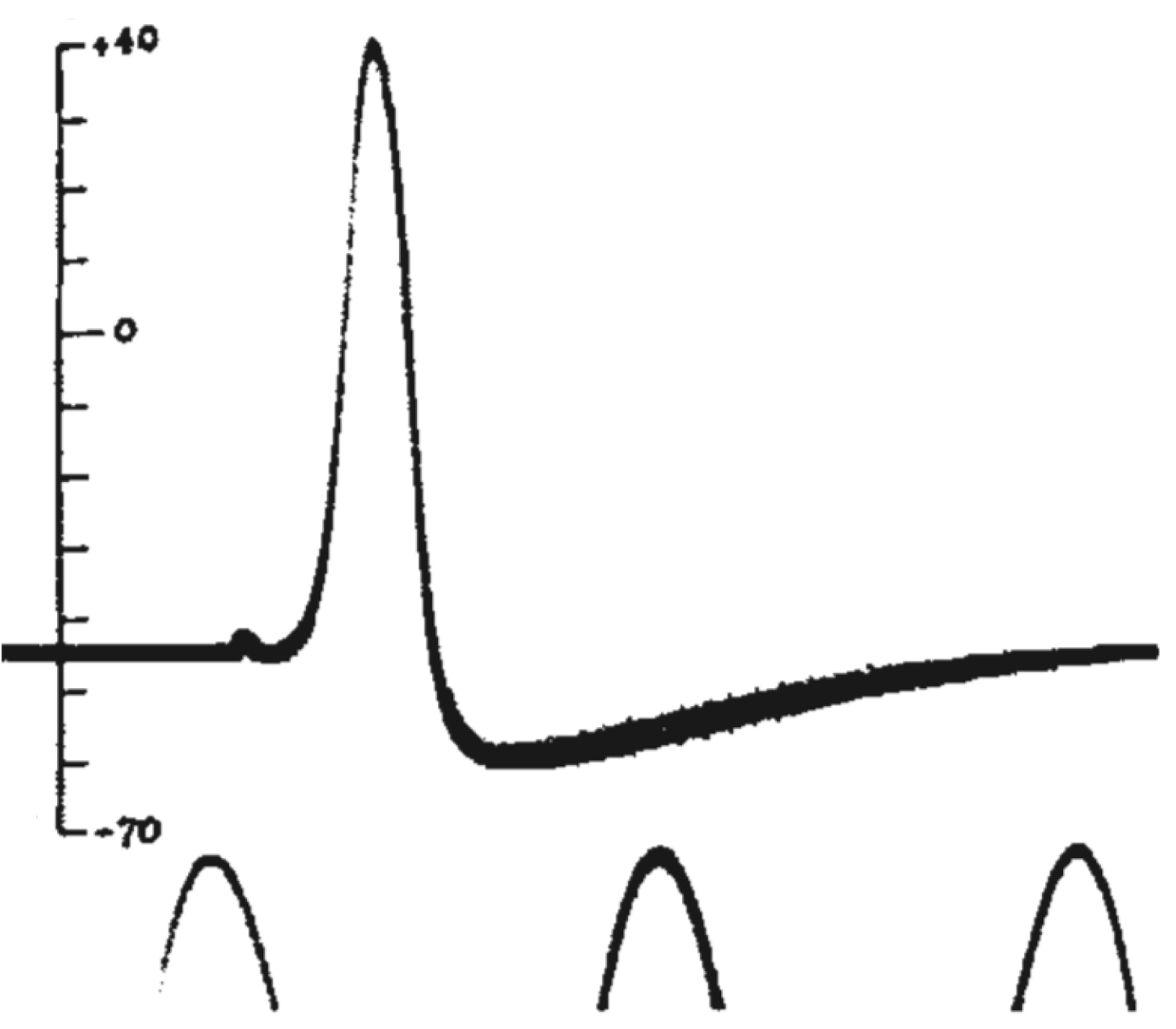
Так, в 1939 году А. Ходжкин и Э. Хаксли опубликовали в журнале Nature короткую заметку «Потенциалы действия, зарегистрированные внутри нервного волокна» [19] , в которой они описали первый эксперимент по внутриклеточному измерению мембранного потенциала на гигантском аксоне кальмара. Посмотрим на потенциалы действия, которые зарегистрировали исследователи.
Рисунок 8 | Потенциал действия из статьи А. Ходжкина и Э. Хаксли 1939 года [19] . Потенциал действия был зарегистрирован как разность потенциала между внутренней средой аксона и внешней средой. Пики внизу рисунка — это фрагменты синусоидального сигнала с частотой 500 Гц. Вертикальной чертой отмечен потенциал внутреннего электрода в милливольтах, потенциал морской воды снаружи аксона был принят за ноль.
Мы видим резкую деполяризацию мембраны до положительных значений, а затем более плавное возвращение потенциала к отрицательным значениям, зачастую более отрицательным, чем величина потенциала покоя. Из этих наблюдений следовало два важных вывода: 1) потенциал действия генерируется мембраной клетки, что не было очевидно в 1930-е годы; 2) поскольку измеренная амплитуда потенциала действия была больше величины мембранного потенциала, генерация потенциала действия — это активный процесс, который нельзя объяснить временным «пробоем» в мембране (каким бы наивным такое представление нам не казалось сегодня, в 1930-е так думали многие физиологи). В том же году К. С. Коул и Х. Дж. Кертис [20] зарегистрировали кратковременное изменение проводимости мембраны с 1 мСм/см 2 до 40 мСм/см 2 при генерации потенциала действия. Эти данные также свидетельствовали о тонкой регуляции этого процесса.
После Второй мировой войны Ходжкин и Хаксли вернулись к своим исследованиям. В 1945 году они опубликовали статью с несколькими дополнительными экспериментами, подтверждающими сформулированные ранее выводы. Но и тогда ионные механизмы потенциала действия оставались неясными.
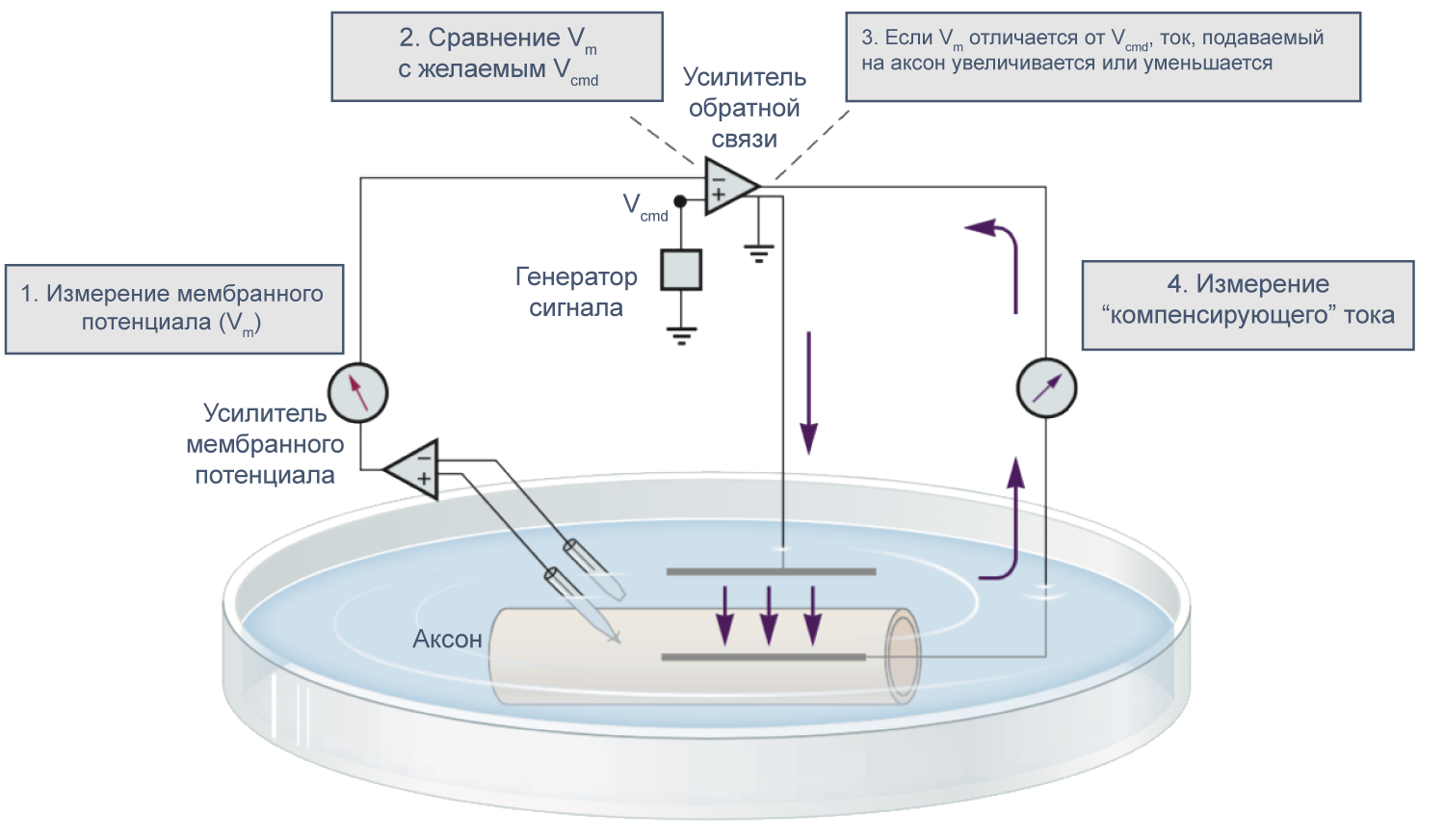
В 1952 году вышла серия статей, посвященных разгадке механизма генерации потенциала действия. Ведущую роль в этом открытии сыграл новый метод фиксации потенциала с помощью двух электродов (в англоязычной литературе TEVC — two-electrode voltage clamp), разработанный в конце 1940-х годов К. С. Коулом и Дж. Мармонтом [21] . Этот метод позволяет измерять не только потенциал, но и токи при заданном значении мембранного потенциала. Как же осуществляется фиксация потенциала с помощью двух электродов на заданном уровне (Vcmd — «командный потенциал»)? В клетку помещают два электрода, один из которых измеряет потенциал (относительно внеклеточного электрода сравнения) и передает его значение на специальный усилитель, который сравнивает измеренный потенциал со значением командного потенциала. Это устройство вычисляет ток, необходимый для компенсации этой разницы, и подает через второй внутриклеточный электрод ток такой величины, чтобы потенциал на мембране клетки стал равен Vcmd (Vm = Vcmd). Из амплитуды тока, необходимого для компенсации сдвига потенциала до Vcmd, можно сделать вывод о токе через мембрану при данном значении мембранного потенциала. Ток при данном значении потенциала равен току, подаваемому на второй электрод, взятому с обратным знаком.
Рисунок 9 | Схема фиксации потенциала с помощью двух электродов [21] .
В 1970–80-х годах Эрвин Неер и Берт Сакман (Erwin Neher, Bert Sakmann) предложили метод локальной фиксации потенциала (англ. patch clamp), позволяющий работать с мелкими клетками и токами малой амплитуды и даже регистрировать активность отдельных каналов. Тем не менее, метод фиксации потенциала двумя электродами в микроэлектродной конфигурации используется и сегодня при работе с такими крупными клетками, как ооциты лягушки Xenopus laevis.
Временной ход потенциала действия
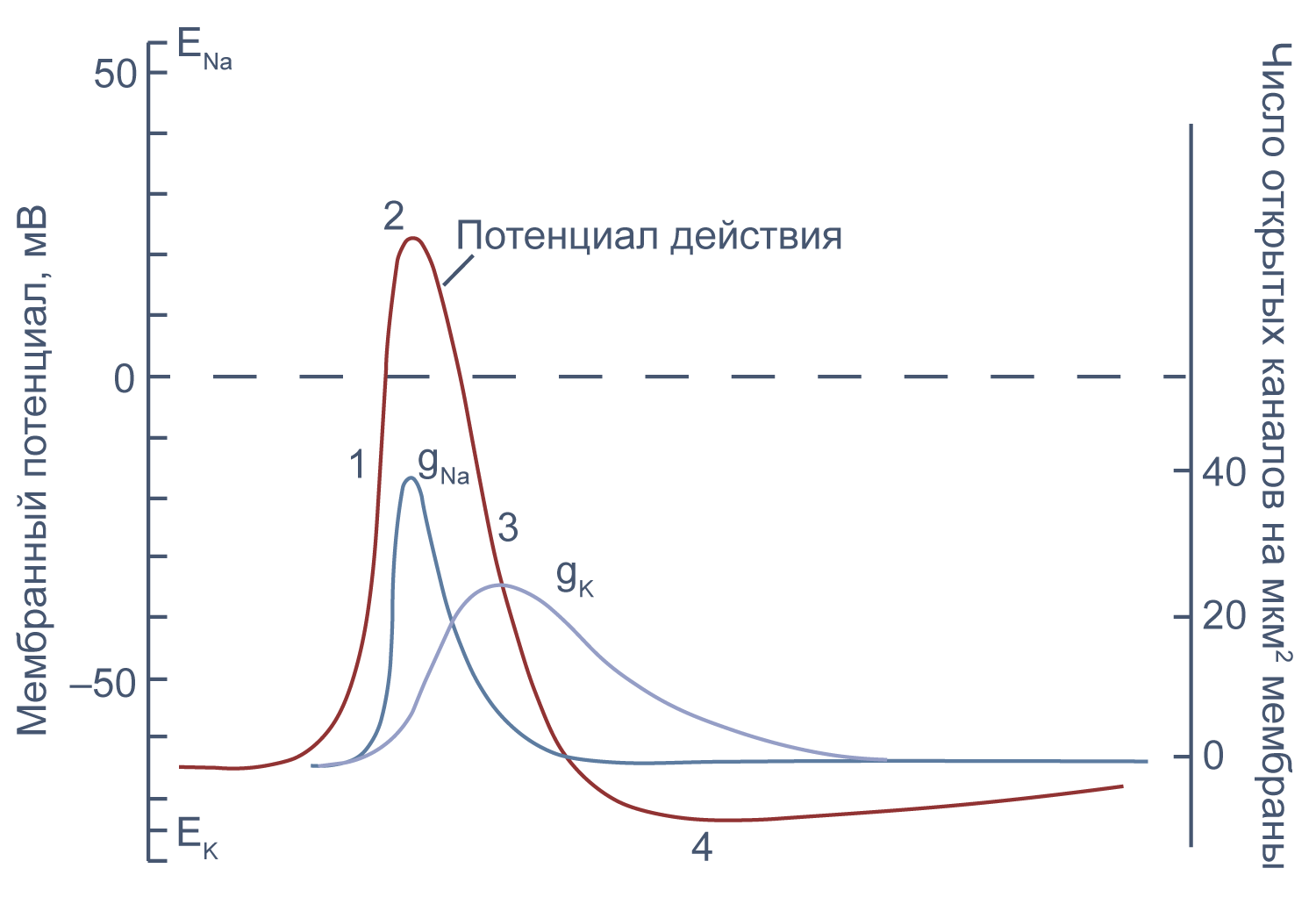
Потенциал действия в аксоне можно разделить на 1) фазу быстрой деполяризации до 2) положительных значений (овершута, от англ. overshoot), 3) фазу реполяризации, в которой потенциал возвращается к потенциалу покоя или даже до несколько более отрицательных значений — 4) следовая гиперполяризация.
Рисунок 10 | Потенциал действия и изменения проводимости мембраны для Na + и K + в гигантском аксоне кальмара. Из [22], с изменениями.
Изменяя ионный состав внутри- и внеклеточного раствора, можно изолировать ионные токи, которые опосредуют изменение мембранного потенциала при потенциале действия. Так, помещая аксон в раствор, в котором натрий заменен на холин, можно изолировать натриевый и калиевый компонент потенциала действия, то есть отдельно измерить калиевый ток [20] . Этого же можно достичь применением блокаторов потенциал-зависимых натриевых и калиевых каналов — тетродотоксина и тетраэтиламмония (TEA).
Чтобы понять взаимосвязь ионных токов и вызванных ими изменений потенциала, рассмотрим всю цепь событий при генерации потенциала действия. Сначала мембрана деполяризуется под действием внешнего стимула: поступления в клетку катионов через лиганд-управляемые каналы, закрытия калиевых каналов или электрической стимуляции в эксперименте. Если деполяризация достигает порогового значения для потенциалзависимых натриевых каналов (Nav), они открываются, натрий по градиенту своей концентрации входит в клетку, и мембрана деполяризуется еще сильнее. Дальнейшая деполяризация влечет за собой лавинообразное открытие все новых натриевых каналов, ток через которые приводит к еще большей деполяризации. Однако эта петля положительной обратной связи не работает бесконечно: открывшись на некоторое время, натриевые каналы инактивируются и не могут открыться вновь, пока мембранный потенциал не вернется к отрицательным значениям.
Механизм инактивации был предложен еще в математической модели Ходжкина и Хаксли [23] на основании кинетических характеристик тока. Они предположили, что в натриевом канале есть три активационные частицы m и одна инактивационная частица h. Когда стала известна аминокислотная последовательность канала, выяснилось, что канал на самом деле имеет четыре гомологичных активационных домена и один инактивационный, однако один из активационных доменов срабатывает значительно медленнее остальных трех, и его влияние на кинетические характеристики тока маскируется происходящей в то же время инактивацией канала (например, [24]).
В то же время деполяризация мембраны приводит к активации потенциал-зависимых калиевых каналов (Kv), которые открываются медленнее, чем натриевые, калий выходит из клетки, и потенциал возвращается к потенциалу покоя и может даже временно стать более отрицательным: пока натриевые каналы инактивированы, потенциал становится ближе к калиевому равновесному потенциалу, и это явление называется следовой гиперполяризацией.
Генерация потенциала действия происходит по принципу «все или ничего». Если деполяризующий стимул не достиг порогового значения, потенциал действия не генерируется. Если же порог был достигнут, положительная обратная связь обеспечивает открытие всех доступных натриевых каналов, и потенциал действия достигает своей максимальной амплитуды.
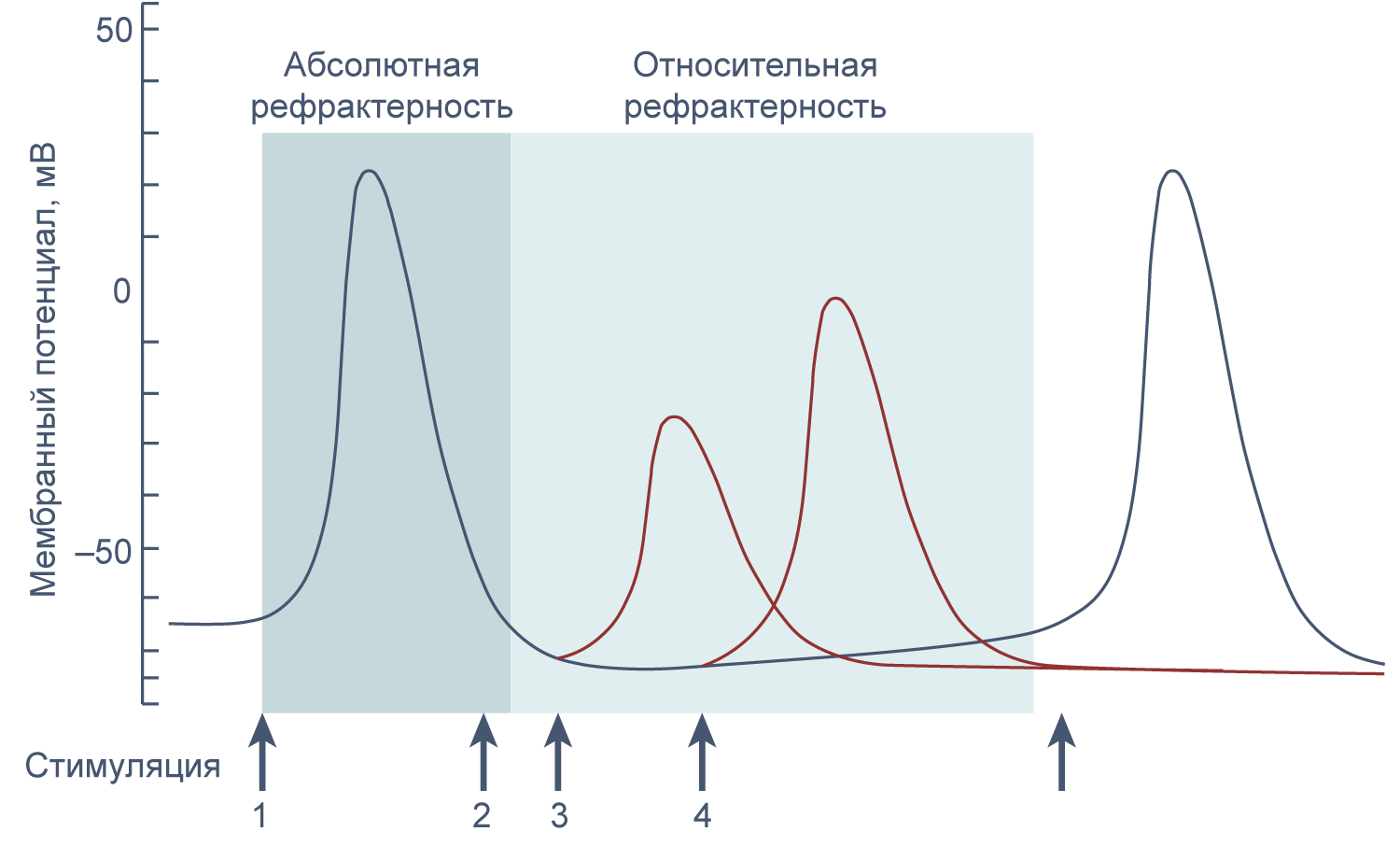
Если новый стимул приходит во время или сразу после генерации потенциала действия, второй потенциал действия не возникает или обладает меньшей амплитудой, чем первый. Это явление называется рефрактерностью. Стимул, возникший в период абсолютной рефрактерности, не вызывает генерации потенциала действия, а пришедшийся на период относительной рефрактерности вызывает потенциал действия уменьшенной амплитуды, так как часть натриевых каналов все еще инактивирована.
Рисунок 11 | Абсолютная и относительная рефрактерность. Стимуляция в период абсолютной рефрактерности (2) не ведет к генерации потенциала действия, а стимуляция в период относительной рефрактерности (3 и 4) приводит к генерации потенциала действия сниженной амплитуды.
Стоит отметить, что внутриклеточная концентрация физиологически значимых ионов при генерации потенциала действия не меняется, и ионные токи задействуют пренебрежимо малую долю от общего числа Na + и K + . Это можно проиллюстрировать следующим примером. Рассчитаем число ионов, которое должно пересечь мембрану для деполяризации на 100 мВ. Заряд на мембране равен произведению емкости мембраны и потенциала: Q = CmVm. Удельная емкость мембраны близка к 1 мкФ/см 2 , а сдвиг потенциала в нашем случае равен 0,1 В. Тогда количество разделенных зарядов равно Q = 10−6 Ф/см 2 × 0,1 В = 10−7 Кл/см 2 . Величина заряда одного иона Na + или K + (элементарного заряда) равна 1,6 × 10−19 Кл, тогда количество переносимых через мембрану ионов равно 10−7 Кл/см 2 / 1,6 × 10−19 Кл = 6,25 × 1011 ионов/см 2 , или 6250 ионов/мкм 2 . Для клетки диаметром 10 мкм площадь поверхности мембраны будет приблизительно равна 4πr 2 = 314 мкм 2 (в этом расчете для простоты мы считаем клетку гладкой сферой), а объем — 4πr 3 /3 = 524 мкм 3 . При внутриклеточной концентрации Na + 10 мМ, а K + 150 мМ содержание этих ионов в цитозоле будет равно 3,2 × 109 и 4,7 × 1010 соответственно. В течение одного потенциала действия приблизительно 314 мкм 2 × 6,250 ионов/мкм 2 ≈ 2 000 000 ионов Na + входит в клетку в фазе деполяризации и примерно столько же ионов K + выходит из клетки в фазе реполяризации, что составляет всего 0,06 % от общего числа ионов натрия в клетке. Токи такой величины обычно не изменяют макроскопические концентрации ионов в клетке, поскольку работа Na/K-АТФазы компенсирует эти незначительные изменения. Однако при определенных условиях концентрации Na + и K + все же могут измениться, например, при продолжительной стимуляции аксонов с малым диаметром [25] .
Распространение возбуждения по аксону
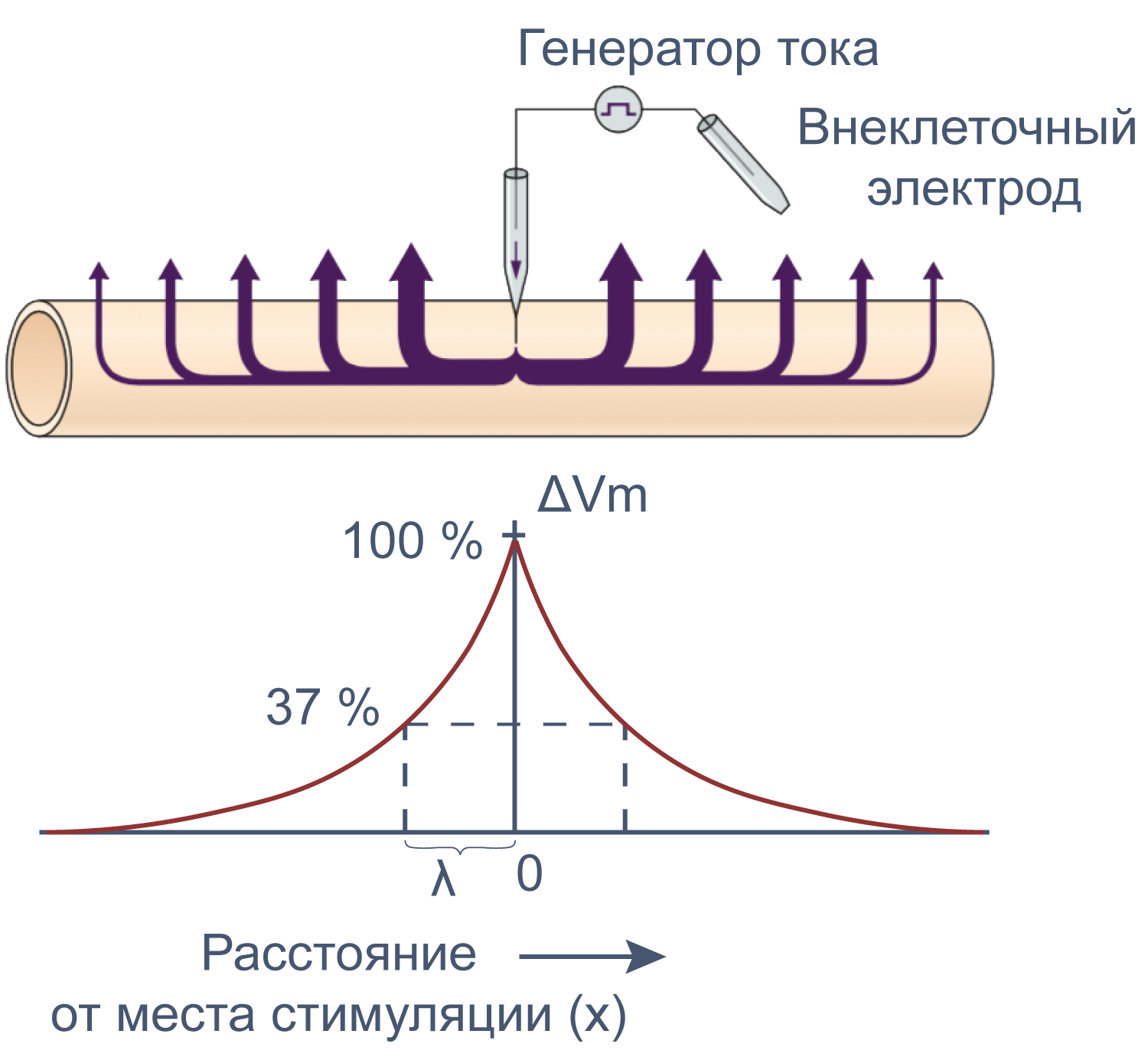
Электрические свойства мембраны помогают понять изменения мембранного потенциала не только во времени, но и в пространстве. Пассивное, или электротоническое распространение возбуждения по мембране происходит без изменения проводимости потенциал-зависимых каналов. Для распространения потенциала действия важен как активный (изменение проводимости натриевых и калиевых каналов), так и пассивный механизмы, поскольку деполяризация, вызывающая открытие новых потенциал-зависимых натриевых каналов, должна достигнуть нового невозбужденного участка аксона, и происходит это благодаря электротоническому распространению возбуждения.
Рисунок 12 | Электротоническое распространение возбуждения. Пояснения в тексте [22].
Сдвиг потенциала в точке, отстоящий на x от места стимуляции, можно вычислить как Ex = E0e –x/λ , где E0 — это сдвиг потенциала в точке стимуляции, а λ — постоянная длины.
Постоянная длины возрастает с увеличением сопротивления мембраны (rm) и уменьшается с возрастанием сопротивления аксоплазмы (ri), которое в свою очередь зависит от концентрации подвижных зарядов в объеме аксона. Знание этих закономерностей позволяет понять зависимость скорости распространения возбуждения от радиуса (R) аксона. Сопротивление мембраны rm пропорционально 1/2πR, сопротивление аксоплазмы ri — 1/πR 2 , а емкость мембраны Cm пропорциональна R. По мере увеличения радиуса аксона и rm, и ri уменьшаются, но ri уменьшается сильнее. Постоянная длины увеличивается, следовательно, сдвиг потенциала может распространяться по более крупному аксону дальше. Кроме того, увеличение радиуса аксона ведет к увеличению емкости мембраны, однако этот эффект нивелируется тем, что емкость с увеличением радиуса растет линейно, а уменьшение ri пропорционально квадрату радиуса. Таким образом, проводимость аксоплазмы увеличивается быстрее (при снижении ri), чем растет емкость мембраны, и это позволяет току быстрее достигать невозбужденных участков мембраны более крупного аксона.
Зависимость скорости распространения потенциала действия по аксону от его диаметра объясняет необходимость в гигантских аксонах у кальмара. Однако у позвоночных гигантских аксонов нет, и достаточная скорость проведения нервных импульсов достигается с помощью миелинизации аксонов. Миелиновые оболочки образованы специальными глиальными клетками: олигодендроцитами в центральной нервной системе и клетками Шванна в периферической. Эти клетки оборачивают аксон, образуя вокруг него плотный чехол из десятков слоев плазматической мембраны, который работает как изолятор. Под миелиновой оболочкой очень мало или почти нет натриевых каналов. Они оказываются расположены на небольших участках мембраны аксона между двумя соседними шванновскими клетками или олигодендроцитами — в перехватах Ранвье. Миелиновая оболочка увеличивает скорость проведения потенциала действия благодаря повышению сопротивления мембраны rm. При этом снижаются потери тока через мембрану, и деполяризация может пассивно распространяться на бо́льшие расстояния. Кроме того, из-за снижения емкости мембраны Cm, меньшая доля тока тратится на перезарядку мембраны. Миелинизация делает передачу потенциала действия не только быстрее, но и эффективнее, поскольку натриевые каналы располагаются только в перехватах Ранвье, благодаря чему меньшее количество ионов натрия входит в клетку и меньше энергии требуется на работу Na/K АТФ-азы для поддержания концентрационного градиента.
Потенциалы действия в других возбудимых клетках
Минималистичный натриево-калиевый потенциал действия характерен только для аксонов нейронов. В других частях нейрона и в иных типах возбудимых клеток в генерации потенциала действия принимают участие разнообразные ионные каналы, в том числе калиевые каналы других семейств и кальциевые каналы плазматической мембраны и эндоплазматического ретикулума (ЭПР является внутриклеточным депо кальция; общая концентрация Ca 2+ в нем достигает миллимолярных значений, а концентрация свободного кальция находится в микромолярном диапазоне [26] ; эти значения на несколько порядков выше, чем 100 нМ свободного Ca 2+ в цитозоле в состоянии покоя). Различия в экспрессии генов ионных каналов в различных типах возбудимых клеток порождают разнообразие потенциалов действия, различающихся ионными механизмами, длительностью (от 1,5 мс в аксонах до 500 мс в кардиомиоцитах желудочков), необходимостью внешнего стимула для генерации или наличием собственного ритма. Многие ионные каналы, не участвуя напрямую в генерации потенциала действия, влияют на возбудимость клеток и таким образом вносят вклад в разнообразие электрической активности клеток.
* Принятое в физиологической литературе употребление фраз «по» или «против градиента концентрации» расходится с физическим понятием градиента. В математике и физике градиент направлен в сторону наибольшей скорости возрастания функции или величины; так, если вещество движется в направлении этого вектора, то физиологи говорят о движении «против градиента концентрации», а если в противоположном направлении — то «по градиенту концентрации». Такое словоупотребление прочно закрепилось в литературе, но пусть оно не сбивает вас с толку, когда вы размышляете, откуда взялся минус перед градиентом концентрации в уравнении диффузионного потока (уравнении Фика): J = — D dC/dx, где J — диффузионный поток [моль∙см -2 ∙с -1 ], D — коэффициент диффузии [см 2 ∙с -1 ], а dC/dx— градиент концентрации.
** Проводимость (g = 1/R) — это характеристика скорости движения любых зарядов через мембрану, а проницаемость (P) отражает, насколько легко частицы могут двигаться через мембрану независимо от того, движутся они или нет. Для ионов эти величины связаны. Например, в фазе быстрой деполяризации при потенциале действия возрастает как проводимость, так и проницаемость мембраны для ионов натрия. Однако зачастую, если проницаемость канала для какого-то иона высока из-за высокого сродства участков поры канала для этого иона, такие ионы будут двигаться через канал медленнее, и проводимость будет ниже, чем для других ионов, для которых канал менее проницаем.
*** Удельная емкость чистого липидного бислоя составляет около 0,8 мкФ/см 2 , разница между электроемкостью мембраны и липидного бислоя возникает из-за обилия встроенных в мембрану белков.
http://info-farm.ru/alphabet_index/m/membrannyjj-potencial-pokoya.html
http://medach.pro/post/1458