ТЕОРИЯ ПЕРЕГОНКИ, РЕКТИФИКАЦИЯ.
Разделение путём перегонки основывается на различии температур кипения отдельных веществ, входящих в состав смеси. Если смесь состоит из 2х компонентов, то при испарении компонент с более низкой температурой кипения (НК) переходит в пары, а компонент с более высокой температурой кипения (ВК) остается в жидком состоянии, полученные пары конденсируются образуя дистиллят, а не испарившаяся жидкость – кубовый остаток.
Простая перегонка не дает возможности полного разделения компонентов смеси и получение их в чистом виде.
— для разделения смеси, летучести компонентов которой существенно различаются;
— для предварительного грубого разделения жидких смесей;
— для очистки сложных смесей от нежелательных примесей.
Для достижения более полного разделения компонентов принимают наиболее сложный вид перегонки – ректификация.
Ректификационная колонна – это аппарат, в котором снизу вверх движутся пары, а сверху подается жидкость, представляющая собой почти чистый НК. При соприкосновении поднимающихся паров со стекающей жидкостью, происходит частичная конденсация паров и частичное испарение жидкости. При этом из паров конденсируется ВК, а из жидкости испаряется НК. Таким образом стекающая жидкость обогащается ВК, а поднимающиеся пары обогащаются НК. Эти пары поступают в конденсаторы, часть конденсата возвращается на орошение колонны и называется флегиной, другая часть отводится в качестве дистиллята.
Свойства смесей жидкостей и их паров
I. Взаимное растворение компонентов:
1. Смеси взаиморастворимых друг в друге жидкостей любых отношений:
а) Смеси жидкостей, в которых силы сцепления между молекулами обеих компонентов, такие же как между молекулами каждого компонента.
б) Сила сцепления между компонентами меньше, чем между молекулами каждого компонента.
в) Сила сцепления между компонентами больше, чем между молекулами каждого компонента.
2. Смеси жидкостей нерастворимы друг в друге.
3. Смеси жидкостей частично растворимы друг в друге.
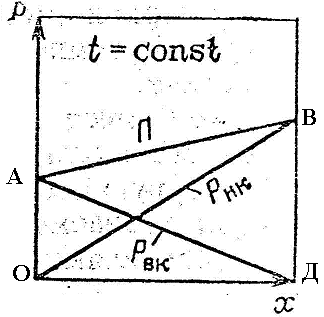
II. Парциальное давление каждого компонента в идеальной смеси зависит от температуры и содержания данного компонента и пропорционально молярной доле каждого компонента в смеси — Закон Рауля.
Таким образом парциальное давление паров компонента равно произведению давления пара чистого компонента на его молярную долю в жидкости.
| PНК* = PНК·xнк |
| PВК* = Pвк·xвк = PВК·(1-xнк) |
PНК*; PВК* – пропорциональное давление над смесью;
PНК; PВК – давление чистых компонентов;
x – молярная доля НК в смеси.
III. Согласно закону Дальтона — общее давление пара над раствором равно сумме парциальных давлений его компонентов.
| P = PНК* + PВК* | |
| P = PНК·xнк + PВК·(1-xнк) | — математическая формула Дальтона |
ОВ – парциальное давление НК.
АД – парциальное давление ВК.
АВ – полное давление при t const.
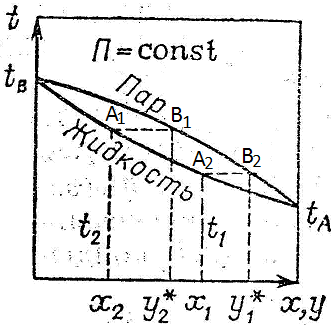
IV. Определение температуры кипения и состава паров смесей по диаграмме:
Откладывая оси ординат температуры кипения t1,t2,t3 для смесей состава x1,x2,x3 получим линию A,A1,A2,A3,B – линия кипения. Откладывая на оси абсцисс составы паров у1, у2, у3 соответствующие температурам t1, t2, t3 линию А, В1, В2, В3, В – линия конденсации.
V. Содержание НК в парах больше, чем содержание НК в жидкости. Это соответствует первому закону Коновалова, согласно которому пар обогащен тем компонентом при добавлении которого в жидкости повышается полное давление пара.
Область между линией конденсации и кипения является двухфазной областью, зависимость между у и х выражается линией равновесия.
Чем ближе линия равновесия к диагонали, тем меньше состав паров, тем труднее разделить смесь.
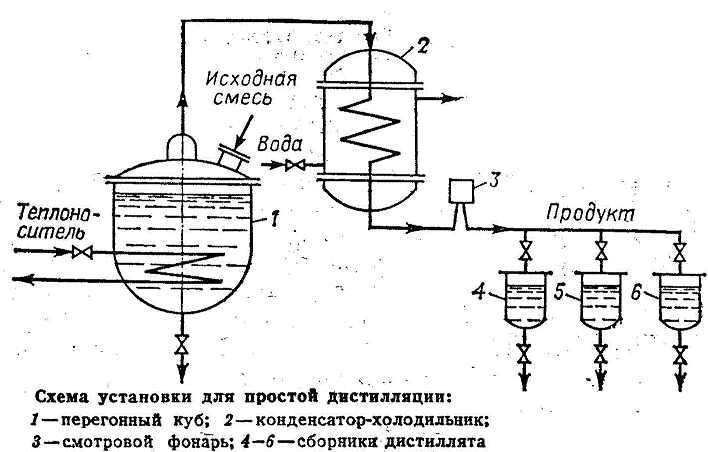
Перегонку проводят путем постоянного испарения жидкости, находящейся в перегонном кубе 1, образующиеся пары отводятся и конденсируются в конденсат-холодильнике 2.
Если простая перегонка проводится периодически, то в ходе отгонки НК, содержание его в кубовой жидкости уменьшается. Вместе с тем изменяется во времени и состав дистиллята, который обедняется НК по мере протекания процесса. В связи с этим отбирают несколько фракций дистиллята имеющих различный состав. Такую перегонку называют фракционной или дробной.
Дистилляция с дефлегмацией
Для повышения степени разделения смеси, перегонку осуществляют, дополнительно обогащая дистиллят путем дефлегмации. Пары из перегонного куба 1 поступают в дефлегматор 2, где они частично конденсируются. Из пара конденсируется преимущественно ВК, получаемая жидкость (флегма) сливается обратно в куб. Пары обогащенные НК накапливаются в конденсат-холодильнике 3, где полностью конденсируются. Дистиллят собирается в сборниках 4. Окончание процесса перегонки контролируют по температуре кипения жидкости в кубе.
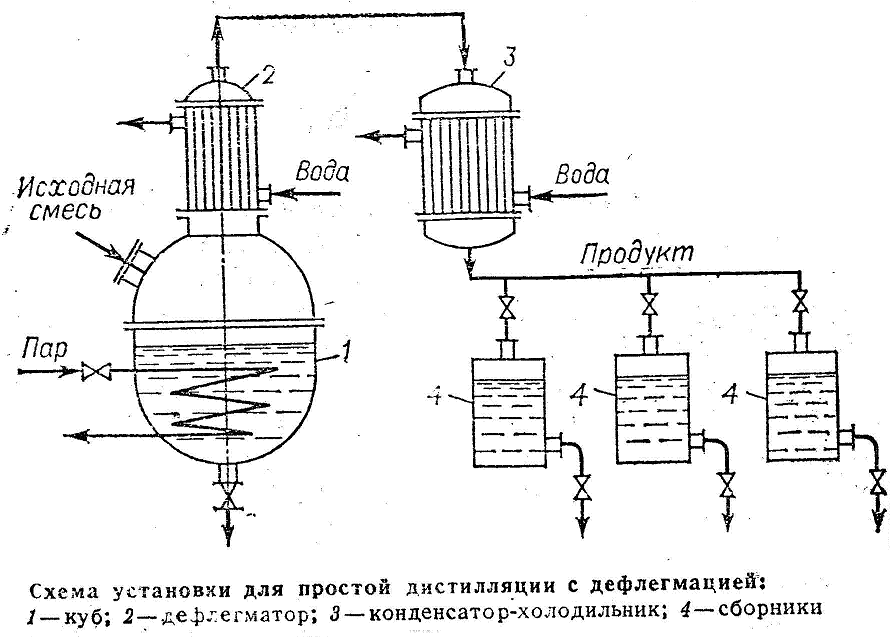 |
Дистилляция в токе водяного пара
Понижение температуры кипения разделяемой смеси может быть достигнуто не только при перегонке под вакуумом, но также путем введения в эту смесь дополнительного компонента-носителя водяного пара или инертного газа. Если компонент исходной смеси не растворимы в воде, то ее используют в качестве дополнительного компонента, который вводят в куб виде острого пара. Этот способ применяется в тех случаях, когда компоненты смеси имеют малую летучесть. Исходная смесь загружается в куб 1 обогреваемый глухим паром через рубашку. Внутрь куба через барбатер подается острый пар. Пары, образующиеся при испарении смеси направляются в конденсат-холодильник 2. Конденсат поступает на разделение в сепаратор 3. Снизу сепаратора через гидравлический затвор удаляется вода, а сверху нерастворимый в воде более легкий компонент, который затем сливается в емкость
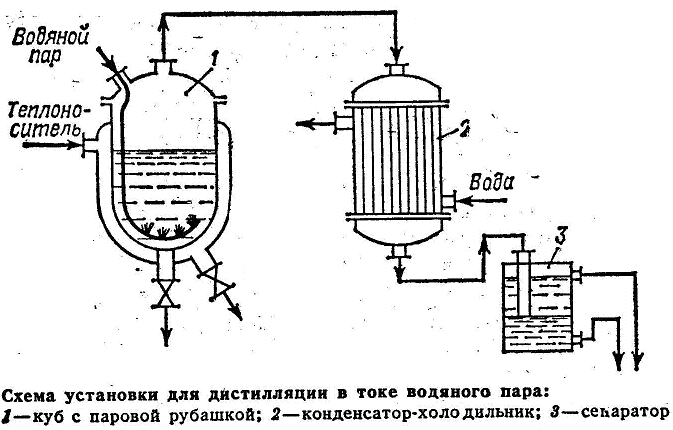 |
Перегонка с инертными газами.
При перегонке смесей вместо водяного пара используют инертные газы N2, CO2. Перегонка в токе инертного неконденсирующегося газа позволяет более значительно снизить температуру испарения разделяемой смеси. Но в присутствии инертного газа в парах поднимающегося из куба приводят к резкому уменьшению α в конденсаторе. Конденсация сопровождается туманообразованием, что вызывает унос продукта с инертным газом.
Молекулярная дистилляция применяется для разделения компонентов, кипящих при высоких температурах и не обладающих необходимой термической стойкостью.
Если расстояние между поверхностями испарения конденсации меньше длины свободного пробега молекул, то отрывающиеся от поверхности испарения молекул летучего компонента попадают на поверхность конденсата и улавливаются на ней.
Внутренний цилиндр 1 снабжен спиралью для электронагрева и является испарителем. Внешний цилиндр 2-конденсатор, имеет рубашку 3, по которой движется охлаждающий агент. Исходная смесь вводится через патрубок в воронку 4 и стекает пленкой по наружной поверхности испарителя. Остаток и дистиллят, собирающиеся на внутренней поверхности конденсатора, удаляется через патрубки в нижней части аппарата.
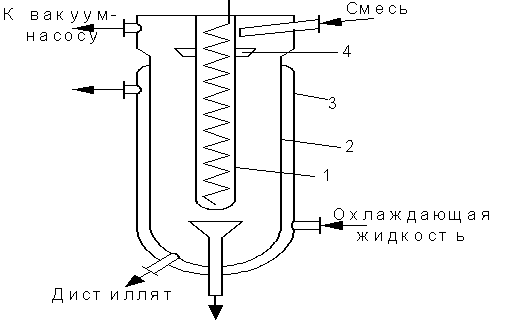 |
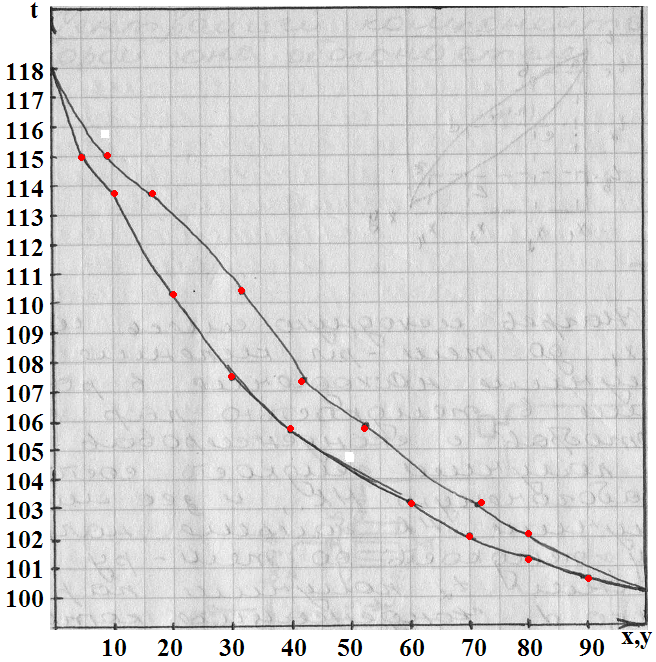
Построение диаграммы t-x,y и x-y для бинарных смесей:
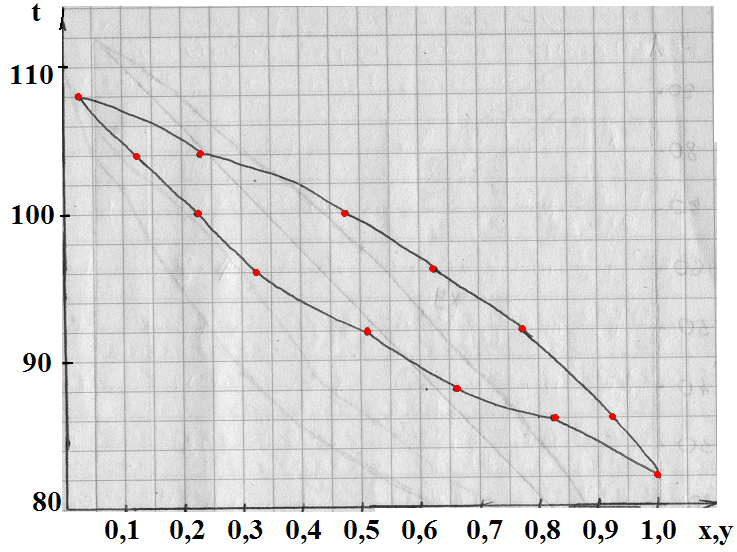
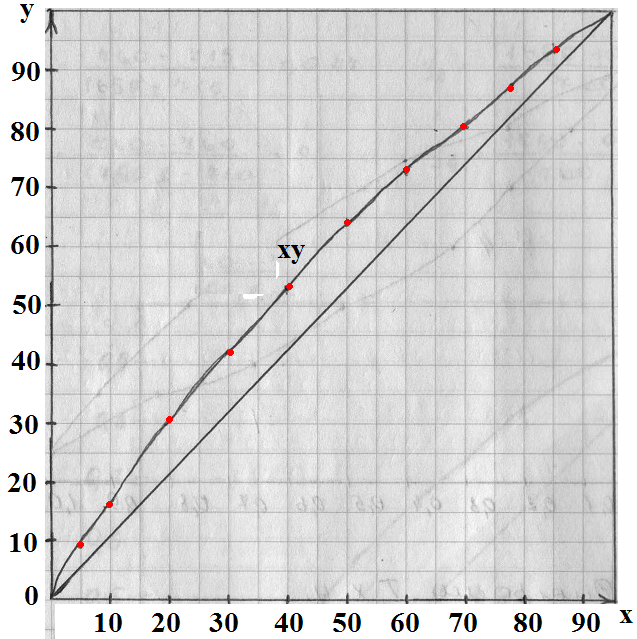
Задача: Построить диаграммы через t-x,y и x-y для смеси бензол-толуол при абсолютном давлении 760 мм. рт. ст.
| t | PНК | PВК | x=(P-PВК)/(PНК-PВК) | y=(PНК·x)/P |
| 80,2 | x1=(760-300)/(760-300)=1 | y1=(760·1)/760=1 | ||
| 342,6 | x2=(760-342,6)/(852-342,6)=0,816 | y2=(852·0,816)/760=0,916 | ||
| 386,2 | x3=(760-386,2)/(957-386,2)=0,655 | y3=(957·0,655)/760=0,824 | ||
| 410,6 | x4=(760-440,6)/(1070-440,6)=0,529 | y4=(1070·0,529)/760= 0,744 | ||
| 505,8 | x5=(760-505,8)/(1200-505,8)=0,366 | y5=(1200·0,366)/760= 0,577 | ||
| x6=(760-571)/(1344-571)=0,244 | y6=(1344·0,244)/760=0,431 | |||
| x7=(760-643)/(1500-643)=0,136 | y7=(1500·0,136)/760=0,268 | |||
| x8=(760-715)/(1650-715)=0,047 | y8=(1650·0,047)/760=0,102 | |||
| 110,4 | x9=(760-760)/(1750-760)=0 | y9=(1750·0)/760=0 |
По расчетным данным:
По табличным данным:
| x | |||||||||||
| y | 0,2 | 16,7 | 30,3 | 42,5 | 62,6 | 71,6 | 79,5 | 86,4 | |||
| t | 118,1 | 115,4 | 113,8 | 110,1 | 107,5 | 105,8 | 104,4 | 103,3 | 102,1 | 101,3 | 100,6 |
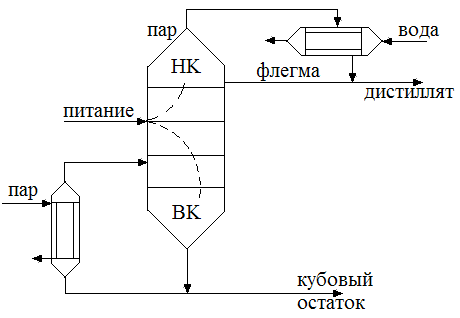
Ректификация бинарных смесей
Ректификация заключается в противоточном взаимодействии паров образующихся при перегонки с жидкостью получающейся при конденсации паров. Ректификация наиболее сложный вид перегонки, предназначен для достижения наиболее полного разделения компонентов. Ректификационные колонны представляют собой аппарат, в котором снизу вверх движутся пары, а сверху подается жидкость представляющая собой почти чистый НК. При соприкосновении поднимающихся паров со стекающей жидкостью происходит частичная конденсация паров и частичное испарение жидкости. При этом из паров преимущественно конденсируется ВК, а из жидкости испаряется НК. Таким образом стекающая жидкость обогащается ВК, а поднимающиеся пары НК. В результате чего выходящие из аппарата пары представляют собой почти чистый НК, которые поступают в конденсатор или дефлегматор, где конденсируются. Часть конденсата возвращается на орошение колонны и называется флегмой, другая часть отводится в виде дистиллята.
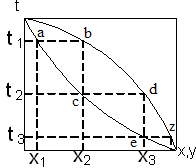
Сущность процессов из которых складывается ректификация и получаемые при этом результаты можно проследить с помощью t-х,у диаграммы.
Если нагреть исходную смесь х1 до температуры кипения t1, то получим находящийся в равновесии с жидкостью пар (точка b). Отобрав и сконденсировав этот пар, даст жидкость состава х2 обогащенную НК. Нагрев жидкость х2 до температуры кипения t2, получим пар (точка d), конденсация которого дает жидкость с еще большим содержанием НК, имеющую состав х3 и т.д. Проводя таким образом последовательно ряд процессов испарения жидкости и конденсации паров, можно в итоге получить дистиллят, представляющий собой почти чистый НК. Простейший вид процесса многократного испарения можно осуществить в многоступенчатой установке в первой ступени которой испаряется смесь. При достаточном большом числе ступеней можно получить жидкостную или паровую фазу с высокой концентрацией компонента, которой она обогащается.
 | Непрерывнодействующая ректификационная установка состоит из ректификационного массообменного аппарата – ректификационной колонны 1, представляющий собой вертикальный цилиндрический корпус, внутри которого расположены контактные устройства. Снизу вверх по колонне движется поток пара, поступающий в нижнюю часть колонны из испарителя 2, находящегося рядом с колонной. На каждой тарелке при его перемещении по колонне происходит конденсация поднимающегося пара, а за счет теплоты его конденсации испарителя, находящегося в этой зоне легколетучего компонента, т.е. происходит постоянное удаление и обогащение |
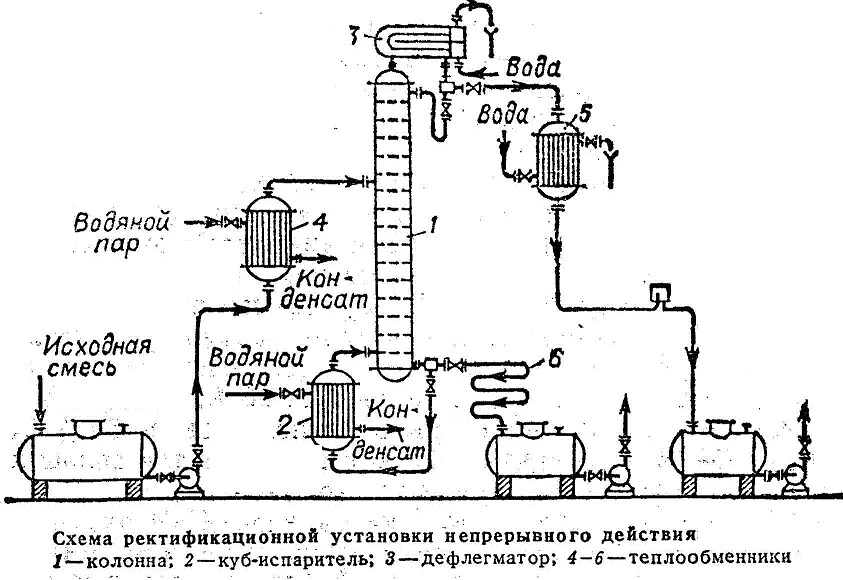 | . |
В результате из верхней части колонны выгружаются пары легколетучего вещества, конденсирующиеся в дефлегматоре. Получается, жидкость удаляется на два потока. Первый поток – флегма, возвращается назад в колонну. Стекая вниз, флегма обогащается труднолетучим компонентом. В результате жидкость, достигающая нижней части колонны и поступающая в испаритель, состоит из низколетучего компонента. Подаваемую на разделение исходную смесь подогревают до температуры кипения в теплообменнике и подают в колонну.
Второй поток жидкости, получаемый в дефлегматоре, называется дистиллят. Он поступает в дефлегматор, затем в сборник, откуда перекачивается в качестве целевого продукта насосом. Жидкость, выходящая из нижней части колонны охлаждается в холодильнике 6, собирается в сборнике и откачивается насосом.
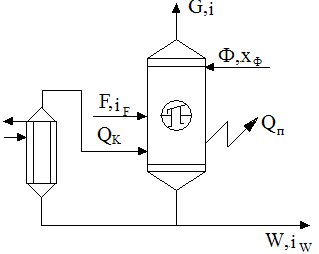
Материальный баланс ректификационной колонны.
Прежде, чем изучать материальный баланс, нужно принять следующие допущения, которые значительно упрощают расчет:
1. Отношение молей теплоты испарения или конденсации к абсолютной температуре кипения для всех жидкостей является приблизительно величиной постоянной: R/T — const. Т.е. каждый кмоль сконденсировавшегося пара испаряет 1 кмоль жидкости.
2. Исходная жидкостная смесь подается в колонну подогретой до температуры кипения смеси на питающей тарелке.
3. Состав пара аналогичен составу дистиллята в дефлегматоре.
4. При испарении жидкости в кубе не происходит изменения ее состава, следовательно, состав образующегося пара аналогичен составу остатка.
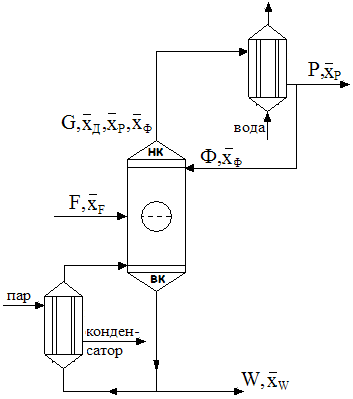 Рис. Схема Материального баланса. Рис. Схема Материального баланса. | Пусть в колонну поступает F кмоль исходной смеси, состав которой XF мольных долей НК. Сверху колонны удаляется G кмоль пара, образующих после себя конденсат, дистиллят и флегму. Количество получившегося дистиллята P кмоль, его состав XP мольных долей НК. На орошение колонны возвращается флегма F кмоль, причем её состав равен составу дистиллята, т.е. X |
Уравнение материального баланса
| F = P+W | — первое уравнение по всему веществу |
где Р – количество дистиллята; W – количество кубовой жидкости.
| F·xF’ = P·xP’+W·xW’ | — второе уравнение по НК |
При помощи этих уравнений решают все задачи, связанные с определение количеств или составов веществ, участвующих в процессе ректификации.
Задача: На ректификацию поступает смесь хлороформ-бензол в количестве 2000 кг/ч, с содержанием хлороформа 40 вес.%, содержание хлороформа в дистилляте 99,5 вес.%, в кубовом остатке 0,5 вес.%. Определить количество дистиллята и кубовой жидкости.
| Дано: x’Ф = 0,4 x’P = 0,995 x’W = 0,005 F = 0,556 кг/с | Решение 1: 1)Изменяем уравнение 1, выражая неизвестное:
2)Подставляем изменённое уравнение 1 в уравнение 2 и находим неизвестное:
0,556·0,4 = 0,556·0,995 — W·0,995 + W·0,005 3)С помощью изменённого уравнения 1 находим другое неизвестное: P = 0,556 – 0,334 = 0,222 кг/с Ответ: W = 0,334 кг/с; P = 0,222 кг/с 1)Изменяем уравнение 1, выражая неизвестное:
2)Подставляем изменённое уравнение 1 в уравнение 2 и находим неизвестное:
3)С помощью изменённого уравнения 1 находим другое неизвестное: W = 0,556 – 0б222 = 0,334 кг/с Ответ: W = 0,334 кг/с; P = 0,222 кг/с Количество поднимающегося пара постоянно по всей колонне. Это количество пара образуется в кубе и поступает в дефлегматор, оттуда часть Ф возвращается в колонну в виде флегмы, а остальная часть P отводится в виде дистиллята
Отношение количества флегмы к количеству дистиллята называется флегмовым числом:
Следовательно количество флегмы:
Тогда количество поднимающихся паров:
Т.е. на каждую кмоль дистиллята в кубе должно быть испарено R+1 кубового остатка. Расчёт минимального флегмового числа Задача: В ректификационную колонну непрерывного действия поступает жидкость с 24 моль,% легколетучего компонента. Концентрация дистиллята 95 моль,%, концентрация кубового остатка 3 моль.%. В дефлегматор поступает 850 кмоль/ч пара, в колонну из дефлегматора поступает 670 кмоль/ч. флегмы. Определить количество кубового остатка и рассчитать флегмовое число.
Уравнение рабочих линий процесса ректификации. G – количество паровой фазы; L – количество жидкой фазы; y1 и y2 – молярные доли НК в парах на входе и на выходе колонны; x1 и x2 – молярные доли НК в жидкости на входе и на выходе колонны; Рассмотрим произвольное сечение А-А в нижней или верхней части. В составе уравнения материального баланса по НК для части аппарата расположенного выше сечения А-А(укр.) В сечении А-А состав пара — у, жидкости — х.
Для части аппарата расположенной ниже сечения А-А:
В укрепляющей части колонны количество стекающей жидкости равно количеству флегмы:
Состав пара на выходе из колонны равен составу подаваемой на орошение флегмы:
Подставляем значение L,G,у2,х2 в уравнение (1), и получим у=xР-(R/(R+1))·(xP-1)
R/(R+1) = tgx – тангенс угла наклона рабочей линии к оси абсцисс; Исчерпывающая часть колонны Количество орошающей жидкости L в этой части колонны больше количества флегмы стекающей по укрепляющей части на количество исходной смеси F, поступающей в питающую тарелку, если обозначить количество питания приходящейся на 1 кмоль дистиллята f=F/P, то количество питания F=fP, и количество стекающей жидкости по исчерпывающей части колонны:
Количество пара проходящего через низ колонны равно количеству пара поднимающегося по верхней части колонны:
Составы поступающего в колонну пара и вытекающей из нее жидкости, равно составу кубового остатка:
Подставим значения L,G,y1,x1 в уравнение нижней части колонны получим y=((xW+R+f)/(R+1))·xW
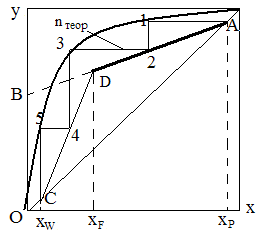
(R+f)/(R+1) – тангенс угла наклона рабочей линии к оси ординат; (f-1)/(R+1) – отрезок, отсекаемый рабочей линией на оси абсцисс. Рабочая линия верха и низа колонны xP/(R+1) = B – отрезок отсекаемой рабочей линии на оси ординат диаграммы x-y. Построение рабочей линии на диаграмме у-х. Для построения рабочей линии откладывают на оси абсцисс диаграммы х-у, заданные составом жидкости хW,xP,xF, учитывая принятые допущения о равенстве состава пара и жидкости на концах колонны из точки xP восстанавливаем вертикаль до пересечения с диагональю диаграммы в точке А, где хP = уР. Величину флегмового числа считаем известной, откладываем на оси ординат отрезок ОВ, B = xP/(R+1), соединяем точку В с точкой А и получаем наклон рабочей линии верха колонны. Из точки отвечающей заданному составу xF проводим вертикаль до пересечения с линией АВ в точке D. Прямая АD – рабочая линия верха колонны, согласно допущению хW = уW, т.е. из точки соответствующей хW восстанавливаем вертикаль до пересечения с диагональю в точке С соединяем точку D с точкой С; СD – рабочая линия низа колонны. Расчет минимального флегмового числа R. При заданном составе дистиллята xP величина отрезка B отсекаемая рабочей линией укрепляемой части колонны зависит только от флегмового числа, т.к. B = xP/(R+1). С уменьшением R отрезок OB увеличивается и рабочая линия поворачивается вокруг точки А. Однако уменьшается флегмовое число лишь до известного предела, т.к. рабочая линия выражает неравновесный состав пара y. Составы пара yF * равновесны с жидкостью и выражаются линией равновесия. Отрезки между линией равновесия и рабочей линией равны разности, выражающая движущую линию процесса, если рабочая линия соприкасается с линией равновесия. В этом случае y * = y, т.е. движущая сила равна 0. Для проведения процесса требуется бесконечно длинная колонна. Положение рабочей линии AD’C соответствует минимальному числу Rmin
С увеличением флегмового числа рабочая линия процесса возрастает, а требуемая высота аппарата уменьшается, но увеличивается расход тепла. Экономически это не выгодно, т.к. отбор дистиллята уменьшается. Наивыгоднейшее число при котором затраты минимальны, может быть найдено технико-экономическим расчетами. Наиболее выгодное R= от 1,2·Rmin до 2,5·Rmin — этот интервал обозначает избыток флегмы.
α — коэффициент избытка флегмы. Задача: На ректификацию поступает смесь метанол-вода с исходным составом xF = 0,273, xP = 0,973, xW = 0,0085. Определить Rmin.
Тепловой баланс ректификационной колонны. 1. Подвод в кубе из кипятильника. – QK; 2. Приход с исходной смесью – F,iF; 1. С парами выходящими из колонны — Qпар=G·J; 3. Потери в окружающую среду – Qпотерь.
Определение числа теоретических тарелок в колонне Чтобы обеспечить заданное разделение в смеси колонны при определении флегмового числа необходимо иметь соответствующее число тарелок, которое можно определить графическим методом с использованием диаграммы х-у. Для этого необходимо иметь кривую равновесия фаз и рабочей линии верха и низа колонны. Затем из т. А, в которой хР=уР проводят горизонталь до линии равновесия и из точки пересечения 1, опускаем вертикаль на рабочую линию, продолжаем аналогичное построение ступенек до т. С, в которой хW=yW. Число ступеней между равновесной и рабочей линии соответствует числу теоретических тарелок, т.е.
|







 — соответственно мольная доля компонента в жидкости и паре, кмоль/кмоль;
— соответственно мольная доля компонента в жидкости и паре, кмоль/кмоль; — соответственно массовая доля компонента в жидкости и паре, кг/кг;
— соответственно массовая доля компонента в жидкости и паре, кг/кг; ;
; (1.2)
(1.2) (1.5)
(1.5) (1.6)
(1.6) (1.7)
(1.7)