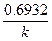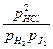Реакции первого порядка
Кинетическое уравнение реакции первого порядка имеет вид:
v = — 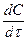
гдe c — концентрация реагента.
Преобразовав уравнение, получим:
— 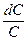
и после интегрирования:
Обозначив начальную концентрацию как Co (когда t=0) можно определить константу интегрирования B: B = lnC0
lnC = -kt + lnC0 Þ (подставив lnC0) lnC — lnC0 = -kt Þ ln 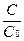
или (если найти антилогарифм): 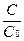
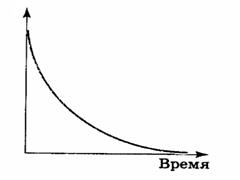
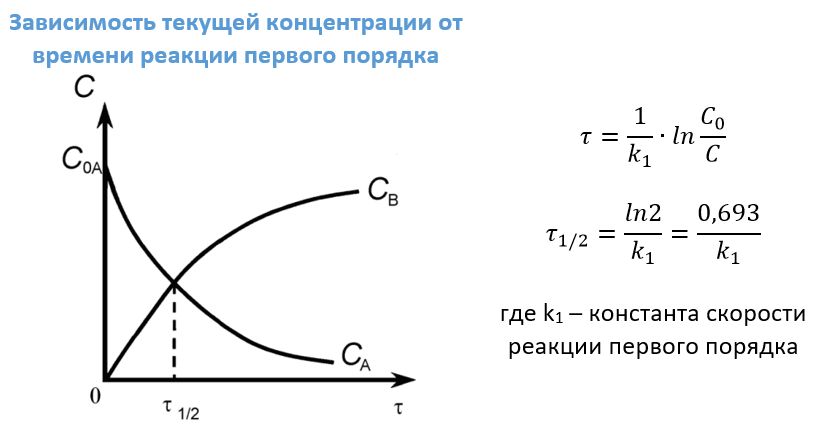
Диаграмма, где концентрация реагента представлена на оси ординат, время реакции — на оси абсцисс:
Представим, что нужно определить время, когда C= C0/2 (концентрация исходного вещества упадет в 2 раза)
ln 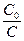
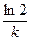
Эта зависимость показывает, что константа скорости реакции 1-го порядка обратно пропорциональна времени (периоду) полураспада.
Период полураспада (t1/2) равен времени, в течение которого прореагирует половина первоначального количества вещества.
Также можно получить подобные уравнения для (t1/2) для реакций более высокого порядка, но это более сложно.
Порядок реакций не равен их молекулярности если :
a) Один из реагентов присутствует в таком большом избытке, что его расход практически не будет изменять его концентрацию. Например, гидролиз эфира в разбавленном водном растворе:
Концентрация воды изменяется пренебрежимо мало, и скорость реакции будет зависеть только от изменения концентрации эфира. В результате скорость реакции будет описываться уравнением 1-го порядка, хотя это бимолекулярная реакция.
b) Если это сложная реакция. Обычно в этом случае уравнение химической реакции отражает только общий эффект всех взаимодействий
Молекулярность равна 2. Реакция имеет 2 стадии:
1-я стадия — медленнее и определяет скорость суммарной реакции, поэтому v=kCN2O5 и порядок реакции равен 1. Если одна из стадий проходит при низкой, по отношению к другим, скорости, то суммарная скорость реакции будет определяться скоростью этой стадии. Эта стадия называется — лимитирующая стадия реакции.
c) Для гетерогенных реакций, например:
2Zn + O2 = 2ZnO. Молекулярность реакции равна 3, но кинетика реакции описывается уравнением реакции 1-го порядка: v= k×CO2,
потому что Zn — это твердое вещество, у него нет концентрации, но O2 — газ, ему соответствует определенная концентрация.
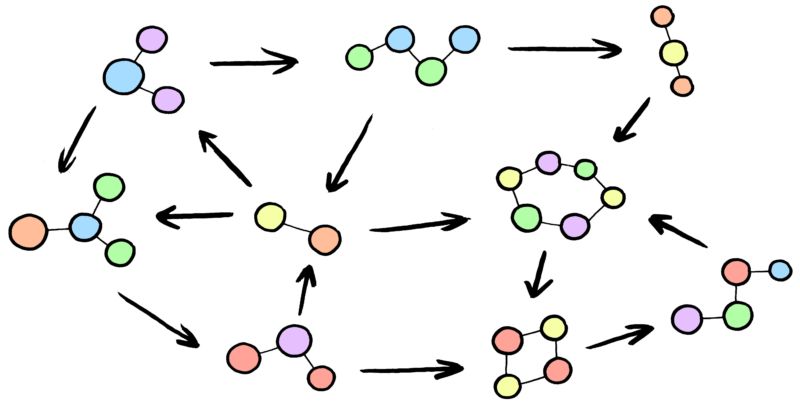
Сложные реакции
Кинетика сложных реакций, состоящих из 2-х и более простых реакций, взаимосвязанных друг с другом тем или иным способом, зависит от природы этой взаимосвязи и отношения скоростей простых реакций. Типичные формы взаимосвязи простых реакций, когда они являются параллельными, последовательными (консекутивные), сопряженными и обратимыми реакциями.
Теория кинетики сложных реакций основана на принципе, что когда несколько реакций происходят одновременно и каждая идет независимо и кинетика каждой реакции может быть описана кинетическим уравнением простой реакции.
Параллельные реакции — это реакции вида:
В таких реакциях начальное вещество (или вещества) могут реагировать параллельно в различных направлениях.
Последовательные реакции -реакции вида:
где B — промежуточный продукт в образовании C и k1 и k2 — константы скорости 2-х стадий реакции.
Сопряженные реакции — реакции типа:
A + B ® M
В которых одна, например 1-я, происходит только вместе со 2-й, т.е. индуцируется 2-й.
Обратимые реакции. Скорость обратимой реакции равна разности между скоростями прямой и обратной реакций.
если написать выражения для скоростей прямой и обратной реакций:
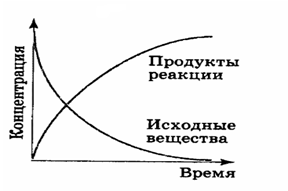
Если в системе первоначально присутствуют только реагенты (H2 и J2), скорость прямой реакции v1 (Исходные вещества) будет уменьшаться с уменьшением концентраций этих компонентов.
Кривая v2 (Продукты реакции) начинается в начале координат (поскольку по условию первоначально CHJ = 0) и возрастает по мере того, как реакция идет.
Положение равновесия будет достигнуто, когда абсолютное значение скоростей прямой и обратной реакций будет равным: v1 = v2 и результирующая скорость = 0.
Если переписать соотношение и затем преобразовать его:
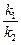
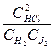
где Kc — концентрационная константа равновесия реакции.
Если предыдущее уравнение применять к реакциям, проходящим в не очень разбавленных растворах, мы должны заменить концентрации веществ их активностями, и тогда заменить Kc на Ka.
Если уравнение применять к смеси идеальных газов мы должны заменить концентрации — парциальными давлениями газов, и соответственно Kc на Kp:
Kp=
гдe pHCl, pH2, pJ2 — парциальные давления газов. Парциальное давление газа, находящегося в смеси других газов, равно давлению, которое этот газ производил, если бы он при данной температуре занимал весь объем, занимаемый смесью газов. В общем случае Kp ¹ Kc. Если применить уравнение для идеальных газов, можно найти зависимость между Kp и Kc.
pi = 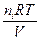
где ni — количество молей газообразного компонента i, Ci — концентрация газа.
Tогда для вышеприведенной реакции:
Kp= 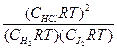
В общем случае: Kp = Kc (RT) D n ,
гдe Dn -разность между стехиометрическими коэффициентами газообразных продуктов реакции и реагентов (Для реакции (H2 and J2) Dn=0 and Kp = Kc)
Константа равновесия — важная характеристика реакции, по ее величине можно судить о степени протекания реакции (большое значение — реакция сдвинута в сторону продуктов реакции, низкое — в сторону исходных веществ). Константа не зависит от концентраций (давлений), зависит от температуры.
Если переписать уравнение реакции в общем виде:
aA + bB = cC + dD +eE
и вещества A, B, C and D — газы, а E — жидкость или твердое вещество, тогда:
Dn= c + d –a –b
Для условий: реакция проходит при постоянной температуре и постоянных парциальных давлениях для всех веществ, и законы идеальных газов применимы, существует связь между энергией Гиббса и константой химического равновесия Kp:
Таким образом, можно вычислить значение Kp
Порядок реакции: понятие, виды
В химической кинетике одной из важных задач является нахождение порядка реакции. Хоть эта величина и формальная, но позволяет наилучшим образом отразить экспериментальную зависимость скорости какой-либо реакции от концентрации. Как правило, для нахождения скорости реакции используют концентрации исходных соединений, взятых в степенях, соответствующих их стехиометрическим коэффициентам. Но это справедливо лишь для очень простых реакций.
Порядком химической реакции по веществу является значение степени n, в которой концентрация этого соединения входит в формулу для нахождения скорости реакции, полученную опытным путем. А вот общий порядок составляет сумму всех порядков по веществам: n = n1 + n2. Значения n1 и n2 соответствуют стехиометрическим коэффициентам в уравнениях одностадийных реакций. Фактически, они могут иметь положительные или отрицательные значения, быть целыми или дробными числами.
Например, для уравнения взаимодействия H2+ Ι2 ― > 2HΙ, которому соответствует формула для определения скорости v=kCHCI, порядки по веществам равны nH=1 и nI=1, общий порядок реакции n=nH+nI=1+1=2.
Нулевой порядок
Некоторые реакции имеют нулевой порядок реакции. Как правило, на них не влияют концентрации исходных соединений. Происходит это в следующих случаях:
- если какое-либо исходное вещество взято в существенном избытке;
- если скорость регулируется энергией активации молекул, участвующих в реакции, например, в фотосинтезе.
В качестве примера рассмотрим реакцию взаимодействия этилуксусного эфира с водой, т.е. его омыления.
Поскольку взаимная растворимость исходных веществ крайне мала, то основная их масса находится в разных фазах. При расходовании эфира в химической реакции из эфирного слоя своевременно поступает новая его порция, то есть концентрация его в растворе не уменьшается.
Реакции первого порядка
Такое взаимодействие веществ можно условно записать уравнением: А―>В. Примером может послужить разложение диметилового эфира:
Для которого скорость реакции определяется как v=kCС2Н6О. В данном случае порядок по веществу и общий порядок совпадают и равны единице.
Практическое значение для реакций первого порядка имеет время (τ) определения некой заданной концентрации С, если известна начальная концентрация Со, а также период полураспада τ1/2, это время, в течение которого успевает прореагировать половина исходного вещества.
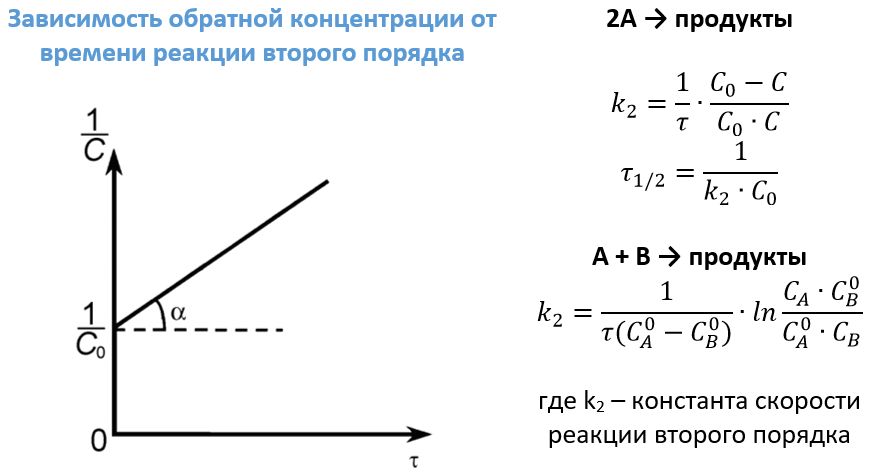
Реакции второго порядка
К таким взаимодействиям можно отнести реакции типа А + В ―> продукты. Примером может послужить уже приводимая выше реакция получения йодоводорода или щелочное омыление этилацетата:
Также (к) второй порядок имеют отдельные реакции разложения типа: 2А ―> продукты. В качестве примеров можно привести следующие:
Последующие реакции
Реакции третьего и последующего порядков встречаются реже, чем предыдущие варианты. Это объясняется низкой вероятностью одновременной встречи в пространстве трех и более частиц. Тем не менее, примером таких взаимодействий может послужить образование диоксидов азота и углерода из их монооксидов:
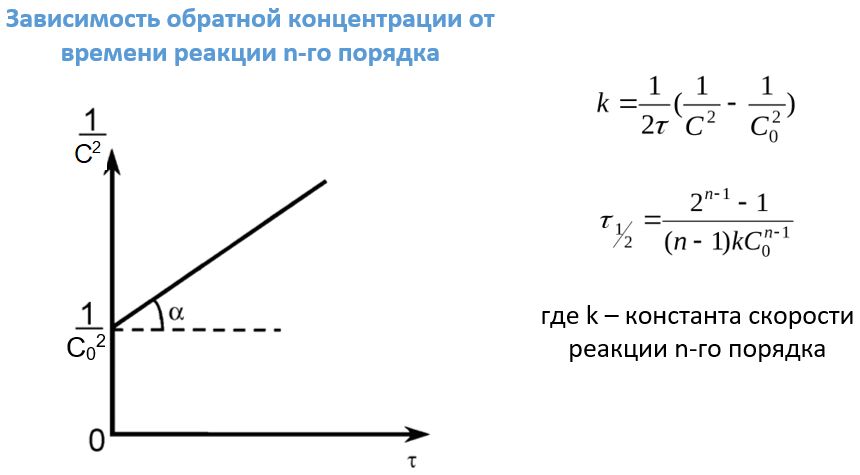
Для таких реакций также существует своя зависимость концентраций реагентов от времени ее протекания. Формулы для нахождения периода полупревращения и констант скоростей реакций унифицированы за счет введения индекса n, равного порядку этих самых реакций.
Молекулярность реакции
Не нужно путать порядок реакции с ее молекулярностью, которая определяется именно числом молекул, которые совершают акт химического превращения. В отличие от порядка, который определяется экспериментально, молекулярность химической реакции имеет теоретическую основу. Для ее определения нужно понимать суть процесса, как именно взаимодействуют молекулы между собой, через какие стадии превращения они проходят.
| Порядок | Молекулярность |
| Формальная величина | Есть физический смысл, показывает число реагирующих молекул |
| Может принимать различные числовые значения | Принимает только одно из трех значений: 1,2,3 |
| Применяется к реакциям любой сложности и многостадийности | Применяется только к элементарным одностадийным реакциям |
Существует несколько причин, по которым не совпадает для одной и той же реакции порядок и молекулярность:
- если один из реагентов взят в большом избытке, о чем уже говорилось выше;
- для многих гетерогенных реакций порядок может изменяться в ходе их осуществления, особенно если при этом меняются условия их протекания;
- каталитические реакции имеют многостадийный механизм, суть которого не всегда отражается стехиометрическим уравнением;
- в сложных многостадийных реакциях на суммарное значение скорости может повлиять только одна из промежуточных, которая в результате и будет определять порядок всего превращения.
К мономолекулярным относят реакции распада молекул:
В бимолекулярных реакциях сталкиваются две молекулы. Причем это могут быть молекулы как разных веществ, так и одного и того же:
Тримолекулярными называют такие реакции, для осуществления которых нужны три молекулы исходных веществ:
Уравнение реакции 1 го порядка
Из уравнений (4) и (5) видно, что критериями первого порядка реакции по реагенту А является линейная зависимость ln [ A ] – t или ln 
В тоже время по тангенсам углов наклона линейных зависимостей можно определить константы скорости.
Другой тест правильности выбранного первого порядка является постоянство константы скорости реакции, вытекающее из уравнения (5)
Размерность константы скорости первого порядка dim < k >= [1/ c ], [1/мин] или соответственно с -1 , мин -1
Третий тест основан на концентрационной зависимости времени полупревращения. Условие полупревращения [ A ] = 0,5[ A ]0 , тогда в соответствии с уравнением (5)
Можно видеть, что критерием первого порядка реакции является независимость времени полупревращения t ½ от начальной концентрации реагента [ A ]0.
Примерами подобных реакций первого порядка являются реакции изомеризации, а также реакции разложения некоторых сложных молекул в газовой фазе.
и в жидкой фазе, например, гидролиз трет-бутилбромида.
Для реакции A + B → C + D можно записать уравнение скорости
Обозначим [ A ]0 и [ B ]0 – начальными концентрациями реагентов А и В, а Х – количество прореагировавших А и В, тогда уравнение (1) приобретет вид
Разделяя переменные, имеем
Проинтегрируем левую часть этого уравнения методом неопределенных коэффициентов, для чего представим дробь
в виде суммы дробей
Решая совместно эти уравнения, имеем

Подставляя значения α и β в уравнение (3) и (4) и интегрируя полученные уравнения в соответствующих пределах
Из уравнения (5) видно, что критерием правильности выбранного второго порядка реакции является линейность зависимости

По тангенсу угла наклона этой зависимости можно определить константу скорости реакции. Другим критерием правильности выбранного второго порядка является постоянство значений k , вычисленных в соответствии с уравнением (5):
во всем диапазоне пар значений τ – х.
Размерность константы скорости второго порядка

Если вещества А и В взяты в равных количествах или реакция идет с участием одного вещества, например
то при постоянстве объема удобно использовать в качестве переменной концентрацию одного из исходных веществ
тогда кинетическое уравнение будет иметь вид
Интегрируя это уравнение в соответствующих пределах
приходим к выражению
Из уравнений (7) и (8) следует, что критериями правильности выбранного второго порядка являются линейный характер зависимости 1/[ A ] от t и постоянство значения k , вычисленных для различных пар значений [ A ] – t по формуле
Третий критерий правильности второго порядка основан на определении времени полупревращения t ½ . Так как [ A ] = 0.5[ A ]0, то в соответствии с уравнением (7)

Можно видеть, что критерием второго порядка является обратно пропорциональная зависимость между t ½ и начальной концентрацией реагента. В соответствии с выражениями (7) и (8) константы скорости второго порядка можно определить по тангенсу угла наклона зависимостей 

Имеется множество реакций протекающих по кинетике второго порядка:
и простой случай, соответствующий равенству исходных и текущих концентраций реагентов
Разделяя переменные и интегрируя
Из уравнения (3) видно, что критериями правильности выбранного третьего порядка является линейность зависимостей 

для всех пар значений t и [ A ] и обратно пропорциональная зависимость между временем полупревращения и квадратом начальной концентрации реагента
В соответствии с уравнением (3) константа скорости третьего порядка может быть определена по тангенсу угла наклона зависимости 

Интегрирование уравнения (1)
приводит к выражениям
Из уравнений (2) и (3) следует, что критериями нулевого порядка по реагенту А являются линейный характер зависимости [ A ] от t , постоянство k , вычисленного по формуле

Из уравнений (2) и (3) следует, что константа скорости нулевого порядка может быть определена по тангенсу угла наклона зависимостей [ A ]0 – [ A ] или [ A ] от времени
Сложные реакции представляют собой совокупность простых реакций. К сложным реакциям относятся обратимые реакции.
При кинетическом анализе сложных реакций руководствуются принципом независимости простых реакций, согласно которому каждая простая реакция, входящая в сложную ведет себя кинетически так, как если бы она была единственная.
в начальный момент времени концентрация реагента A составляет [ A ]0, а [ B ] = 0, то уравнение этой реакции запишется как
Выражая r через концентрацию [A] имеем


где X – количество молей вещества A в единице объеме, которое прореагировало к моменту τ и соответственно количество молей вещества B в единице объеме, которое образовалось к этому моменту. Преобразуя правую часть уравнения (2)

В условиях равновесия
При τ ® ¥ X стремится к своему равновесному значению X ® X ¥ . Тогда
где
Тогда кинетическое уравнение (3) примет вид
Интегрируя это уравнение в соответствующих пределах
и
В соответствии с выражениями (6) и (7) кинетические зависимости для A и B будут иметь следующий вид
Пользуясь интегральной формой кинетического уравнения (5) и соотношением 
Так, в соответствии с (5)
так как 
Подставляя последнее выражение в уравнение (8), имеем
Подставляя выражение (10) в уравнение (8), имеем
Рассмотрим систему параллельных реакций первого порядка
В соответствии с ранее принятыми обозначениями суммарная скорость расходования реагента A выразится уравнением
По форме уравнение (1) подобно кинетическому уравнению необратимой реакции первого порядка, поэтому его интегральная форма имеет вид.
Разрешая уравнение (2) относительно [ A ] имеем
Для определения констант k 1 и k 2 рассмотрим уравнения конкурирующих параллельных реакций.
Поделив почленно, левые и правые части уравнений (5) и (6), имеем уравнение 
Разделяя, левые и правые части уравнений (5) и (1), (6) и (7), приходим к очевидным равенствам

интегрирование которых дает уравнения:

Подставляя в последние уравнения выражение (4) приходим к равенствам
Уравнения (2) и (8) являются основой для определения абсолютных значений констант скорости конкурирующих реакций k 1 и k 2 . На первом этапе можно определить сумму констант скоростей k 1 + k 2 , пользуясь уравнением (2). Затем на основе линейных зависимостей между XB и X , а также XC и X определяют брутто константы 

Нетрудно показать, что для трех параллельных реакций первого порядка


Этот случай более сложен по сравнению с предыдущим. Рассмотрим систему параллельных реакций
Уравнение скорости расхода A в этой системе реакций с учетом его количества, прореагировавшего к моменту времени t (Х) имеет вид:
или с учетом преобразований
обозначая 
Разделяя переменные, приходим к выражению
Интегрируем левую часть уравнения (3) методом неопределенных коэффициентов, для чего представим левую её часть в виде суммы дробей.

так как 

Тогда 
Откуда 

С учетом (4) возвращаемся к уравнению (3)
Интегрирование уравнения (5) приводит к выражению
Откуда
или
Возвращаясь к соотношению 
Рассмотрим систему двух последовательных реакций первого порядка
В силу принципа независимости скорости расходования реагента A выражается уравнением скорости необратимой реакции первого порядка
Решение которого дается в виде


Уравнение скорости изменения концентрации промежуточных продуктов
Разделим почленно левые и правые части уравнений (3) и (1)
Уравнение (4) имеет признаки однородного уравнения первого порядка. Для его решения вводим обозначение
Подставляя последнее выражение в уравнение (4), имеем:
Разделяем переменные и интегрируем
и
тогда
и
или
Так как 
В тоже время в соответствии с уравнением (2)
Тогда уравнение (5) можно преобразовать в форму
Выведенные зависимости показывают, что в случае необратимых последовательных реакций уравнение для первого промежуточного продукта связано с характеристиками лишь первых двух стадий, оставаясь одинаковым при любом числе и характеристиках последующих стадий. При этом независимо от начальной концентрации реагента A , значение второй характеристики материального баланса 
Используя уравнение (5) можно найти 
Из анализа уравнения (6) следует, что при XA = 0 и XA = 1 

откуда
и значение максимума
Из выражений (8) и (9) видно, что положение и величина максимума промежуточного продукта в необратимых реакциях первого порядка зависит только от соотношения констант скоростей первых двух стадий. При этом, чем больше величина 

Уравнение образования продукта C :
Максимальная скорость 
Легко видеть, что это условие соответствует одновременно условию максимума концентрации B , определяемого уравнениями(8) и (9). Качественно проанализированные зависимости могут быть представлены графически.
Неэлементарные реакции состоят из ряда элементарных стадий, составляющих их механизм. Кинетика таких реакций определяется последовательностью элементарных стадий, их характером (обратимые, необратимые), природой реагентов, интермедиатов и продуктов реакции. При кинетическом анализе неэлементарных реакций возникает задача определения концентраций интермедиатов, играющих ключевую роль в образовании продуктов или расходовании реагентов. В качестве инструмента такого определения используется принцип квазистационарных концентраций Боденштейна – Семенова. Согласно этому принципу скорость изменения концентраций нестабильных интермедиатов пренебрежимо мала по сравнению со скоростью изменения концентраций реагентов и продуктов реакции и её можно считать равной нулю. Применение принципа стационарных концентраций к неэлементарным реакциям, протекающим по сложному механизму, позволяет исключить из кинетического описания процессов неизвестные концентрации интермедиатов и получить одно или некоторый минимум дифференциальных уравнений скорости, выраженных через подлежащие измерению концентрации реагентов и продуктов реакции.
Рассмотрим пример неэлементарной реакции, описываемой стехиометрией
и протекающей через образование интермедиата Q
Скорость реакции можно приравнять к скорости образования продукта B
В соответствии с принципом квазистационарных концентраций
откуда
Подставляя последнее выражение в уравнение (1) приходим к уравнению скорости реакции
Если экспериментально возможно непосредственно измерить скорость реакции, то обработку кинетических данных можно провести, преобразуя уравнение (3) как:
Последнее уравнение приводится к виду
Обрабатывая зависимость (4) в координатах 

http://fb.ru/article/375081/poryadok-reaktsii-ponyatie-vidyi
http://www.trotted.narod.ru/physchem/26.htm