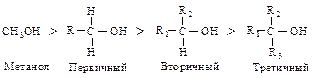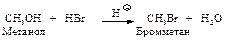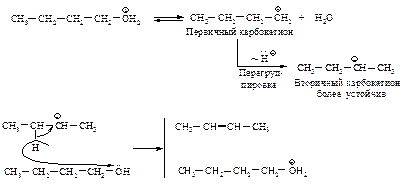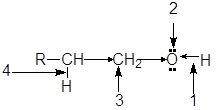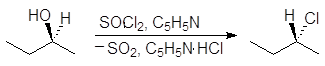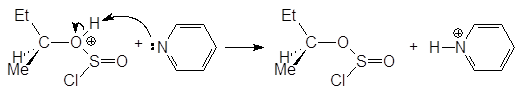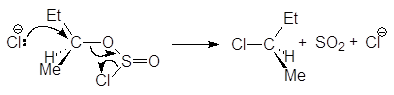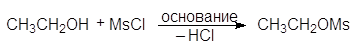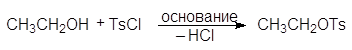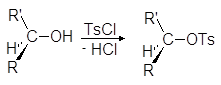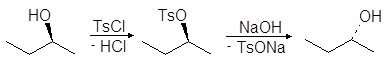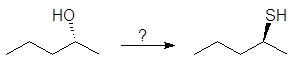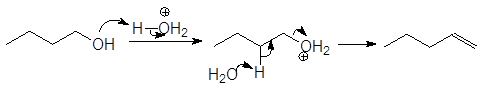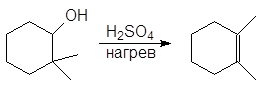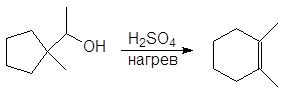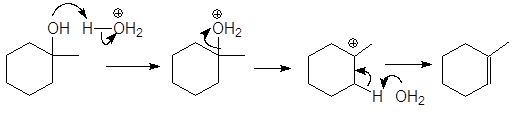Химические свойства аллилового спирта
Аллиловый спирт, имея в молекуле кратную связь и гидроксильную группу, проявляет свойства спиртов и непредельных соединений:
1. Взаимодействие с галогенами с образованием β — дигалоидгидринов глицерина
Совершенно иначе, чем этиловый спирт, относится аллиловый спирт к хлору и брому; тогда как обыкновенный спирт дает с ними продукты замещения и окисления (напр. хлораль), аллиловый спирт прямо присоединяет два атома хлора, брома или йода, образуя β-дигалоидгидрины глицерина C3H6Cl2O, C3H6Br2O и C3H6J2O:
2. Реакция гидрирования:
3. Реакция гидратации в присутствии кислорода с образованием глицерина:
4. Окисление с образованием альдегида
Окислителями переводится в альдегид — акролеин, дальнейшее окисление дает акриловую кислоту:
5. Взаимодействие со щелочными металлами с образованием алкоголятов
Со щелочными металлами получаются алкоголяты, которые при действии хлористого аллила дают соответствующий этиловому эфиру аллиловый эфир (С3Н5)2О:
6. Межмолекулярная дегидратация спиртов с образование простых эфиров:
7. Взаимодействие с минеральными и органическими кислотами с образованием сложных эфиров
Образование сложных эфиров происходит при взаимодействии с минеральными и органическими кислотами:
8. Взаимодействие с магнийгалогеналкилами
Происходит замещение гидроксильного водорода на магнийгалоген и выделение углеводорода:
9. Взаимодействие с хлористым фосфором — PCl3
Треххлористый фосфор дает хлористый аллил C3H5Cl, изомерный с α- и β – хлорпропиленами:
Аналогичным путем образуется йодистый аллил C3H5J:
10. Гидратация под действием слабых минеральных кислот
При действии слабых минеральных кислот аллильный спирт способен присоединять элементы воды, причем превращается в пропиленгликоль который, вновь теряя воду, переходит уже в изомерный с аллиловым спиртом пропионовый альдегид или его продукты конденсации:
Полимеризация аллилового спирта идет по следующей схеме:
Операторная модель химико-технологической системы
Операторная схема жидкофазного гидролиза хлористого аллила в аллиловый спирт представлена на рисунке 1.
Хлорпроизводное и водный раствор гидролизирующего агента подают на всасывающую линию компрессора 2, который эмульгирует смесь и сжимает её до давления 15 атм. Причем переключающее устройство гидравлического клапана пускает в действие поршневую ступень компрессора. При этом, в системе давление повышается до желаемого уровня.
В подогревателе 3 реакционная масса нагревается до температуры 1400С, и в изолированном от теплопотерь реакторе 4 процесс ведут до высокой степени конверсии хлорпроизводного (95% и более). После этого жидкость дросселируют в клапане редуктора 5 почти до атмосферного давления, причем часть ее в испарителе — сепараторе 6 испаряется и пары отделяются от жидкости. Органические продукты отгоняют с острым водяным паром; из нижней части испарителя 6 отводят раствор хлористого натрия и избыток щелочи.
В ректификационной колонне 7 аллиловый спирт отделяют, азеотропной перегонкой от диаллилового эфира. Из верхней части колонны при 77,8°С отбирают тройную азеотропную смесь аллилового спирта, диаллилового эфира и воды. Смесь поступает в сепаратор 8, где разделяется на два слоя: нижний (89,5% воды, 10% аллилового спирта и 0,5% диаллилового эфира), и верхний (90% диаллилового эфира; 8,6% аллилового спирта и 1,4% воды). Из сепаратора 8 верхний слой перетекает в аппарат 9, куда также подают воду для извлечения аллилового спирта в сепараторе 10. Из нижней части колонны 7 жидкость направляют в ректификационную колонну 11 для выделения аллилового спирта.
В процессе синтеза, с ректификационных колонн 7, 11, 13 аллиловый спирт поступает в сборник 14.
Щелочь из испарителя — сепаратора 6 вновь возвращается на стадию синтеза.
Побочные продукты от ректификационных колонн 11 и 13: вода и диаллиловый эфир, поступают на стадию утилизации сырья.
Разработка и оптимизация методов получения аллилового спирта является актуальной в химической технологии.
Пропеновый спирт, полупродукт производства глицерина, синтетических смол и пластических материалов, и используется в производстве фармацевтических препаратов и в химическом синтезе вообще, но самое большое применение аллиловый спирт нашел в производстве различных сложных эфиров аллила, из которых наиболее важными являются диаллил — фталат и диаллил — изофталат , которые служат в качестве мономеров и реполимеров .
Рис.1. Операторная схема получения аллилового спирта из хлористого аллила:
1 — смеситель; 2 — компрессор; 3 — подогреватель; 4 – реактор; 5 – редуктор; 6 – испаритель — сепаратор; 7, 11, 13 — ректификационная колонна; 8, 10 – сепаратор; 9, 12 – смеситель; 14- сборник
Химические свойства. 1.2.1. Реакции с участием связи O−H
Читайте также:
|
|
Алкоксиды (алкоголяты) нельзя получить реакцией спирта с гидроксидами металлов, их синтезируют реакцией спирта с активным металлом (Na, K, Mg, Al и др.).
Кислотные свойства спиртов убывают в ряду:
Основность. Спирты представляют собой основания, сравнимые по силе с водой. При действии сильных кислот они превращаются в соли.
Взаимодействие с магнийгалогеналкилами. В этой реакции происходит замещение гидроксильного водорода на магнийгалоген и выделяется углеводород.
В случае использования СН3MgJ выделяется метан. По объему выделившегося метана определяют количественное содержание гидроксильных групп.
Образование сложных эфиров. Благодаря наличию электронной пары на атоме кислорода спирт является нуклеофильным реагентом. В качестве нуклеофила он выступает в реакциях образования сложных эфиров. Спирт может атаковать электронодефицитный атом углерода карбонильной группы хлорангидридов, ангидридов кислот и кислот (реакция ацилирования спирта).
|
1.2.2. Реакция с участием связи R–OH
Электроотрицательный кислород, оттягивая общую пару электронов связи 

Образование алкилгалогенидов. Спирты легко реагируют с галогеноводородами (HCl, HBr, HI). Реакционная способность падает в ряду НI > HBr > HCl.
Сухой газообразный галогеноводород пропускают в спирт или спирт нагревают с концентрированным раствором галогеноводорода. Реакция катализируется кислотами. Спирт, присоединяя протон, превращается в ион алкилоксония, который гораздо легче отщепляет нейтральную молекулу воды (“хорошая” уходящая группа), чем спирт – ион ОН y (“плохая” уходящая группа).
Метиловый и первичные спирты реагируют по механизму SN2.
Механизм:сначала происходит протонирование спирта 
|
Вторичные и третичные спирты взаимодействуют с галогеноводородами по механизму SN1.
Механизм:
1 стадия, медленная:
2 стадия, быстрая:
Поскольку реакции замещения у вторичных и третичных спиртов протекают через стадию образования карбониевого иона, возможна перегруппировка.
Механизм перегруппировки:
Реакционная способность спиртов по отношению к галогенводородам изменяется следующим образом:
|
Бензиловый, аллиловый > третичный > вторичный > первичный
Механизм реакции спирта с тионилхлоридом. Взаимодействие одного моля спирта с одним молем тионилхлорида приводит к нестойкому алкилхлорсульфиту.
В присутствии основания, обычно пиридина, происходит инверсия путем атаки хлорид-иона на хлорсульфит.
|
Однако при проведении синтеза в эфире в отсутствии основания создаются условия для сохранения конфигурации. Частица y ОSOCl вытесняется из хлорсульфита и при этом создается тесная ионная пара, в которой атом хлора с фронта (со стороны уходящей группы) атакует углеродный атом.
Такой тип реакций называют внутримолекулярным (интрамолекулярным) замещением и обозначают символом SNi.
Образование простых эфиров – межмолекулярная дегидратация. Межмолекулярная дегидратация спиртов служит примером нуклеофильного замещения, в котором субстратом является протонированная молекула спирта, а другая молекула ROH служит нуклеофилом.
Первичные спирты реагируют по механизму SN2
Механизм:
Протонирование спирта:
Протонированный спирт подвергается атаке нуклеофилом
|
Применение этой реакции ограничено получением симметричных эфиров, т.к. при использовании различных спиртов получается смесь трех эфиров.
Важным методом получения простых эфиров является реакция алкоксидов с алкилгалогенидами (синтез Вильямсона) или алкилсульфатами ROSO2OR.
Бόльшая нуклеофильность алкоксидиона RО y по сравнению со спиртом ROH означает бόльшую склонность к тому, чтобы выступать в качестве основания в реакции элиминирования. Поэтому при получении смешанных эфиров ROR1 следует учитывать возможность протекания конкурирующих реакций: нуклеофильного замещения и элиминирования. Например, для получения метилизопропилового эфира следует использовать йодистый метил и изопропилоксид натрия (пример 1), а не изопропилиодид и метоксид натрия (пример 2).
Пример 1:
Пример 2:
Вторичные и третичные спирты не подвергаются межмолекулярной дегидратации, а реагируют с образованием продуктов внутримолекулярной дегидратации — алкенов.
|
Образование алкенов – внутримолекулярная дегидратация. Под влиянием электроотрицательного кислорода на связанном с кислородом атоме углерода появляется положительный заряд, это вызывает поляризацию связи углерод-углерод и далее связи 
Спирт превращается в алкен при температуре
200 о С в присутствии серной или фосфорной кислоты, либо при пропускании паров спирта над окисью алюминия (Al2O3 — кислота Льюиса) при температуре 300-350 о С.
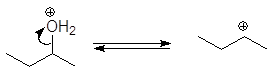
Механизм дегидратации Е1:
Первая стадия, медленная – диссоциация протонированного спирта с образованием карбониевого иона.
Вторая стадия, быстрая: карбокатион теряет протон и образует алкен.
|
В отличие от галогеналканов, которые подвергаются элиминированию в основном по механизму Е2, спирты реагируют только по механизму Е1. Элиминирование Е2 требует присутствия сильного основания для отщепления протона, но кислая среда, необходимая для протонирования спирта, и сильное основание не совместимы.
Направление элиминирования. Элиминирование спиртов происходит с образованием более устойчивого, т.е. более алкилированного алкена (правило Зайцева).
Перегруппировка. Поскольку реакция Е1 протекает через стадию образования карбокатиона, она может сопровождаться перегруппировкой:
Дата добавления: 2014-12-30 ; просмотров: 53 ; Нарушение авторских прав
Получение алкилгалогенидов действием на спирты тионилхлорида
Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя неподеленными парами электронов. В молекуле спиртов можно выделить следующие реакционные центры:
1. ОН-кислотный центр, обусловливающий возможность отщепленя протона вследствие высокой полярности связи О-Н;
2. нуклеофильный и n-основный центр — атом кислорода, имеющий неподеленные пары электронов;
3. электрофилный центр — a-атом углерода, на котором дефицит электронов вызван -I-эффектом соседней гидроксильной группы;
4. b-С-кислотный центр, в котором поляризация связи С-Н также обусловлена электроноакцепторным влиянием гидроксильной группы.
1. Получение алкилгалогенидов действием на спирты
Одним из лучших лабораторных способов превращения спиртов в алкилхлориды является их взаимодействие с тионилхлоридом. Тионилхлорид превращает первичные и вторичные спирты в алкилхлориды с выходом 70-90%. Образующиеся наряду с продуктом замещения хлороводород и диоксид серы газы, что облегчает выделение целевого продукта. Следует различать две разновидности этой реакции: в присутствии или в отсутствии основания (пиридина С5Н5N или триэтиламина Et3N и других третиичных аминов). Амин играет двоякую роль. Прежде всего, он способствует образованию алкоксид-аниона. Кроме того, он связывает выделяющийся хлороводород:
Реакция (S)-2-бутанола с тионилхлоридом в присутствии пиридина проходит с обращением конфигурации:
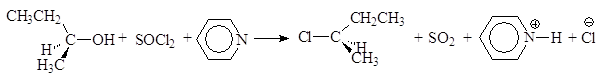
(S)-2-бутанол (R)-2-хлорбутан пиридинийхлорид
На первой стадии реакции с сохранением конфигурации образуется хлорсульфит:
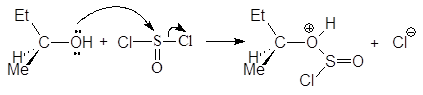
На второй стадии хлорсульфитная группа замещается на хлор по механизму SN2 с обращением конфигурации. В присутствии основания выделяющийся на первой стадии хлороводород превращается в соль:
Замещение гидроксильной группы первичных и вторичных спиртов на хлор под действием тионилхлорида в присутствии пиридина сопровождается перегруппировками, например:
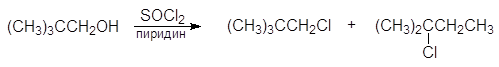
неопентиловый спирт неопентилхлорид 2-метил-2-хлорбутан
Реакция (S)-2-бутанола с тионилхлоридом в отсутствии пиридина проходит с рацемизацией:
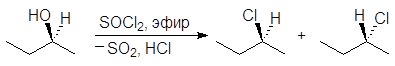
Дело в том, что в отсутствии основания хлорсульфит превращается сначала в ионную пару. Ионная пара далее превращается в алкилгалогенид и диоксид серы. При этом образуются продукты, как с сохранением, так и с обращением конфигурации.
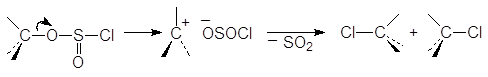
Третичные спирты в этих условиях превращаются в алкены.
2. Образование алкилсульфонатов
Еще один путь превращения гидроксильной группы спиртов в хорошую уходящую группу — превращение их в мезилаты и тозилаты. Например, спирты реагируют с метансульфонилхлоридом (мезилхлоридом Ms¾Cl) или с п-толуолсульфонилхлоридомом (тозилхлоридом Тs¾Cl) превращаясь соответственно в алкилмезилаты или алкилтозилаты:
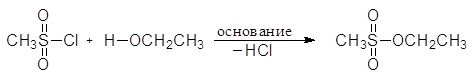
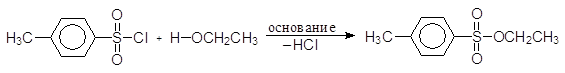
Превращение спиртов в алкилсульфонаты позволяет осуществлять с ними реакции нуклеофильного замещения. Стадия превращения спирта в алкилсульфонат идет с сохранением конфигурации, а вот стадия взаимодействия алкилсульфоната с нуклеофилом проходит с обращением конфигурации:
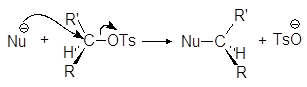
Алкилсульфонаты вступают во все реакции, характерные для галогенуглеводородов. Из них, например, могут быть получены различные галогензамещенные углеводороды. Для этого спирты сначала превращают в алкилсульфонаты, например в тозилаты, которые легко могут быть выделены и очищены. Далее сульфонатную группу замещают на другую функциональную группу. Подобного рода превращения иллюстрируются упражнениями 17-21.
Упр.17. Какова конфигурация 2-бутанола, образующегося в результате превращения (R)-2-бутанола в тозилат и с последующей реакцией тозилата со щелочью по механизму SN2?
Упр.18. Каким образом через тозилат может быть осуществлено следующее превращение?
Дегидратация спиртов подробно осуждалась в главе 8 Алкены (см. реакции 5-10, м 1-5 и упр 8.1 и 8.2). При нагревании спиртов с концентрированной серной кислотой они отщепляют воду. В случае вторичных и третичных спиртов отщепление воды протекает согласно эмпирическому правилу Зайцева: протон отщепляется предпочтительно от наименее гидрогенизированного b-атома углерода. Иными словами, двойная связь образуется у наиболее замещенного атома углерода:
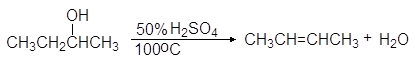
Легкость элиминирования возрастает при переходе от первичных спиртов к третичным, что нашло отражение в условиях проведения реакций. Так первичные спирты дегидратируются в довольно жестких условиях — 170 — 200 о С с использованием концентрированной серной кислоты:
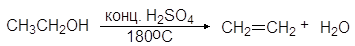
Дегидратация вторичных спиртов происходит при температур 100 — 150 о С с менее концентрированными кислотами:
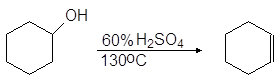
Еще легче отщепляют воду третичные спирты — 80 — 100 о С в присутствии более мягких дегидратирующих агентов (разбавленная серная кислота, щавелевая или п-толуолсульфоновая кислота):
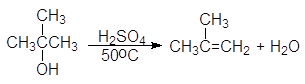
Дегидратация вторичных и третичных спиртов протекает по механизму Е1.
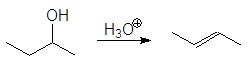
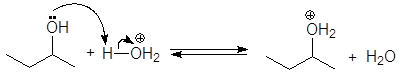
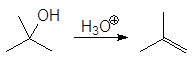
проходит по механизму:
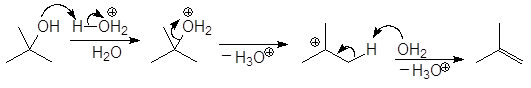
Первичные спирты дегидратируются по механизму E2,
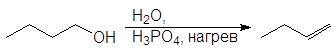
Дегидратация первичных и вторичных спиртов часто сопровождается перегруппировками, например:
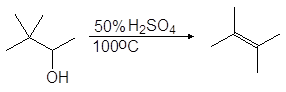
Упр.22. Опишите механизм реакции (68).
Упр.23. Опишите механизмы реакций:
(а) 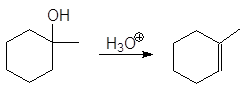
(в)
(а)
Упр. 24. Напишите реакции:
(а)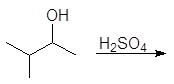
(в)
(г)
http://lektsii.com/1-45992.html
http://kazedu.com/referat/111167