Химические свойства амфотерных оксидов
Перед изучением этого раздела рекомендую изучить следующие темы:
Химические свойства амфотерных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например , оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
амфотерный оксид + кислотный оксид = соль
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
| Соль состава X2YO2 * . Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4] * . Например: Na2[Zn(OH)4] | |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6] * или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например :
амфотерный оксид + щелочь (расплав) = соль + вода
амфотерный оксид + щелочь (раствор) = комплексная соль
4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
5. Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например , твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Уравнение реакции амфотерные оксиды с основными
Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:
Na I 2O – оксид натрия; Са II О – оксид кальция;
S IV O2 – оксид серы (IV); S VI O3 – оксид серы (VI).
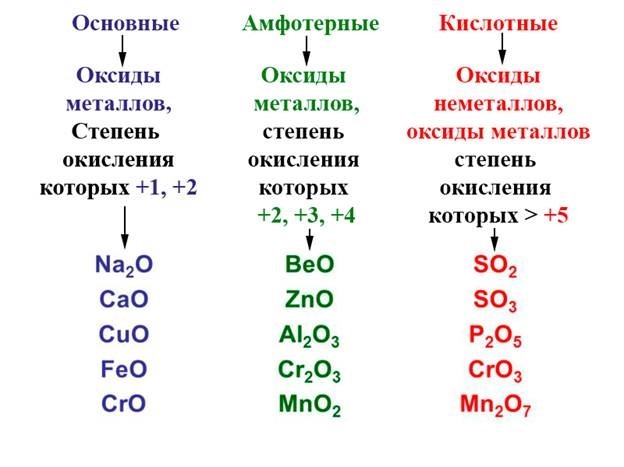
По химическим свойствам оксиды делятся на две группы:
1. Несолеобразующие (безразличные) – не образуют солей, например: NO, CO, H2O;
2. Солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3, Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).
Например, оксиду кальция CaO отвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмия Cd(OH)2.
Например, оксиду серы (IV) соответствует сернистая кислота H2SO3 .
Оксиды, гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными.
Например: оксид алюминия Al2O3, оксид марганца (IV) MnO2.
Тема №10 «Характерные химические свойства основных, амфотерных и кислотных оксидов»
Основные химические свойства различных типов оксидов, виды оксидов и их химические свойства.
Характерные химические свойства основных, амфотерных и кислотных оксидов
Оглавление
Оксиды
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (-2). Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды могут быть твердыми (песок SiO2, разновидности кварца), жидкими (оксид водорода H2O), газообразными (оксиды углерода: углекислый CO2 и угарный СО газы).
Номенклатура химических соединений развивалась по мере накопления фактического материала. Сначала, пока число известных соединений было невелико, широко использовались тривиальные названия, не отражающие состава, строения и свойства вещества, — сурик РЬ3О4, глет РЬО, жженая магнезия MgO, железная окалина Fe3О4, веселящий газ N2О, белый мышьяк As2О3• На смену тривиальной номенклатуре при шла полусистематическая номенклатура — в название были включены указания числа атомов кислорода в соединении: закись — для более низких, окись — для более высоких степеней окисления; ангидрид — для оксидов кислотного характера.
В настоящее время почти завершен переход к современной номенклатуре. Согласно международной номенклатуре, в названии оксида следует указывать валентность элемента; например, SО2 — оксид cepы(IV), SО3 — оксид cepы(VI), CrO — оксид хрома(II), Cr2О3 — оксид хрома(III), CrO3 — оксид хрома(VI).
По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие.
Несолеобразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и не образуют солей. Их немного, в состав входят неметаллы.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
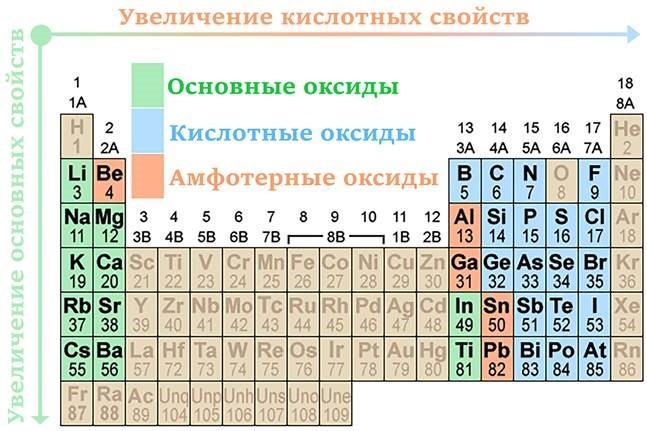
Среди солеобразующих оксидов различают оксиды основные, кислотные, амфотерные.
Основные оксиды — это такие оксиды, которым соответствуют основания. Например: CuO соответствует основание Cu(OH)2, Na2O — основание NaOH, Cu2O — CuOH и т. д.
Типичные реакции основных оксидов
1. Основный оксид + кислота = соль + вода (реакция обмена):
2. Основный оксид + кислотный оксид = соль (реакция соединения):
3. Основный оксид + вода = щелочь (реакция соединения):
Кислотные оксиды — это такие оксиды, которым соответствуют кислоты. Это оксиды неметаллов: N2O5 соответствует HNO3, SO3 — H2SO4, CO2 — H2CO3, P2O5 — H4PO4 а также оксиды металлов с большим значением степеней окисления: Cr2 +6 O3 соответствует H2CrO4, Mn2 +7 O7 — HMnO4.
Типичные реакции кислотных оксидов
1. Кислотный оксид + основание = соль + вода (реакция обмена):
2. Кислотный оксид + основный оксид соль (реакция соединения):
3. Кислотный оксид + вода = кислота (реакция соединения):
Такая реакция возможна, только если кислотный оксид растворим в воде.
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Это ZnO, Al2O3, Cr2O3, V2O5.
Амфотерные оксиды с водой непосредственно не соединяются.
Типичные реакции амфотерных оксидов
1. Амфотерный оксид + кислота = соль + вода (реакция обмена):
2. Амфотерный оксид + основание = соль + вода или комплексное соединение:
 Получение оксидов
Получение оксидов
Основные оксиды. К основным относят оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов
Окисление металлов при нагревании в атмосфере кислорода.
Метод неприменим для получения оксидов щелочных металлов. В реакции с кислородом щелочные металлы обычно дают пероксиды, поэтому оксиды Na2O, К2O труднодоступны.
Обжиг сульфидов
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
Разложение гидроксидов
Этим методом нельзя получить оксиды щелочных металлов.
Разложение солей кислородсодержащих кислот.
Разложение легко осуществляется для нитратов и карбонатов, в том числе и для основных солей.
Получение кислотных оксидов
Кислотные оксиды представлены оксидами неметаллов или переходных металлов в высоких степенях окисления. Они могут быть получены методами, аналогичными методам получения основных оксидов, например:
Шпаргалка
Справочный материал для прохождения тестирования:
http://www.sites.google.com/site/school302project/temy/10-himiceskie-svojstva-oksidov-osnovnyh-amfoternyh-kislotnyh
http://chem-mind.com/2017/03/16/%D1%82%D0%B5%D0%BC%D0%B0-%E2%84%9610-%D1%85%D0%B0%D1%80%D0%B0%D0%BA%D1%82%D0%B5%D1%80%D0%BD%D1%8B%D0%B5-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5-%D1%81%D0%B2%D0%BE%D0%B9/








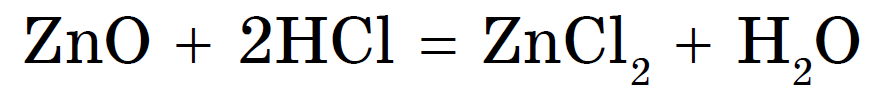
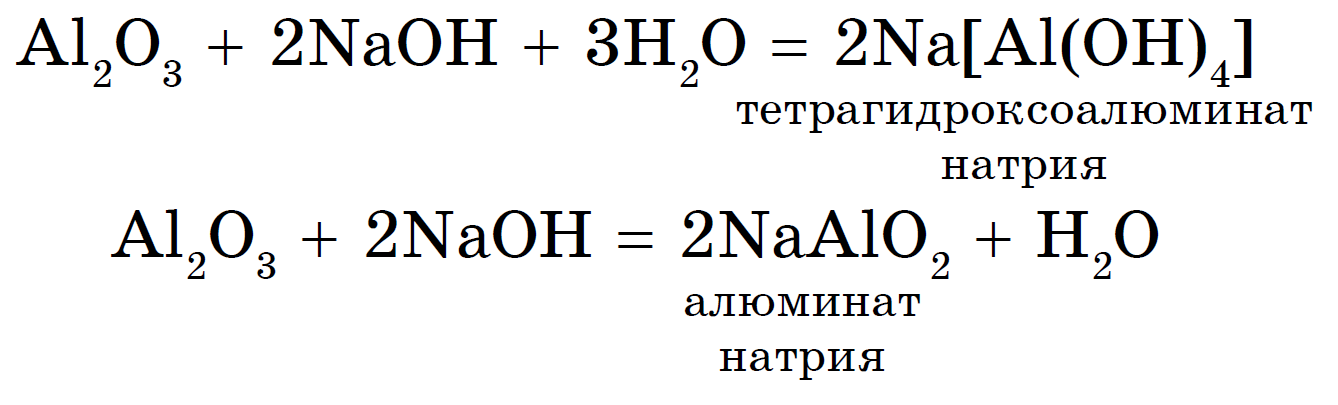
 Получение оксидов
Получение оксидов