Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
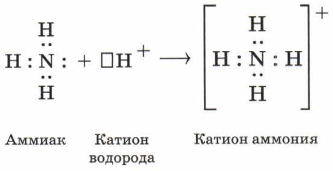
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Уравнение реакции аммиак с водой запишите уравнения
Как объяснить хорошую растворимость аммиака в воде? Какие процессы при этом происходят? Запишите уравнения реакций.
Аммиак прекрасно растворяется в воде вследствие своей полярности (в одном объёме воды растворяется 700 объёмов аммиака), а также благодаря образованию водородных связей между молекулами аммиака и воды.
За счёт неподелённой пары электронов атома азота молекулы аммиака устанавливают прочную ковалентную связь с ионом водорода молекулы воды по донорно-акцепторному механизму с образованием катиона аммония NH4 + :
В водном растворе ион аммония играет роль катиона, а гидроксид-ион воды создаёт щелочную среду. Реакции аммиака с кислотами идут по такому же механизму, как и с H2O.
Помогите составить ионное уравнение : Аммиак + вода =?
Химия | 5 — 9 классы
Помогите составить ионное уравнение : Аммиак + вода =.
NH3 + H2O = NH4OH
NH3 0 + H2O = NH4 + + OH -.
Осуществить превращения по схеме : аммиак — > ; хлорид аммония — > ; аммиакдля ОВР составить её баланс для РИО полное ионное уравнение N2 + 3H2 — > ; 2NH3?
Осуществить превращения по схеме : аммиак — > ; хлорид аммония — > ; аммиак
для ОВР составить её баланс для РИО полное ионное уравнение N2 + 3H2 — > ; 2NH3.
Помогите составить полное и сокращенное ионное уравнение?
Помогите составить полное и сокращенное ионное уравнение.
Помогите составить ионное уравнение?
Помогите составить ионное уравнение!
Как выглядит уравнение отражающее взаимодействие аммиака с водой?
Как выглядит уравнение отражающее взаимодействие аммиака с водой.
Полярные молекулы аммиака :1)Практически нерастворимы в воде2)очень хорошо растворимы в воде3)в жидком аммиаке связаны ионными сязями4)в водном растворе практически мгновенно диссоциирует на ионы H и ?
Полярные молекулы аммиака :
1)Практически нерастворимы в воде
2)очень хорошо растворимы в воде
3)в жидком аммиаке связаны ионными сязями
4)в водном растворе практически мгновенно диссоциирует на ионы H и N.
Составить уравнение взаимодействия аммиака с водой в молекулярном и ионном виде, описать условия проведения реакции и ее признаки?
Составить уравнение взаимодействия аммиака с водой в молекулярном и ионном виде, описать условия проведения реакции и ее признаки.
Помогите пожалуйста?
Из этих ионных уравнения нужно составить полные ионные уравнения.
Помогите составить ионное и молекулярное уравнения ZnCl2 + 2NaOH?
Помогите составить ионное и молекулярное уравнения ZnCl2 + 2NaOH.
2KOH + H2SO4 = K2SO4 + 2H2O Помогите составить ионное и сокращённое ионное уравнение : )?
2KOH + H2SO4 = K2SO4 + 2H2O Помогите составить ионное и сокращённое ионное уравнение : ).
Даны реакции?
Составь ионные уравнения реакций при условии что взята известковая вода.
Вы перешли к вопросу Помогите составить ионное уравнение : Аммиак + вода =?. Он относится к категории Химия, для 5 — 9 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
Формула сахарозы (сахара) — C12H22O11. 25% = 0, 25 m(C12H22O11) = 300г * 0, 25 = 75г m(H2O) = 300г — 75г = 225г V(H2O) = 225г : 1г / см3 = 225 см3 1 см3 = 1мл 225 см3 = 225 мл.
Держи, первые 4 вопроса точно здесь найдёшь.
На рисунке видно уменьшение радиуса Поэтому подходит только Ответ 4.
1. в 2. Г 3. б 4. А 2. б, в, а, г 3. Г 4. знаходима масу сульфатної кислоти у розчині : 300г·0, 196 = 58, 8г Хг 58, 8г 2NaOH + H2SO4 = Na2SO4 + 2H2O 80г 98г Х = 80г··58, 8г / 98г = 48г.
3CuO. + 2Al. — > Al2O3. + 3Cu Cu( + 2) + 2e — > Cu(0) 3. В — ие ок — ль Al(0) — 3e — > Al( + 3) 2. Ок — ие в — ль.
2H2O = 4H2 + O2Mr(H2O) — 36составляем пропорцию108 / 36 : икс / 32 = икс = 108 * 32 / 36 = 96грамм / дробная черта * умножить.
K⁻¹₂S⁺² самостоятельного соединения K2S2 — нету.
http://gomolog.ru/reshebniki/9-klass/kuznecova-2019/27/3.html
http://himia.my-dict.ru/q/1685117_pomogite-sostavit-ionnoe-uravnenie-ammiak-voda/