Нитрид трийода
| Нитрид трийода | |||
|---|---|---|---|
| |||
| Систематическое наименование | Йодид азота | ||
| Хим. формула | NI3 | ||
| Состояние | кристаллы | ||
| Молярная масса | 394.77 г/моль | ||
| Температура | |||
| • кипения | возгоняется при — 20 °C | ||
| • разложения | от 0 до 25 С | ||
| Рег. номер CAS | 13444-85-4 | ||
| PubChem | 61603 | ||
| SMILES | |||
| ChemSpider | 55511 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
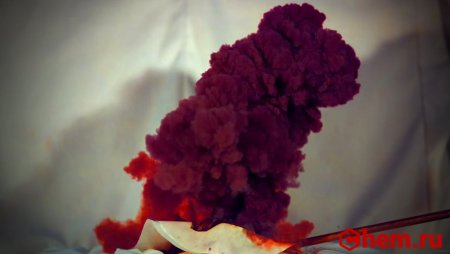
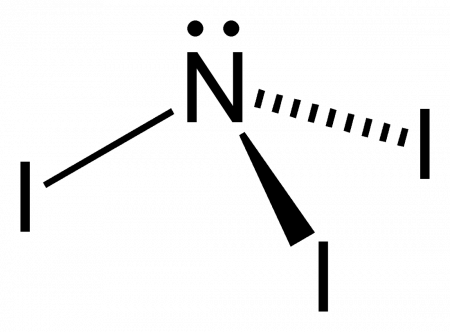
Нитрид трийода (иногда йодистый азот, ошиб. азид йода) — чрезвычайно взрывчатое неорганическое соединение с формулой NI3. Обычно известен в виде чёрно-коричневых кристаллов — аддукта с аммиаком NI3· n NH3 (аммиаката), но был получен и в индивидуальном виде реакцией BN с IF при низких температурах.
Представляет собой чёрные кристаллы, очень чувствительные к механическим воздействиям. В сухом виде взрывается от прикосновения, образуя розовато-фиолетовое облако паров йода. Это единственное вещество, которое взрывается под воздействием альфа-частиц и других продуктов ядерного распада.
Содержание
Свойства
Аддукт нитрида йода разлагается при взаимодействии с диэтилцинком:
Благодаря именно этой реакции установлено строение аддукта йодида азота с аммиаком http://pubs.rsc.org/en/content/articlepdf/1905/ct/ct9058700055 [2]
Во влажном виде при наличии избытка аммиака в растворе сравнительно устойчив. Единственное известное взрывчатое вещество, способное сдетонировать от альфа-излучения. Из-за крайней нестабильности применяется исключительно как эффектный химический фокус.
Нестабильность вещества вызвана большой длиной связи N−I и огромными размерами трёх атомов йода, приходящихся на один атом азота, и соответственно низкой энергией активации реакции разложения.
Нерастворим в этаноле. Разлагается горячей водой, кислотами-окислителями, щелочами.
Разложение чистого вещества протекает по следующей реакции:
Аммиак, который присутствует в аддукте, является восстановителем для образующегося йода:
Нитрид трийода подвергается гидролизу с образованием оксида азота III и йодоводородной кислоты:
Получение
Получают взаимодействием водного раствора аммиака (нашатырный спирт) — обычно 25 % и спиртового раствора йода в соотношении 1:2. При смешивании выпадает чёрный или бурый осадок, представляющий собой продукт присоединения аммиака к нитриду трийода.
Возможно использование кристаллического йода вместо раствора, в этом случае кристаллы йода поливают раствором аммиака. При реакции с безводным аммиаком в условиях низких температур образующийся продукт имеет состав NI3 ⋅ (NH3)5 , при нагревании он начинает терять часть аммиака.
Осадок может быть очищен от примеси аммиака промыванием спиртом, но при этом его детонационная чувствительность сильно возрастает.
Биологическая роль
Йодид азота III — потенциально опасное вещество. Является ирритантом (в очень больших количествах), взрывоопасен.
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
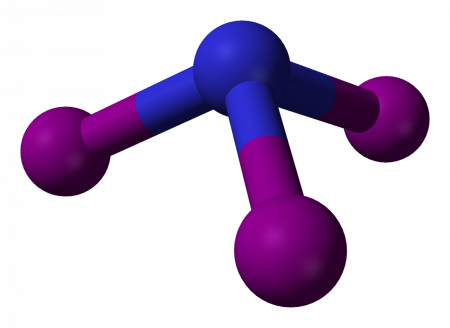
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Удаление нежелательных волос с помощью йода и аммиака
Воздействие аммиака и йода на волосяные фолликулы

Вообще, йодная и нашатырная спиртовые настойки, как пишется официально в инструкции, вместе не совместимы, так как могут усиливать негативное влияние на организм в комбинации. Для удаления нежелательных волос это то, что нужно. Эта смесь еще сильнее ускоряет выпадение волосков, с помощью которой можно полностью избавиться от волосяного покрова за считанные недели. Более того, смесь йода и нашатырного спирта не окрашивает волосы, так как йод теряет свой яркий коричневый цвет в нашатыре, становясь черным.
Плюсы и минусы от удаление нежелательных волос
Хоть это действенный и достаточно серьезный способ устранения лишнего волосяного покрова, после которого волос может уже больше не появиться на теле, тем не менее, такой метод борьбы с оволосением чреват негативными последствиями при неаккуратном применении, имеет свои противопоказания.
Основные риски, связанные с применением йодно-аммиачной смеси:
- Легко заработать ожог на коже, особенно если она сухая или чувствительная
- Можно получить в конечном итоге дерматит, шелушение или аллергическую реакцию
- Эта смесь здорово сушит кожные покровы
- Можно получить желтоватый оттенок кожи на теле, который будет тяжело смыть
- Всегда существует риск, что в индивидуальном случае эта смесь окажется неэффективной в плане избавления от волосяного покрова, но негативные эффекты будут проявлены на состоянии кожи сполна
- Также возможно, что растительность тела исчезнет на некоторое время, но нет гарантии, что со временем новые волоски не появятся снова.

Ни в коем случае нельзя наносить препарат на лицо, там кожа более нежная, нежели на теле и существует еще больший риск заработать себе аллергию, покраснения, ожоги. Лучше всего перед нанесением смеси на тело провести тест на чувствительность к каждому компоненту рецепта. По очереди следует немного нанести каждый препарат и понаблюдать, не появится ли через некоторое время сыпь, зуд или покраснение. Если появилась любая возможная реакция чувствительности на один из компонентов, значит, следует отказаться от этого способа удаления волосков на теле.
Рецепт йодно-нашатырной смеси
Это классический вариант удаления волосков с помощью спиртовых настоек йода, аммиака, медицинского спирта и касторового масла.
Требуется вместе размешать в 30-ти граммах спирта 70% или 96%: 5 грамм нашатыря, полтора грамма йода, 5 грамм касторового масла. Кожа смазывается ежедневно, 2-3 раза в сутки. В зависимости от строения волосяной луковицы, они выпадут у кого-то через пару дней, а у кого-то через 2-3 недели. Если мазать более трех недель, а результата нет, значит, данный способ не подошел и процедуру требуется поскорее прекратить.
http://chemege.ru/ammiak/
http://lekhar.ru/lekarstva/antiseptiki/jod-i-ammiak-ot-volos/