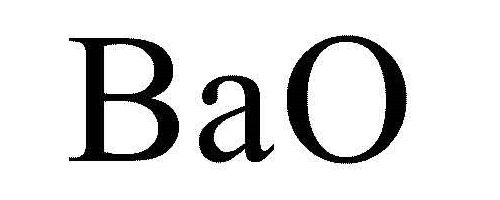Оксид бария: способы получения и химические свойства
Оксид бария BaO — бинарное неорганическое вещество. Белый, тугоплавкий, термически устойчивый, летучий при высоких температурах. Энергично реагирует с водой (образуется щелочной раствор). Проявляет основные свойства.
Относительная молекулярная масса Mr = 153,33; относительная плотность для тв. и ж. состояния d = 5,72; tпл ≈ 2020º C.
Способ получения
1. Оксид бария получается при разложении карбоната бария при температуре 1000 — 1450º C. В результате разложения образуется оксид бария и углекислый газ:
2. В результате разложения нитрата бария при температуре 620 — 670º С образуется оксид бария, оксид азота (IV) и кислород:
3. Оксид бария можно получить сжиганием бария в в кислороде при температуре до 500º С, в результате реакции образуется оксид бария:
2Ba + O2 = 2BaO,
4. Пероксид бария разлагается при температуре выше 790º С с образованием оксида бария и кислорода:
5. Карбонат бария вступает в реакцию с углеродом (коксом) и образует оксид бария и угарный газ при выше 1000º С:
BaCO3 + C = BaO + 2CO
Химические свойства
1. Оксид бария реагирует с простыми веществами :
1.1. Оксид бария реагирует с кислородом при температуре до 500º С и образует пероксид бария:
2BaO + O2 = 2BaO2
1.2. При 1100 — 1200º С оксид бария вступает в реакцию с алюминием и образует барий и алюминат бария:
4BaO + 2Al = 3Ba + Ba(AlO2)2
1.3. Оксид бария вступает во взаимодействие с кремнием при 1200º С с образованием силиката бария и бария:
3BaO + Si = BaSiO3 + 2Ba
2. Оксид бария взаимодействует со сложными веществами:
2.1. Оксид бария взаимодействует с кислотами:
Оксид бария с разбавленной соляной кислотой образует хлорид бария и воду:
BaO + 2HCl = BaCl2 + H2O
2.2. Оксид бария реагирует с кислотными оксидами.
Оксид бария при комнатной температуре реагирует с углекислым газом с образованием карбоната бария:
BaO + CO2 = BaCO3
2.3. Оксид бария взаимодействует с водой при комнатной температуре, образуя гидроксид бария:
Оксид бария: получение и применение
Многообразие окружающего мира не перестает удивлять человечество. Исследователи открывают перед нами новые горизонты, основываясь на полученных результатах предыдущего поколения. В этом смысле химия – наука, которая не может быть полностью изученной, современные технологические решения находят наиболее оптимальные и необходимые области применения для уже познанных человечеством элементов. XIX век стал временем открытий, XXI – периодом более эффективного их использования. Например, оксид бария, — вещество, изученное многосторонне, но кто знает, какие новые технологии будут связаны с ним в будущем.
Барий
Щелочноземельный металл, который входит в состав земной коры привлек внимание химиков в XVIII веке. Первое упоминание об этом элементе связано с его кислородным соединением – оксидом бария. Он имеет очень высокую для своего вида плотность, поэтому получил название «тяжелый», которое в дальнейшем стало названием самого элемента. Металл химически активен, поэтому для его получения в чистом виде необходимо провести ряд реакций в присутствии катализатора. Наиболее распространенным в природе минералом, содержащим барий, является его сульфат BaSO4 (тяжелый шпат барит) и BaCO3 (витерит). Именно с данными соединениями связан процесс получения такого вещества, как оксид бария. В дальнейшем оно используется для выделения металла в чистом виде и имеет собственные направления применения.
Важнейшие соединения
Как и все типичные металлы, барий вступает в химическую реакцию с кислородом, при этом полученное вещество зависит от условий процесса и катализатора. Например, простая реакция окиси с водой дает возможность образовывать Ba(OH)2 — гидроксид бария. Оксид бария получают из нитрата. Типичны соединения со всеми галогенами: BaF2, BaCI2, BaI2, BaS, BaBr2. Образование нитратов, сульфидов, сульфатов, происходит за счет взаимодействия минералов с соответствующими кислотными растворами. На сегодняшний день все важнейшие соединения бария находят свое применение. Но исключить новые открытия в сферы использования данного вещества нельзя, с ростом технологичности приборов его значение будет только возрастать как на промышленном, так и на бытовом уровне.
Оксиды
Бинарная связь химического элемента с кислородом наиболее распространенная форма вещества в природе. При этом оксиды образуют металлы и неметаллы. Именно характеристика элемента при взаимодействии с кислородом стала основой формирования периодической системы Менделеева Д. И. Для металлургической отрасли наиболее приемлемым способом выделения вещества является процесс его получения из оксида. Предварительно металлическая природная руда (соли металлов) подвергается различным химическим воздействиям, направленным на получение окиси. Как правило, данный процесс сопровождается нагреванием до необходимой температуры. Исключением не является и оксид бария. Формула полученного вещества имеет вид: BaO. Оксиды можно получить и другими способами. Например, из гидроксидов, солей и самих оксидов более высокой степени окисления.
Оксид бария
Прежде всего необходимо отметить, что все соединения данного металла токсичны (исключение составляет сульфат), поэтому требуется соблюдать элементарные правила безопасности при работе. Это касается многих химических элементов. Другое название – барит безводный — не следует путать с сульфатом, который является природным минералом. В нормальных (стандартных) условиях белые кристаллы или порошок, иногда бесцветные с типичной решеткой кубического вида, являются соединением металла с кислородом и называются оксид бария. Формула вещества — BaO. Техническая модификация оксида может иметь серый цвет, который ему придает уголь, не полностью выведенный из состава.
Физические свойства
Типичное агрегатное состояние оксида твердое, плотность 5,72 (20 0 С), молярная масса – 153,34 г/моль. Соединение имеет достаточно высокую теплопроводность 4,8-7,8 Вт/(мК)(80-1100К), и тугоплавкость температура кипения – 2000 0 С, плавления – 1920 0 С. Оксид бария был открыт в 1774 году Шееле Карлом Вильгельмом.
Получение
Существует несколько способов выделения такого вещества, как оксид бария. Применяются они в соответствии с поставленной целью и количеством получаемого вещества. Для лабораторных и промышленных условий подходят все способы, поэтому как получить оксид бария выбирает производитель. Применяемые методы:
- Кальцинированием предварительно осажденного нитрата бария, которое происходи с выделением чистого кислорода. 2Ba(NO3)2 = 2BaO + 4NO2 + O2.
- Реакция взаимодействия с кислородом металлического бария. 2Ba + O2 = 2BaO. Катализатором служит температура 500-600 0 С, в этом случае не исключено получение пероксида. 2Ba + O2 = 2BaO2. При дальнейшем нагревании до 700 0 С вещество распадается на свободный кислород и оксид бария.
- Для процесса разложения карбоната бария на оксид и углекислый газ необходимо воздействие высокой температуры. BaCO3 = BaO + CO2. Для получения более чистого конечного вещества необходимо удалить излишки углекислорода.
Химические свойства
Большинство бинарных соединений металла с кислородом проявляют основные свойства. Уравнение оксида бария (формула ВаО) показывает, что данное вещество относится именно к таким окислам. При этом данное соединение является солеобразующим. Типичные химические взаимодействия происходят со следующими классами веществ:
- Взаимодействие с водой происходит достаточно бурно, с выделением тепла и образование щелочного раствора. BaO + H2O = Ba(OH)2.
- С кислородом оксид взаимодействует при наличии катализатора (высокая температура 600-500 0 С), результатом является пероксид, разлагаемый в дальнейшем на составные части для выделения чистого металла или оксида. При этом необходимо увеличить нагрев до 700 0 С. 2Ba + O2 = 2BaO2.
- Как типичный основной оксид бария взаимодействует с кислотами, в результате химической реакции получается вода и соответствующая соль. BaO + H2SO4 = H2O + BaSO4 или BaO + 2HCI = H2O + BaCI2.
- Кислотные оксиды вступают в реакцию с BaO, результатом взаимодействия являются соли. BaO + CO2 = BaCO3 или BaO + SO3 = BaSO4.
- Для высвобождения чистого бария оксид прокаливают с металлами, которые забирают выделяемый кислород. В качестве таковых выступают кремний, алюминий, цинк или магний.
Применение
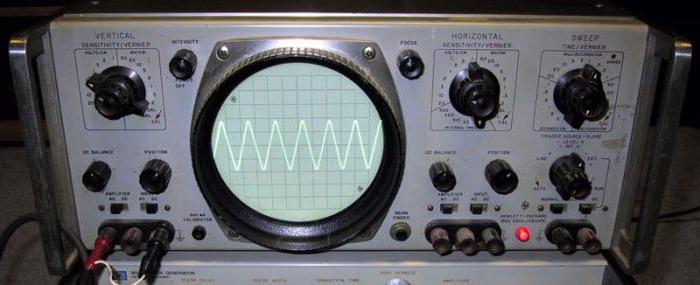
Барий и его соединения дают очень мощную яркость цвета при покрытии поверхности других веществ. Поэтому оксиды марганца и бария служат единицами измерения коэффициента яркости. Используется для получения зеленого цвета в пиротехнике, при декоративной отделке в составе глазурей и эмалей. Достаточно низкая стоимость обработки и получения, высокий уровень выделения тепла дает возможность использования окисла в качестве катализатора при проведении химических реакций. В частности, данное вещество применяется для выделения чистого металла (Ва), получения гидроксида и пероксида. Производство керамики, используемой при наиболее низких температурах (жидкий азот), происходит с участием оксида бария. В процесс синтеза включаются редкоземельные металлы и окись меди. Достаточно широк спектр применения вещества в приборостроении. Оксид бария используется для покрытия осциллографических и телевизионных трубок, различных видов катодов, электронновакуумных изделий. Служит в качестве активной массы для мощных аккумуляторов медноокисного вида. Оксид бария является одним из основных элементов в составе стекла, которое имеет достаточно специфичное направление применения, используется для покрытия поверхности стержней из урана. Для создания оптических стекол данное вещество так же незаменимо.
Оксид бария
Оксид бария известен в качестве соединения бария и кислорода. В письменном обозначении в составе химических формул оксид бария обозначается, как ВаО. В ряде химических реакций выступает оксидом основного вида. Допустим и элементарный визуальный анализ вещества в соответствии со стандартными условиями, где ВаО представлен в виде бесцветных кристаллов с кубической по форме решеткой.
Оксид бария входит в число элементов, относящихся к подгруппе IV, то есть к неорганическим основаниям, представленным оксидами, гидроксидами и пероксидами металлов. Любое из оснований данного вида представляет собой соединение, где явно выражено наличие гидроксильного радикала (OH). Такие основания реагируют с кислотой, вследствие чего характерно образование солей.
Сырье, в основном используемое при получении бария, применяется в виде барита или, что реже, витерита. Реакция получения оксида бария – это реакция восстановления минералов при помощи каменного угля, кокса либо газа природного происхождения. Собственно именно в результате взаимодействия данных веществ и происходит стабильное получение сульфида и оксида бария.
Основные уравнения реакций оксида бария
• Реакция взаимодействия металлического бария и кислорода, в результате которой происходит образование оксида бария: 2Ва + О2 → 2ВаО. В подобном типе реакции обеспечивается получение не только оксида, но и пероксида бария: Ва + О2 → ВаО2;
• Реакция разложения карбоната бария при условии обязательного нагревания, где получение оксида бария сопровождается выделением углекислого газа: ВаСО3 → ВаО + СО2↑. Существует обратная реакция оксида бария и оксида углерода (IV) при условиях комнатной температуры;
• Реакция разложения нитрата бария при условиях нагревания, где полученными веществами являются оксид бария, оксид азота и кислород: 2Ba(NO3)2 → 2BaO + 4NO2 + O2;
• Реакция гидроксида бария и оксида серы (IV): Ва(НО)2 + 2SО2 → Ва(НSО3)2, где результатом взаимодействия веществ становится образование (Ва(НSО3)2).
Получение металлического бария возможно и с проведением реакции восстановления. Главное, какой оксид использовать в реакции дополнительно. Например, наиболее яркая реакция — это химическая реакция с участием оксида алюминия:
3ВаО + 2Аl → 3Ва + Аl2О3
Кроме этого, гарантированное получение бария обеспечивается посредством электролиза смеси хлорида бария и кальция в расплавленном состоянии.
Степень растворимости Ва
Растворимость оксида бария определяется по реакции данного вещества с водой. В этом случае, исходя из данных уравнения по взаимодействию:
ВаО + Н2О = Ва(ОН)2,
где оксид бария — это оксид основного типа.
Следовательно такому оксиду будет соответствовать основание — Ва(ОН)2. Сверяя полученные данные с таблицей растворимости веществ нетрудно определить, что данный вид оснований относится к растворимым и подтверждает тот факт, что реакция вполне осуществима.
Природные источники вещества
По содержанию в природных источниках различается несколько возможных:
- • Земная кора, где масса вещества составляет 0, 05 %;
- • Морская вода, где средняя величина содержания бария составляет 0,02 мг/литр.
Области применения оксидов основного типа
Любое их химических соединений данной группы широко применяется в различных отраслях современной промышленности. В соответствии с краткой классификацией веществ, можно определить следующее разграничение использования оксидов (калия, магния, бария, алюминия):
- • Оксид калия. Широко применяется в производстве удобрений минерального типа, используемых аграрном хозяйстве;
- • Оксид натрия. Незаменим в химической промышленности для получения гидроксида натрия;
- • Оксид бария. Применим в качестве катализатора в осуществлении химических реакций;
- • Оксид магния. Область применения – пищевая промышленность (в виде добавки Е530).
Определение химических свойств вещества на практике
• Ярко протекает реакция взаимодействия оксида бария и воды, вследствие чего отмечается образование щелочи с параллельным выделением тепла: ВаО + Н2О → Ва(ОН)2.
• Взаимодействует оксид бария и с кислотными оксидами, в результате чего характерно образование солей: ВаО + СО2 → ВаСО3, ВаО + SО3 → Ва SО4↓, где оксид бария вступает в реакцию с триоксидом серы;
• Реакция взаимодействия ВаО с кислотами, где обеспечивается итоговое образование солей и воды: ВаО + Н2Сl → ВаСl2 + Н2О, ВаО + Н2SО4 → Ва SО4↓ + Н2О. В течение подобной реакции между оксидом бария и серной кислотой (в разбавленном виде) результатом становится образование сульфата бария и воды.
Также стоит обратить внимание на реакцию оксида бария с соляной кислотой: ВаО + 2НСl (при обязательном условии разбавленного состояния) → ВаСl2 + Н2О, где результатом реакции обеспечено образование хлорида бария BaCl2 и воды H2O.
Описание физических свойств ВаО
Существует в твердом состоянии. Непосредственно сам барий отличается характерным серебристо – белым оттенком, достаточно пластичен, по причине чего относится к ковким металлам.
- • Величина молярной массы оксида бария, гр/моль: 153, 3394;
- • По плотности вещество характеризуется следующими показателями, при условии температурного режима в 20 °C: 5, 72;
- • Растворимость в воде, то есть показатель Кs, при условии температуры в 20° С = 1, 5 г/100 г;
Особенности гидроксида и пероксида бария
Гидроксид бария обозначается, как Ba(OH). Применяется в виде кристаллообразных пластин белого цвета, либо в состоянии раствора, более известного как баритовая вода. Популярен в стекольном производстве, например для создания и разработки непроницаемого стекла для рентгеновских установок. Также используется в производстве керамических изделий, в процессах по очистке воды и в производстве гидроксида калия.
Пероксид бария, обозначаемый, как BaO, получается путем нагревания оксида бария в воздушном пространстве с характерным отсутствием диоксида углерода.
Применение
Выход ВаО достаточно низок, соответственно, учитывая его невысокую стоимость, он пользуется повышенным спросом в работах по покрытию катодов, входящих в электронно-вакуумные приборы, на элементах телевизионных устройства и осциллографических трубок. Известны и иные сферы активного применения:
- • Производство антикоррозионных материалов;
- • Товары из категории сегнето- и пьезо- электрики;
- • Изготовление оптических приборов, таких, как призмы, линзы и прочие;
- • Пиротехнические изделия с целью окрашивания пламени заряда в зеленый цвет;
- • Отрасль атомно-водородной и ядерной энергетики;
- • В составе фторионных аккумуляторных батарей, как электролитный компонент;
- • При разработке и производстве медицинского оборудования.
Хранение
Условия соответствующего хранения ВаО подразумевают полное отсутствие любых легко возгораемых веществ. Также исключены в близком хранении и нахождении восстанавливающие агенты, металлы в порошкообразном состоянии. Категорически запрещается параллельное нахождение любых продуктов питания и сельскохозяйственных животных кормов.
Особые обозначения на упаковке
Полностью исключена одновременная транспортировка с пищевыми продуктами, косметической продукцией, животными кормами и любыми водными организмами. Весь транспортируемый материал должен быть помечен следующими символами:
- • Хn, обозначающий раздражающее действие отмеченных веществ;
- • R, с числовым значением 20/22, что говорит об опасности при вдохе и в случае проглатывания;
- • S, с числовым значением 17, что предписывает ранение вещества в максимальной отдаленности от горюче – смазочных материалов;
- • S, с числовым значением 28, указывающем на незамедлительное промывание, в случае попадания ВаО на поверхность кожных покровов.
Варианты фасовки подразумевают распределение вещества по упаковкам в 1, 20 – 25, 100, 500 и 1000 килограммовые упаковки, которыми служат банки из стекла, мешки из полипропилена, пакеты из полиэтилена. На фасовке любого веса обязателен к указанию класс степени опасности: 5.1. Существует понятие вторичной опасности, означаемой 6.1.
Влияние ВаО на организм человека
Симптоматика отравлений барием как правило выражена в следующем: повышенное слюнотечение, жжение во рту, дискомфорт в пищеводе. Период отравления сопровождается явно выраженными болями в области желудка, тошнотой, рвотой, острыми коликами. При тяжелом отравлении вероятен смертельный исход, наступающий в течение 24 часов. Смертельная доза составляет порядка 0,8 граммов.
При использовании любых соединений бария стоит помнить о том, что изучение его недостаточно, а к жизненно важным микроэлементам он не относится. Вещество характеризуется как высокотоксичное, так что при любом виде контакта рекомендовано соблюдать все меры предосторожности и СИЗ.
http://www.syl.ru/article/218515/new_oksid-bariya-poluchenie-i-primenenie
http://promplace.ru/himicheskie-soedineniya-staty/oksid-bariya-2301.htm