Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2edd5dfdbf164b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Уравнение реакции бора с азотной кислотой
Аморфный бор получил восстановлением оксида бора натрием. Рецепт есть в Энциклопедическом словаре Брокгауза и Ефрона:
Для получения аморфного бора (по Вёлеру и Девиллю) в раскаленный чугунный тигель всыпают смесь 100 ч. борного ангидрида с 60 ч. металлического натрия и покрывают все слоем прокаленной поваренной соли (от 40 до 50 ч.); наступает бурная реакция, причем часть борного ангидрида отдает свой кислород натрию; бор выделяется в свободном состоянии, и вместе с тем образуется бура; сплав перемешивают железным прутом, выливают в воду, подкисленную соляной кислотой, и собирают остающийся нерастворенным бор на фильтре; в виде аморфного порошка он легко проходит через поры бумаги, висит в воде и сообщает ей бурую окраску, сушить порошок следует на пористых фарфоровых пластинках при обыкновенной температуре, так как при более сильном подогревании бор легко загорается.
Для реакции в качестве стального тигля удобен 100 мл китайский стаканчик из нержавейки. Крышка — из кружка жести. Вначале борная кислота обезвоживается в том же стаканчике в муфельной печи при 700-800 С. Затем стакан (наружные стенки) охлаждается водой, растрескавшийся стекловидный оксид бора удобно извлечь ударом молотка, подстелив под стакан бумагу. Потом борный ангидрид быстро измельчается ударами молотка или в ступке острожными ударами пестика. Ступка помещается в пакет.
У меня кусочки оксида бора получились довольно крупные, тщательно дробить было лень — вещество очень твердое. Масса оксида бора — примерно 20 г.
Натрий (12 г), порезанный ножом на мелкие кусочки, поместил в тигель, и засыпал его оксидом бора с добавлением 8 г хлорида натрия. Закрыл крышкой, (для надежности придавленной дополнительным грузом железа) и поместил в разогретую до 800°С печь. Тигель нагревался около 15 минут при температуре 800-900°С.
После остывания внутри был плав грязно-коричнево-черного цвета. От удара молотка он отделился от стакана. Полученный плав раздробил на несколько кусков, поместил в стакан с водой, подкисленной соляной кислотой, воду нагрел до кипения. После охлаждения осадок и взвесь отфильтровал на воронке Бюхнера, залил 10 % раствором едкого калия, довел до кипения, потом нейтрализовал щелочь, прилив соляной кислоты. Отфильтровал под вакуумом. Бор образует тончайшую взвесь черного цвета, фильтруется довольно медленно, на фильтре промыл осадок водой и ацетоном (для ускорения сушки). Получилось примерно 1.2 г бора в виде тончайшей пыли.
Выход небольшой (скорее всего из-за крупных кусков натрия и оксида бора), но для нескольких экспериментов с бором этого хватит.
Вот часть полученного бора, цвет серо-черный:
 Бор Elemental boron Реакция с концентрированной серной и азотной кислотой — наиболее доступными кислотами-окислителями — является важной для характеристики свойств неметаллов со средним значением электроотрицательности. Среди таких неметаллов следует назвать: серу, фосфор, кремний, йод, селен, теллур, мышьяк. Например, фосфор реагирует с азотной кислотой с образованием фосфорной кислоты. Сера реагирует с азотной кислотой с образованием серной кислоты, а с серной кислотой — с образованием диоксида серы и воды. Кремний не реагирует с концентрированной серной и азотной кислотами. Чтобы растворить кремний, используют смесь азотной и плавиковой (фтористоводородной) кислоты. Азотная кислота играет роль окислителя, фтористоводородная — комплексообразователя. Бор — типичный неметалл с невысокой электроотрицательностью. Как должна протекать его реакция с азотной кислотой? В практикуме Рипан Р. Четяну И. Руководство к практическим работам по неорганической химии (1965), С. 555 [ссылка] сказано: С концентрированной азотной или серной кислотой бор реагирует следующим образом: Опыт проводят в пробирке при нагревании. — И все: больше никаких подробностей. Значит — проверим опытным путем. Налил в стаканчик концентрированную азотную кислоту (60-70%) и всыпал туда небольшой шпателек аморфного бора. Произошла вспышка, которая сопровождалась шипением и образованием желтых искр. Появились бурые пары. Но пламя исчезло и после этого бурной реакции не последовало. Добавил еще один шпатель бора: снова вспышка, а потом — отсутствие всякой активности. Греть стакан до растворения бора не стал (ввиду тривиальности процедуры). Повторил эксперимент: снова при добавлении бора в азотную кислоту дважды произошла вспышка. Про такой эффект при взаимодействии аморфного бора с азотной кислотой в практикуме не было ни слова. Возможно, бор содержал примесь борида натрия, который и дал вспышку с кислотой? Но это практически исключено, т.к. полученный аморфный бор я кипятил с раствором соляной кислоты: бориды натрия в этих условиях разложились бы. Приведу еще раз фрагмент цитаты из Энциклопедического словаря Брокгауза и Ефрона: . сушить порошок [аморфного бора] следует на пористых фарфоровых пластинках при обыкновенной температуре, так как при более сильном подогревании бор легко загорается. Другими словами, аморфный бор, полученный реакцией борного ангидрида с натрием (с последующей промывкой соляной кислотой), содержит активные частицы, способные воспламеняться на воздухе, если бор сушить при нагревании. Например, это могут быть очень мелкодисперсные частицы (вспомните, что железо и свинец — металлы средней активности — в мелкодисперсном виде вспыхивают на воздухе, т.е. обладают пирофорностью). Не удивительно, что реакция бора с азотной кислотой происходит со вспышкой. Такой «активной формы» бора в полученном образце, по-видимому, содержится мало, поэтому после вспышки дальнейшей бурной реакции не наблюдается. |
 Бор и азотная кислота Elemental boron and nitric acid |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
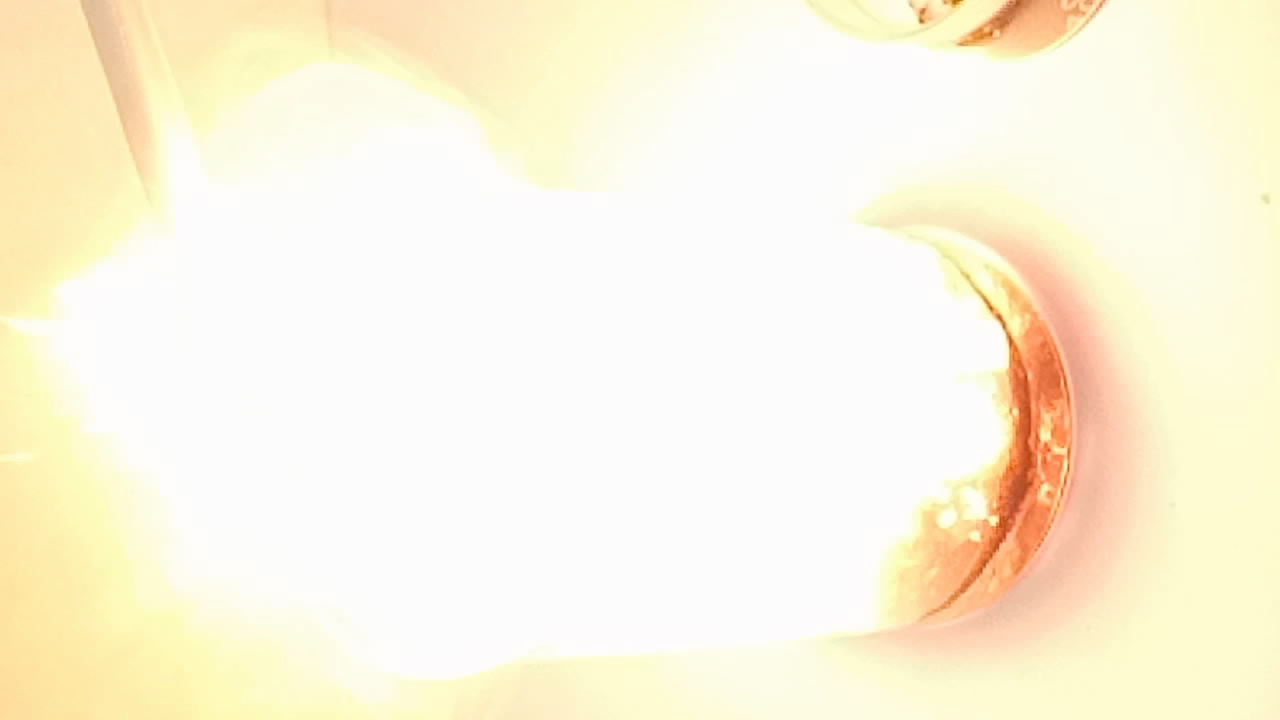 |
 |
 |
 |
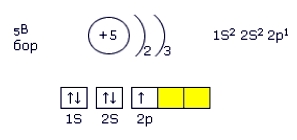
 Согласно практикуму Рипан Р. Четяну И. Руководство к практическим работам по неорганической химии (1965), С. 555 [ссылка] при нагревании в кислороде или на воздухе бор воспламеняется и сгорает красным пламенем с образованием борного ангидрида и выделением большого количества тепла. Поместил бор в ложечку для сжигания, нагрел его в пламени зажигалки и внес в колбу с кислородом. Сначала бор горел красивым ослепительным бело-зеленым пламенем, затем — красным и белым. Образовался белый дым. Бор (B)Первыми бор получили французы Гей-Люссак и Тенар в 1808 году. В природе элементарный бор не встречается. Почит во всех минералах бор связан с кислородом, он встречается в небольших концентрациях во многих природных соединениях, в виде боратов и боросиликатов, в изверженных и осадочных породах, в водах морей, соляных озер, горячих гейзеров, грязевых вулканов. Электронная конфигурация бора — 1s 2 2s 2 2p 1 (см. Электронная структура атомов). На внешнем электронном слое бора находятся три электрона, которые он может либо отдавать, либо принимать еще 3, проявляя кислотность +3 или -3. Бор, как простое веществоБор является инертным (при н. у.) неметаллом, образует ряд аллотропных модификаций, отличающихся строением кристаллической решетки — это самое твердное (после алмаза) природное вещество, обладающее малой электропроводностью. Свойства бора во многом зависят от его модификации и чистоты. Химические свойства бора:
Соединения бораБорная кислота (H3BO3) — это слабая одноосновная кислота, представляет собой растворимое в воде бесцветное кристаллическое вещество. Борную кислоту получают из минерала сассолина. Кислотные свойства борной кислоты обусловлены образованием протона при ее взаимодействии с водой: При нагревании борная кислота, теряя воду, превращается в метаборную кислоту: Борная кислота применяется как дезинфицирующее и антисептическое средство, для изготовления эмалей, специальных стекол, цементов, косметики, средств гигиены. Борный ангидрид (B2O3) — диэлектрическое бесцветное кристаллическое вещество, легко переходящее в стеклообразное состояние. Энергично вступает в реакцию с водой, образуя борную кислоту: B2O3 + 3H2O = 2H3BO3. Получение борного ангидрида: Борный ангидрид нашел применение в производстве специальных стекол и для получения бора. Получение бора:
Применение бора:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка: Код кнопки: источники: http://chemistry-chemists.com/N1_2017/ChemistryAndChemists_1_2017-P1-1.html http://prosto-o-slognom.ru/chimia/508_bor_B.html |