Составьте уравнения реакций: а) бензола с бромом; б) горения этилена. Укажите тип реакции а и назовите полученное вещество
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Химия, Биология, подготовка к ГИА и ЕГЭ
Химические свойства бензола
В лекции о бензоле мы рассмотрели строение молекулы и определили, что бензольное кольцо — уникальная система. И у этой системы свои характеристики, отличающиеся от свойств других углеводородов.

Что это означает? Это означает, что разрушить эту систему (раскрыть кольцо) возможно при специальных условиях — давление, температура, катализатор…
Для бензола и его гомологов характерны реакции замещения.
Остальные реакции идут с трудом.
Лучше, конечно, разделить химические свойства бензола и химические свойства алкилбензолов. По сути, алкилбензолы — вещества с двумя функциональными группами — бензольным кольцом и насыщенным алкильным радикалом, для которого более характерны свойства алканов.
Химические свойства бензола
Реакции замещения в бензольном кольце проходят в присутствии катализаторов: солей Al(3+) или Fe(3+):
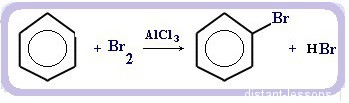
Реакция галогенирования бензола (взаимодействие с бромом — качественная реакция на бензол):
C6H6 + Br2 = C6H5Br + HBr
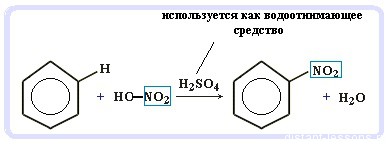
Нитрование бензола (обратите внимание, в органической химии неорганические кислоты реагируют немного по-другому — с отщеплением группы -OH):
C6H6 + HO-NO2 → C6H5NO2 + H2O
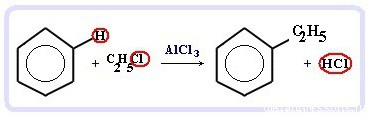
Химические свойства бензола — Алкилирование — получение гомологов бензола, алкилбензолов (катализаторы реакции — галогениды алюминия: AlCl3, AlBr3 и т.д.):
С6H6 + С2H5Cl → C6H5C2H5 + HCl
Химические свойства гомологов бензола — алкилбензолов
Реакции замещения алкилбензолов:
во-первых, гомологи бензола более ракционноспособны — легче вступают в реакции,
во-вторых, эти реакции идут немного по-другому:
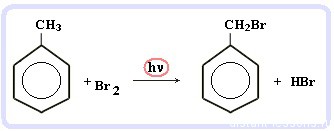
Галогенирование алкилбензолов:
С6H5-CH3 + Br2 (на свету) = С6H5-CH2Br + HBr
Т.е. бром идет в боковую цепь, а не в кольцо.
Чтобы бром пошел в кольцо, надо использовать катализатор — соли Al(3+)
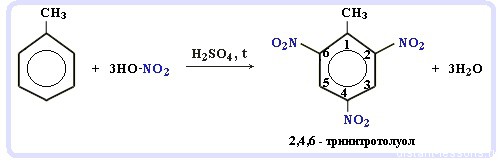
Нитрование алкилбензолов:
С6H5-CH3 + 3HNO3 → C6H2CH3(NO2)3
тринитротолуол, он же тротил
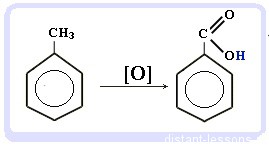
Окисление: реакция, характерная для алкилбензолов и не характерная для самого бензола
С6H5CH3 + [O] → C6H5COOH — бензойная кислота
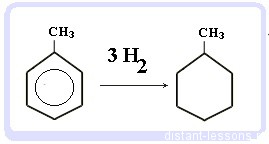
Гидрирование бензола и алкилбензолов:
Тут уже различий нет. при гидрировании всех аренов (температура, давление, катализатор — бензольное кольцо разорвать не так уж и просто) получаются циклоалканы, а точнее, циклогексан и циклогексан с радикалами:
С6H6 + 3 H2 → C6H12 циклогексан
С6H5CH3 + 3 H2 → C6H11-CH3 — метилциклогексан
Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды H2O:
Уравнение реакции брома с бензолом
Установив, что бензол не дает обычных реакций непредельных углеводородов, некоторые учителя переходят к опытам бромирования и нитрования бензола, чтобы показать аналогию со свойствами предельных углеводородов (замещение атомов водорода), и далее — к вопросу о строении бензола.
При обосновании структурной формулы бензола мы рекомендуем ограничиться лишь указанными выше «отрицательными» опытами, опыты же бромирования и нитрования ставить при изучении химических свойств бензола.
Это вызывается тем, что дважды демонстрировать сложные опыты учитель вряд ли будет, а без них изучение химических свойств сильно обедняется. Не случайно, что иногда специальное рассмотрение химических свойств бензола опускается вовсе, и в результате учащиеся, хорошо отвечая на вопрос о выводе структурной формулы бензола, затрудняются охарактеризовать химические свойства этого вещества.
Вместе с тем рассуждения о том, что бензол вступает в реакции, аналогичные предельным углеводородам, ничего по существу не дают для вывода его структурной формулы. Замечание же об отсутствии изомеров у монозамещенного бензола можно привести впоследствии как подтверждение структурной формулы.
Исходя из всего этого, после установления отрицательного результата с реактивами на непредельные соединения, целесообразно перейти к разбору реакции тримеризации ацетилена и на основе этого дать вывод структурной формулы.
При изучении химических свойств бензола учитель указывает, что, несмотря па наличие двойных связей, для бензола более характерны реакции замещения водорода, чем присоединения других атомов, и в качестве первого примера демонстрирует опыт бромирования бензола. Реакция бензола с бромом, выражаемая уравнением:
идет с чистым бромом и в присутствии катализаторов — бромида алюминия или железа.
Так как бром легко взаимодействует с алюминием и железом, то для реакции можно брать металлические опилки (например, железные), и тогда катализатор образуется непосредственно о реагирующей смеси. Мелким порошком металла для опыта воспользоваться нельзя, так как реакция может пойти слишком бурно.
При получении больших количеств бромбензола бром необходимо постепенно, по мере прохождения реакции, прибавлять к бензолу из капельной воронки, чтобы избежать слишком бурного течения процесса. Демонстрационный же опыт может быть поставлен с небольшими количествами вещества и поэтому в колбу можно помещать полностью заготовленные для опыта вещества.
Согласно уравнению реакции на 1 моль бензола требуется 1 моль брома, т.е. весовые соотношения веществ должны быть 78 : 160. Практически лучше брать бензола немного больше, чтобы бром полностью прореагировал. Во избежание улетучивания паров брома и бензола опыт следует вести с обратным холодильником, можно воздушным. В колбу емкостью 100 мл
наливают 2 мл бензола и 1 мл брома. Отмечают, что реакция между веществами не происходит. Затем бросают в колбу очень немного (на кончике ножа) железных опилок и быстро закрывают колбу пробкой с вертикальной трубкой-холодильником, второй конец которой соединен с нисходящей трубкой, оканчивающейся воронкой над водой в стакане (вода служит для поглощения образующегося бромистого водорода). Обычно вскоре начинается реакция бензола с бромом, и, если она пойдет слишком бурно, колбу охлаждают, погружая ее в чашку с холодной водой. Если реакция долго не начинается, колбу слегка подогревают. Под конец опыта колбу также следует подогреть (горячей водой), чтобы реакция прошла до конца.
О ходе реакции учащиеся судят по изменениям в колбе и по образованию кислоты в стакане. Для этой цели в стакан с водой предварительно можно добавить раствор лакмуса или метилоранжа. Изменения в окраске раствора хорошо наблюдаются на фоне белого экрана. Если удалить стакан с водой и к концу трубки поднести палочку, смоченную аммиаком, то можно показать образование дыма бромида аммония. Пары бромистого водорода можно также пропускать в слабый раствор нитрата серебра; при этом наблюдается образование осадка бромида серебра.
После того как обнаружено образование паров бромистого водорода, можно поручить наблюдение за реакцией лаборанту или одному из учащихся и перейти к проверке понимания учащимися опыта и соответствующего химического уравнения. После окончания опыта жидкость из колбы выливают в стакан с водой и демонстрируют образовавшуюся тяжелую жидкость — бромбензол. Извлечение чистого бромбензола (удаление остатков бензола и образовавшихся частично о- и n-дибромбензолов) можно передать в химический кружок.
Для очистки реакционную смесь промывают в делительной воронке слабым раствором щелочи, затем водой, сушат хлоридом кальция и перегоняют из небольшой колбочки с воздушным холодильником. Отдельно собирают фракцию, кипящую в пределах 150-158°С (бромбензол кипит при температуре 155°С).
http://distant-lessons.ru/ximiya/benzol-i-ego-gomologi/ximicheskie-svojstva-benzola-i-alkilbenzolov
http://ximicat.com/info.php?id=130