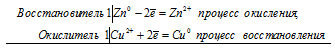Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 
Катодный процесс: Cu 2+ + 2 
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 

В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Уравнение реакции cuso4 и zn
7 ОСНОВЫ ЭЛЕКТРОХИМИИ
7.1 ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn , Fe , Cu , Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается.
Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции :
Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 6.1 показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
Рисунок 6.1 – Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби)
Сосуд А и соединяющая оба сосуда трубка В заполнены раствором ZnSO4, сосуд Б – раствором CuSO4. В первый из них опущена цинковая пластинка, во второй – медная. Если соединить обе пластинки проводом, то по нему в указанном стрелкой направлении начнут перемещаться электроны (потечет электрический ток). Трубка В обеспечивает замкнутость цепи, по ней перемещаются ионы SO4 2– . Электрод, на котором происходит процесс восстановления (на рисунке 6.1 – медный) называется катодом, а электрод, на котором осуществляется окисление (в рассмотренном примере – цинковый) – анодом В электротехнике принята противоположная система обозначений электродов: катодом называют отрицательный полюс источника тока, т.е. электрод, передающий электроны во внешнюю цепь (в данном случае цинковый). В учебном пособии электроды названы так, как это принято в электрохимии. .
В данном случае электродные процессы являются гетерогенными, т.к. окисленная и восстановленная формы находятся в разных фазах *. В более общем виде гетерогенный электродный процесс можно записать в виде:
Me (ВФ, тв . фаза) – ne – 
На границе раздела фаз возникает двойной электрический слой, состоящий из катионов Me n + (в растворе) и электронов (в металле), что приводит к появлению потенциала E( Me n + / Me ). Его абсолютная величина определению не поддается, однако легко измеряется разность потенциалов катода и анода, которая называется электродвижущей силой (ЭДС) гальванического элемента Δ E = E к – Eа . Если в таких устройствах условно считать потенциал какого-то электрода равным нулю, то измерением ЭДС можно получить относительные значения других электродных потенциалов, что важно для сравнительной количественной характеристики электродов.
Условно за нуль принят потенциал стандартного водородного электрода, который состоит из платиновой пластинки, покрытой платиновой чернью и частично погруженной в раствор кислоты с активной концентрацией ионов водорода, равной 1 моль/л. Электрод омывается газообразным водородом под давлением 1,013 · 10 5 Па (1 атмосфера), что приводит к образованию системы:
2 H + + 2e
Для измерения электродных потенциалов металлов, например меди, составляют гальванический элемент, в котором вторым электродом служит стандартный водородный электрод. В основе работы составленного гальванического элемента лежит реакция
Cu 2+ + H2 → 2H + + Cu
На схеме гальванического элемента границы раздела фаз показывают одной вертикальной чертой, а электроды отделяют друг от друга двумя вертикальными чертами. Анод на схеме указывают слева, а катод – справа:
А (–) Pt (H2) | 2H + | | Cu 2+ | Cu (+) К
Катодом в этом случае является медный электрод. ЭДС гальванического элемента, измеренная при концентрации (активности) ионов меди 1 моль/л, равна 0,34 В и может быть выражена как Δ E = E(Cu 2+ / Cu )– E(2H + /H2). Так как E(2H + /H2) принят за нуль, то E(Cu 2+ / Cu )= Δ E =0,34 В при стандартных условиях. Если медь заменить цинком, то катодом будет водородный электрод. Тогда E(Zn 2+ / Zn )= – Δ E = –0,76В.
Электродные потенциалы металлов, измеренные по отношению к водородному электроду при стандартных условиях, т.е. активной концентрации ионов металла в растворе, равной 1 моль/л, и температуре 25 ° С (298 К), называют стандартными и обозначают Е ° . Так, Е ° (Cu 2+ / Cu )=0,34В, Е ° (Zn 2+ / Zn )= –0,76В. Ряд металлов, расположенных в порядке возрастания их стандартных электродных потенциалов, называется рядом напряжений. В основных чертах он имеет следующий вид:
K, Ca , Na , Mg , Al , Zn , Fe , Ni , Sn , Pb , H, Cu , Hg , Ag , Pt , Au
Ниже приведены основные следствия из ряда напряжений:
а) Каждый металл вытесняет из солей все другие, расположенные в ряду напряжений правее него.
б) Все металлы, расположенные левее водорода, вытесняют его из кислот, расположенные правее – не вытесняют.
в) Чем дальше друг от друга стоят два металла, тем большую ЭДС имеет построенный из них гальванический элемент.
Величина электродного потенциала зависит от концентрации В данном случае имеется в виду молярная концентрация (моль/л). ионов металла в растворе его соли [ Me n + ], их заряда ( n ) и температуры ( Т), что выражается уравнением Нернста:

здесь F – число Фарадея ( F=96485 
При Т=298 К можно применять упрощенную форму уравнения Нернста:
Величина ЭДС и изменение энергии Гиббса * для химического процесса, лежащего в основе работы гальванического элемента, связаны соотношением Δ G = – nF Δ E , где n – количество электронов, передаваемых от восстановителя к окислителю. Необходимо иметь в виду, что реакцию необязательно проводить в гальваническом элементе. Она может быть проведена, например, в пробирке. Единственным отличием будет то, что полуреакции окисления и восстановления не разделены по электродам, а происходят в одной области пространства. Следовательно, Δ G может вычисляться точно так же, т.е. через ЭДС гипотетического гальванического элемента, найденную из электродных потенциалов полуреакций. В качестве примера рассмотрим реакцию:
2 Fe 2+ + Cl2 → 2 Fe 3+ + 2 Cl –
Здесь n=2, т.к. молекула хлора принимает два электрона (по одному от каждого иона Fe 2+ ). Соотношение Δ G = – nF Δ E находит применение для определения Δ G окислительно-восстановительных реакций * в растворах по измеренной величине ЭДС гальванических элементов, в которых они могут протекать, а также для выяснения возможности работы гальванического элемента на той или иной химической реакции, если для нее изменение энергии Гиббса Δ G известно.
Zn + CuSO4 — > ; ZnSO4 + Cu?
Химия | 5 — 9 классы
Zn + CuSO4 — > ; ZnSO4 + Cu.
Расставить коэффициенты и указать типа реакции, пожалуйста : ).
Коэффициенты не нужны, реакция замещения.
Дописать уравнения, расставить коэффициенты, определить тип реакции?
Дописать уравнения, расставить коэффициенты, определить тип реакции.
Расставить коэффициенты , указать тип реакции : AgNO3 + HCL — > ?
Расставить коэффициенты , указать тип реакции : AgNO3 + HCL — > ;
Помоги пожалуйста расставить коэффициенты и указать продукты реакции : NiCl2 + CaOCl2 + NaOH?
Помоги пожалуйста расставить коэффициенты и указать продукты реакции : NiCl2 + CaOCl2 + NaOH.
Помогите пожалуйста номер 2 нужно расставить коэффициенты и назвать тип реакции?
Помогите пожалуйста номер 2 нужно расставить коэффициенты и назвать тип реакции.
Расставить коэффициенты и определить тип реакций?
Расставить коэффициенты и определить тип реакций.
Дописать уравнения химических реакций, расставить коэффициенты, назвать продукты реакций?
Дописать уравнения химических реакций, расставить коэффициенты, назвать продукты реакций.
Указать тип реакций : P2O5 + K2O = BaCI2 + H2SO4 = NaOH + CuCI2 = Na2CO3 + HCI = KOH + HBr =.
Расставите коэффициенты и укажите тип реакции?
Расставите коэффициенты и укажите тип реакции.
Расставить коэффициенты и тип реакций10?
Расставить коэффициенты и тип реакций
Помогите расставить коэффициенты и в скобочках указать реакцию?
Помогите расставить коэффициенты и в скобочках указать реакцию.
CuO + C — — > ; CU + CO2 расставить коэффициенты и указать тип реакции?
CuO + C — — > ; CU + CO2 расставить коэффициенты и указать тип реакции.
На этой странице находится вопрос Zn + CuSO4 — > ; ZnSO4 + Cu?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 5 — 9 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку.
http://www.chem-astu.ru/chair/study/genchem/r7_1.htm
http://himia.my-dict.ru/q/116696_zn-cuso4-gt-znso4-cu/