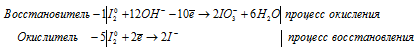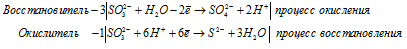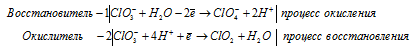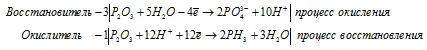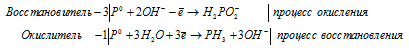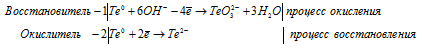Реакции диспропорционирования.
Это реакции, в которых атомы одного и того же элемента, входящие в состав одного и того же исходного вещества, повышают и понижают степень окисления. Они очень часто встречаются в заданиях С2, поэтому их нужно запомнить тем, кто хочет сдать ЕГЭ на высокий балл.
1.Все галогены, кроме F2, диспропорционируют в растворах всех щелочей. При комнатной температуре или на холоде получаются две соли – МГ, МГО и Н2О; при нагревании – две соли: МГ, МГО3 и Н2О.
Cl2 +2KOH = KCl + KClO + H2O – на холоде,
3Cl2 + 6KOH = 5KCl +KClO3 + 3H2O – при нагревании,
Аналогично происходят реакции с растворами карбонатов:
2. Диспропорционирование серы в растворах щелочей:
3. Диспропорционирование фосфора в растворах щелочей.
4. Диспропорционирование оксида азота (IV) в воде и щелочах:
5. Другие реакции диспропорционирования:
Особо обратим внимание на те случаи, когда образуется соль, которая в таблице растворимости показана прочерком. Здесь возможны 2 варианта:
1) соль не существует, потому что необратимо гидролизуется.
2) Соль не существует за счёт внутримолекулярного окисления-восстановления, таким солям относятся Fe2S3, FeI3, CuI2. Как только они получаются, тут же разлагаются: Fe2S3 = 2FeS+ S; 2FeI3 = 2FeI2 +I2; 2CuI2 = 2CuI + I2
Например; FeCl3 + 3KI = FeI3 + 3KCl (1),
но вместо FeI3 нужно записать продукты его разложения: FeI2 +I2.
Тогда получится: 2FeCl3 + 6KI = 2FeI2 +I2 + 6KCl
Это не единственный вариант записи данной реакции, если йодид был в недостатке, то может получиться йод и хлорид железа (II):
Окислители – соединения железа (III), восстановители – сульфиды, йодиды. При этом катион Fe 3+ восстанавливается до катиона Fe 2+ , сульфид – анион S 2- окисляется до серы S 0 , а йодид – анион I — окисляется до йода I2.
В зависимости от количественного соотношения реагирующих веществ могут получиться различные соединения железа (II):
2FeCl3 + Na2S = S¯ + 2FeCl2 + 2NaCl или 2FeCl3 + 3Na2S = S¯ + FeS + 6NaCl
2. Окислители – соединения меди (II), восстановители — йодиды. При этом катион Cu 2+ восстанавливается до катиона Cu + , а йодид – анион окисляется до йода I2 :
2CuCl2 + 4KI = 2CuI¯ + I2¯ + 4KCl
2CuCl2 + 4HI = 2CuI¯ + I2¯ + 4HCl
3. Окислитель – азотная кислота, восстановитель – сульфиды, йодиды, сульфиты. При этом азотная кислота, в зависимости от концентрации, восстанавливается до NO2 (концентрированная), до NO (разбавленная); сульфид – анион S 2- окисляется до серы S 0 или сульфат – аниона SO4 2- , йодид – анион – до йода I2, a сульфит – анион SO3 2- — до сульфат – аниона SO4 2- :
4. Окислитель – азотная кислота или серная концентрированная кислота, восстановитель – соединения железа (II). При этом азотная кислота восстанавливается до NO2 или NO, серная – до SO2, а катион Fe 2+ окисляется до катиона Fe 3+ :
5. Окислитель – серная кислота концентрированная, восстановитель – сульфиды, йодиды и бромиды. При этом серная кислота восстанавливается до SO2, S или
H2S; сульфид – анион S 2- окисляется до серы S, SO2 или H2SO4; йодид – анион до йода I2, бромид – анион до брома Br2 :
наиболее вероятный вариант продуктов,
6. Железная окалина – Fe3O4, это смесь двух оксидов — FeO и Fe2O3. Поэтому при взаимодействии с сильными окислителями она окисляется до соединения железа (III) за счёт катионов Fe 2+ — восстановителей, а при взаимодействии с сильными восстановителями восстанавливается до соединения железа (II) за счёт катионов Fe 3+ — окислителей:
При взаимодействии с большинством кислот происходит реакция обмена, получаются две соли:
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1.Дописать продукты окислительно-восстановительных реакций и уравнять реакции:
Составление уравнений реакций самоокисления-самовосстановления (диспропорционирования)
Задача 634.
Закончить уравнения реакций самоокисления-самовосстановления (диспропорционирования):
а) I2 + Ba(OH)2 → Ba(IO3)2 +
б) K2SO3 → K2S +
в) HClO3 → ClO2 +
г) P2O3 + H2O → PH3 +
д) P + KOH + H2O → KH2PO2 + PH3
е) Te + KOH → K2TeO3 +
Решение:
Реакции диспропорционирования сопровождаются одновременным увеличением и уменьшением степени окисления одного и того же элемента, первоначально находившихся в одном, определённом состоянии.
а) I 2 + Ba(OH) 2 → Ba(IO 3) 2 +
После приведения членов обеих частей уравнения, получим:
б) K 2SO 3 → K 2S +
После приведения членов обеих частей уравнения, получим:
в) HClO 3 → ClO 2 +
После приведения членов обеих частей уравнения, получим:
г) P2O 3 + H 2 O → PH 3 +
После приведения членов обеих частей уравнения, получим:
д) P + KOH + H 2 O → KH 2 PO 2 + PH 3
После приведения членов обеих частей уравнения, получим:
е) Te + KOH → K 2 TeO 3 +
3Te 0 + 6OH — → TeO3 2- + 2Te 2- + 3H2O.
После приведения членов обеих частей уравнения, получим:
Используя метод электронного баланса, составьте уравнение реакции S + KOH → K2S + K2SO3 + H2O Определите окислитель и восстановитель
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,261
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://buzani.ru/zadachi/khimiya-glinka/1216-reaktsii-samookisleniya-samovosstanovleniya-zadacha-634
http://www.soloby.ru/992440/%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D1%83%D1%8F-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D0%B5-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C