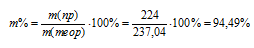Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de31a654bc51ea1 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Составьте электронные уравнения процессов, происходящих на электродах
Решение задач на электролиз растворов солей
Задание 268.
Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока. Ответ: 5,74 А.
Решение:
Стандартный электродный потенциал системы Zn 2+ + 2 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- — 2 
Силу тока вычисляем из уравнения Фарадея относительно выделившегося объёма газа, имея в виду, что 5 ч = 18000 с и VЭ(О2) = 5,6 лг/моль, получим:
I = V . F/ VЭ . t = 6 . 96500/5,6 . 18000 = 5,74 A.
Здесь V – объём выделившегося газа, л; VЭ – эквивалентный объём газа, л/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: I = 5,74 А.
Задание 269.
Электролиз раствора СuSO4 проводили с медным анодом в течение 4 ч при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анодов. Ответ: 94,48%.
Решение:
Массу теоретического выхода меди вычислим из уравнения Фарадея, имея в виду, что 4 ч = 14400 с и МЭ(Cu) = 31,77 г/моль, получим:
m(Cu) = МЭ(В) . I . t/F = 31,77 . 50 . 14400/96500 = 237,04 г.
Здесь m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Выход по току (отношение массы выделившегося вещества к теоретически возможной) равен:
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- — 2 
При электролизе соли медного купороса на медном аноде на катоде будет электрохимическое восстановление меди Cu 2+ . На аноде будет происходить электрохимическое окисление меди, приводящее к выделению в анодное пространство ионов Cu 2+ , поскольку отвечающий этой системе стандартный электродный потенциал (+0,34 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
2Н2О — 4 
т. е. в данном случае при электролизе будет происходить растворение медного анода и отложение меди на катоде. Электрохимические процессы при данном типе электролиза:
Катод: Cu 2+ + 2 
Анод: Cu 0 — 2 
Ответ: m% = 94,49%.
Задание 270.
Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вsчислите массу вещества, выделившегося на катоде и аноде? Ответ: 0,56 г; 71,0 г.
Решение:
Стандартный электродный потенциал системы Na + + 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление ионов I-, приводящее к выделению йода:
2I — — 2 
поскольку отвечающий этой системе стандартный электродный потенциал (+0,54 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
2Н2О — 4 
Массу веществ, выделившихся на электродах находим из уравнения Фарадея, имея в виду, что 2,5 ч = 9000 с и МЭ(Н2) = 1 г/моль, МЭ(I2) = 126,9 г/моль получим:
m(B) = МЭ(B) . I . t/F
m(H2) = МЭ(H2) . I . t/F = 1 . 6 . 9000/96500 = 0,56 г;
m(I2) = МЭ(I2) . I . t/F = 126,9 . 6 . 9000/96500 = 71,00 г.
m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Ответ: m(I2) = 0,56 г; 71,0 г.
Уравнение реакции электролиза раствора сульфата цинка
ЛЕКЦИЯ 34. ЭЛЕКТРОЛИЗ СУЛЬФАТА ЦИНКА
Нейтральный электролит, очищенный от примесей, непрерывно поступает в электролизные ванны, из которых отводится такой же объем отработанного электролита состава: около 40 г/л Zn и до 160 г/л H 2 S 0 4 . В результате этого процесс электролитического осаждения цинка фактически происходит из электролита, содержащего 50—60 г/л Zn и 100—120 г/л H 2 S 0 4 . Вследствие электролитической диссоциации в таком растворе образуются следующие ионы:
ZnS 0 4 — > Zn 2+ + SO * H 2 S 0 4 ->2 H + + SO 2- 4
Катодный процесс восстановления цинка из его сульфатного раствора выражается следующей реакцией:
Конкурирующей электродной реакцией на катоде является разряд ионов водорода:
Наиболее вероятным анодным процессом в условиях электролитического осаждения цинка является процесс электрохимического разложения воды по реакции
Таким образом, суммарный процесс в электролизной ванне характеризуется убылью в раствор ионов цинка в результате осаждения его на катоде, выделением на аноде газообразного кислорода и, как следствие этого, образованием серной кислоты: 2 H + + S 0 4 = H 2 S 0 4
Теоретически при электролизе на катоде в первую очередь должны разряжаться ионы водорода. Однако на цинке (цинковом катоде) при повышенной плотности тока, высокой чистоте электролита, низкой его температуре и добавке в электролит поверхностно-активных веществ создается высокое перенапряжение водорода (не менее 0,7 В). В результате этого потенциал, при котором разряд ионов водорода Н + приобретает значительное развитие, становится более электроотрицательным, близким или даже меньшим,
чем надо для разряда ионов Zn 2+ .
При очистке нейтральных растворов не удается полностью удалить все примеси и они могут существенно влиять на результаты электролиза.
Рассмотрим поведение примесей при электролитическом осаждении цинка из сернокислых растворов. По своему электрохимическому поведению в процессе электролиза примеси в цинковых растворах можно разделить на четыре группы:
1) катионы металлов, более электроположительные, чем цинк;
2) катионы металлов, более электроотрицательные, чем
4) органические примеси.
Наиболее серьезные затруднения при электролитическом выделении цинка вызывают металлы первой группы. Они способны восстанавливаться на катоде и загрязнять катодный цинк. Единственным путем предотвращения попадания этих примесей в катодный осадок является глубокая очистка цинковых растворов.
Накопление в растворе более электроотрицательных, чем цинк, катионов ( Na + , Mg 2+ и Мп 2 +) выше суммарной концентрации около 30 г/л снижает растворимость в электролите сернокислого цинка и неблагоприятно сказывается на подготовке растворов к электролизу. Вследствие повышения вязкости растворов при значительном количестве этих примесей замедляется скорость осветления растворов при сгущении пульп.
При наличии в электролите анионов СЬ возможно их окисление на аноде с образованием газообразного хлора, который загрязняет атмосферу цеха и вызывает коррозию анода. В присутствии катионов Мп 2+ газообразный хлор не выделяется в результате его взаимодействия по реакции
М n 2+ + С l 2 + 2Н 2 0 — М nO 2 + HCI + 2Н + . (120)
Таким образом, присутствие в электролите около 3 г/л Мп считается полезным.
Органические примеси, переходящие в электролит из деревянных деталей аппаратуры, фильтровальной ткани, реагентов и других источников, приводят к получению хрупких катодных осадков цинка.
Электролитическое осаждение цинка из сульфатных растворов осуществляют в ваннах ящичного типа, по конструкции во многом схожих с ваннами, используемыми при электролитическом рафинировании и осаждении меди.
На современных заводах чаще всего применяют железобетонные ванны, внутренние стенки которых футеруют листовым свинцом, полихлорвинилом или винипластом. Длина ванн 2,5—4 м, ширина 0,85—0,9 м, глубина 1,3—
1,4 м. В них завешивают от 28 до 32 катодов и 29—33 анода.
Аноды отливают из свинца с добавкой 1 % серебра, повышающего их коррозионную стойкость. Поверхность анодов может быть рифленой или гладкой; Прокатанные аноды толщиной 5 мм в два-три раза жестче, чем литые толщиной 8 мм, а срок службы их в два раза больше (до 4 лет). Анодную штангу из освинцованной медной шины приваривают к аноду водородной сваркой.
Катоды выполняют из листового алюминия толщиной 3—4 мм. Длина и ширина катодов на 20—30 мм больше, чем у анодов, что уменьшает дендритообразование на краях катодов. На кромки катодных листов надевают деревянные или резиновые рейки. Это предотвращает срастание катодных осадков, образующихся на противоположных плоскостях катода. Катодную штангу из алюминия с медным контактом на одном конце приваривают к катодному листу.
Ванны располагают в цехе рядами по 20—30 шт. Между ваннами имеются проходы для обслуживания. Применяют две схемы компоновки и ошиновки ванн (рис. 131).
Схема // более удобна для обслуживания каждой ванны со стороны проходов, что позволяет механизировать выемку и транспортировку электродов; На новых заводах предпочтение отдают схеме спаренных электролизных ванн.
В процессе электролиза цинка выделяется значительное количество тепла, которого выделится тем больше, чем выше будет плотность тока. Для поддержания оптимальной температуры электролита (33—38°С) необходимо электролит охлаждать. Охлаждение электролита на практике может быть централизованным (вне ванн) или индивидуальным — непосредственно в ваннах с помощью водоохлаждаемых трубчатых змеевиков. Змеевики-холодильники устанавливают на одном из торцов каждой ванны.
Питание нейтральным раствором каждой из ванн, скомпонованных по схеме //, осуществляется со стороны торца, где установлен змеевик. Одновременно с противоположного торца из каждой ванны с той же скоростью отводят отработанный электролит.
Выделяющийся на аноде кислород хорошо перемешивает
сернокислый электролит, но несколько его разбрызгивает. Чтобы оздоровить атмосферу в цехе, на поверхности электролита в ваннах создают слой пены, поглощающей брызги электролита. Для этого в раствор вводят экстракт мыльного
корня или лакрицы.
Обслуживание ванн при электролизе цинка сводится к
указанным ниже операциям:
1) контроль за составом и температурой электролита;
2) периодическая сдирка катодного цинка;
3) контроль за состоянием ванн/контактов и змеевиков
и их обслуживание;
4) регулирование скорости циркуляции электролита;
5) периодическая очистка ванн и анодов от шлама.
Сдирку катодного цинка производят обычно один раз в сутки, для чего из ванн одновременно вынимают по 5—10 катодов. Если сдирку цинкового осадка производят на месте, то ванны в этот момент работают на повышенной плотности тока. При централизованной сдирке (в торце цеха) на место вынутых катодов сразу устанавливают новые. В настоящее время на цинковых электролитных заводах ручную сдирку цинка заменяют механизированной на катодосдирочных машинах.
Электролитическое осаждение цинка из сульфатных растворов проводят при катодных плотностях тока 400—700 А/м 2 . Отечественные заводы обычно работают на плотности тока 550—650 А/м 2 . Для получения гладких катодных осадков в электролит в качестве поверхностно-активной добавки вводят столярный клей. Выход по току в цинковом производстве обычно равен 88—92%; около 5% электроэнергии расходуется на разряд на катоде ионов водорода.
Общее напряжение на ванне Е в при электролизе цинка определяется уравнением
где (Е в — Е к ) — напряжение разложения ZnS 0 4 , выраженное через разность потенциалов анода и катода; Е Э л, Е ко » и Е щл — потери напряжения соответственно в электролите, контактах и в анодном шламе.
Теоретическое напряжение разложения сульфата цинка составляет 2,45 В (- 0,76 В на катоде и +1,69 В на аноде). На практике Е в =3,3- s -3 > 4 В.
Расход электроэнергии (постоянного тока) при получении электролитного цинка колеблется от 2900 до 3200 кВтХ
Электролитический способ получения цинка позволяет получать металл высокой чистоты, содержащий не менее 99,99 % Zn ; по ГОСТ 3640—79 это соответствует маркам ЦБ
(>99,99% Zn ), ЦВ1(>99,992% Zn ) и ЦВ0 (>99,995.% Zn ). Для получения высших марок товарного металла электролитический цинк очищают вакуумной перегонкой.
Основными направлениями дальнейшего совершенствования процесса электролитического осаждения цинка являются :
1) повышение чистоты нейтрального раствора;
2) наметившаяся в 70-х годах тенденция к снижению
3) совершенствование конструкции электролизных ванн
с целью увеличения их производительности;
4) механизация и автоматизация процесса в целом и в первую очередь операции сдирки катодного цинка.
Снижение плотности тока при электролизе цинка способствует стабилизации процессов, улучшению условий труда и получению катодных осадков высокого качества, удовлетворяющих требованиям автоматизированной сдирки.
Заслуживает внимания в этом отношении промышленный опыт завода «Бален» (Бельгия), где электролиз цинка осуществляют при плотности тока 400 А/м 2 в крупногабаритных ваннах длиной 4550 мм, шириной 2150 мм и глубиной 2150 мм. Рабочая площадь катодов, помещаемых в такие ванны, составляет 2,6 м 2 (1,3X2 м), что более чем в два
раза превышает площадь обычных катодов (1,2 м 2 ).
На заводе «Бален» успешно осуществлена механизированная и автоматизированная сдирка катодного цинка, управляемая ЭВМ. Освоение автоматизированной линии позволило повысить производительность труда в три раза.
Катодный цинк непригоден для непосредственного использования и его переплавляют в чушки определенной формы и массы. Переплавку катодного цинка в печах ведут с добавкой на 1 т цинка 0,5—0,6 кг/т хлористого алюминия — флюса, разрушающего оксидную пленку на поверхности катодных листов и способствующего слиянию корольков расплавленного металла. При наличии на поверхности капель оксидных пленок они не сливаются друг с другом и образуют порошкообразные дроссы.
На современных цинковых заводах переплавку цинка проводят в индукционных печах. Производительность таких печей составляет от 100—120 (при емкости печи 20 т| до 350—500 т/сут. Выход чушкового свинца достигает 98-98,5 %; в дроссы и пыль переходит до 2 % цинка.
Разливку цинка обычно ведут» на карусельных разливочных машинах, хотя более целесообразно использовать прямолинейные разливочные машины. Такие машины установлены на ряде отечественных и зарубежных заводов.
В настоящее время созданы практически полностью механизированные поточные плавильно-литеиные комплексы (рис. 132), работающие по схеме: загрузка катодов в печь — плавка в индукционной печи— разливка — штабелирование чушек — погрузка на транспортные средства.
http://buzani.ru/zadachi/khimiya-shimanovich/944-elektroliz-electrolysis-uravnenie-faradeya-zadaniya-268-270
http://klukonin.narod.ru/index/0-43