Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы: этан → этиловый спирт → уксусный альдегид → уксусная кислота
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Изомерия спиртов
Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Получение этанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Уравнение реакции этан этиловый спирт уксусный альдегид
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие вещества относят к классу предельных одноатомных спиртов?
К предельным одноатомным спиртам относят органические вещества, в молекулах которых алкильный радикал связан с гидроксильной группой ―ОН. Их общая формула CnH2n+1OH
Приведите формулы и названия трёх первых представителей этого гомологического ряда.
CH3OH ― метанол, C2H5OH ― этанол, C3H7OH ― пропанол.
Задание 2
Напишите структурные формулы всех спиртов состава C4H9OH, назовите каждое вещество. Укажите типы изомерии, характерные для спиртов. Ответ проиллюстрируйте формулами изомерных бутиловых спиртов.
Для одноатомных спиртов характерна изомерия положения функциональной группы и углеродного скелета.
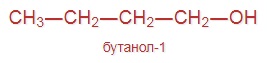 | Изомерия положения функциональной группы |
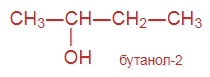 | Изомерия положения функциональной группы |
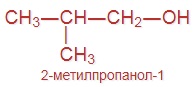 | Изомерия углеродного скелета |
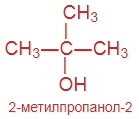 | Изомерия углеродного скелета |
Задание 3
Напишите структурные формулы следующих соединений:
а) 2-метилпропанол-2;
б) 2,3-диметилпентанол-3;
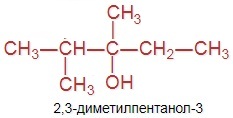 |
в) бутанол-2;
г) 3-метилбутанол-2.
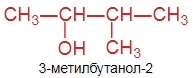 |
Задание 4
Какое действие на организм человека оказывает метиловый спирт?
Метиловый спирт очень ядовит, уже 5-10 мл метанола, попавшие в организм, вызывают полную потерю зрения в результате поражения сетчатки глаза, а 30 мл и более могут привести к летальному исходу.
Какое действие на организм человека оказывает этиловый спирт? При попадании этилового спирта в организм происходят психические и неврологические изменения, снижаются острота мышления и чёткость восприятия, нарушается координация движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — ядовит и вызывает тяжелые отравления. Систематическое употребление напитков, содержащих этиловый спирт, приводит к поражению нервной, сердечно-сосудистой системы, разрушает печень, вызывает понижение иммунитета, умственных способностей.
Задание 5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) этан ⟶ этилен ⟶ этиловый спирт ⟶ уксусный альдегид
H3C ― CH3 ⟶ H2C=CH2 + H2↑
H2C=CH2 + H2O ⟶ CH3–CH2 ― OH
CH3 ― CH2 ― OH + CuO ⟶ CH3 ― CHO + Cu + H2O
б) метан ⟶ хлорметан ⟶ метиловый спирт ⟶ метиловый эфир уксусной кислоты
CH4 + Cl2 ⟶ CH3Cl
CH3Cl + NaOH ⟶ CH3OH + NaCl
CH3 ― COOH + CH3OH ⟶ CH3 ― COO ― CH3 + H2O
в) этиловый спирт ⟶ этилен ⟶ бромэтан ⟶ этиловый спирт ⟶ этилат калия
H3C ― CH2 ― OH ⟶ H2C=CH2 (t, H2SO4)
H2C=CH2 + HBr ⟶ H3C ― CH2Br
H3C ― CH2Br + NaOH ⟶ H3C ― CH2 ― OH + NaBr
2H3C ― CH2 ― OH + K ⟶ 2H3C ― CH2 ― OK + H2 ↑
Задание 6
В двух пробирках без подписи находятся метиловый спирт и толуол. Предложите способ распознавания этих веществ. Напишите уравнение реакции.
Метиловый спирт, в отличие от толуола, реагирует с карбоновыми кислотами, с образованием эфиров (реация этерификации, которая катализируется сильными неорганическими кислотами) . Добавим в пробирки с веществами уксусную и концентрированную серную кислоты, нагреем пробирки, в пробирке с метиловым спиртом появится фруктовый запах метилацетата CH3―COO―CH3: 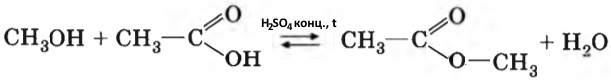
Задание 7
Какой объём водорода (н.у.) получится при действии 6,9 г натрия на 115 мл этилового спирта плотностью 0,80 г/мл?
Дано: m(Na)=6,9 г, V(C2H5OH)=115 мл, ρ(C2H5OH)=0,80 г/мл
Найти: V(H2)—?
Решение
1. Рассчитываем массу этилового спирта:
m(C2H5OH)=V(C2H5OH)•ρ(C2H5OH)=115 мл•0,80 г/мл=92 г
2. Количество вещества натрия и спирта рассчитываем по формуле: n=m/M, где M ― молярная масса.
M(Na)=23 г/моль, M(C2H5OH)=46 г/моль
n(Na)=m(Na)/M(Na)=6,9 г : 23 г/моль=0,3 моль
n(C2H5OH)=m(C2H5OH)/M(C2H5OH)=92 г : 46 г/моль=2 моль
3. Составим химическое уравнение:
2Na + 2C2H5OH = 2C2H5ONa + H2↑
По уравнению реакции 2 моль натрия реагируют с 2 моль этилового спирта, поэтому с 0,3 моль натрия прореагирует одиноковое количество вещества спирта, то есть 0,3 моль. По условию задачи имеем 2 моль этилового спирта, следовательно спирт взят в избытке, он реагирует не полностью, поэтому расчеты будем проводить по данным натрия.
По уравнению реакции n(Na):n(H2)=2:1, количество вещества водорода в 2 раза меньше количества вещества натрия, поэтому
n( H2 )=n( C2H5OH ):2=0,3 моль:2=0,15 моль
4. Вычисляем объём водорода в количестве вещества 0,15 моль по формуле: V= n • VM, где VM ― молярный объём .
n( H2 )=n( H2 ) • VM=0,15 моль • 22,4 л/моль=3,36 л
Ответ: 3,36 л
http://chemege.ru/etanol/
http://gdz.cool/h10_gos_2019/844-h10_gos_2019_11.html




















