ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
a -Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a -аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Описание опыта. В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
- Реакция Сакагучи
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a -нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a -нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a -нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
- РЕАКЦИЯ ФОЛЯ
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
- РЕАКЦИЯ С ФОРМАЛЬДЕГИДОМ
При взаимодействии a -аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a -аминокислот методом формального титрования (метод Сёренсена).
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
- РЕАКЦИЯ Циммермана
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a -Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a -аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a -аминокислот дают соли, окрашенные в оранжевый цвет.
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают. Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
- Открытие серы в белках
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a -АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a -аминокислоты является реакция Фоля. Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
- РЕАКЦИЯ НА ТРИПТОФАН
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
Уравнение реакции фенилаланина с азотной кислотой
«Великий предок» важных веществ
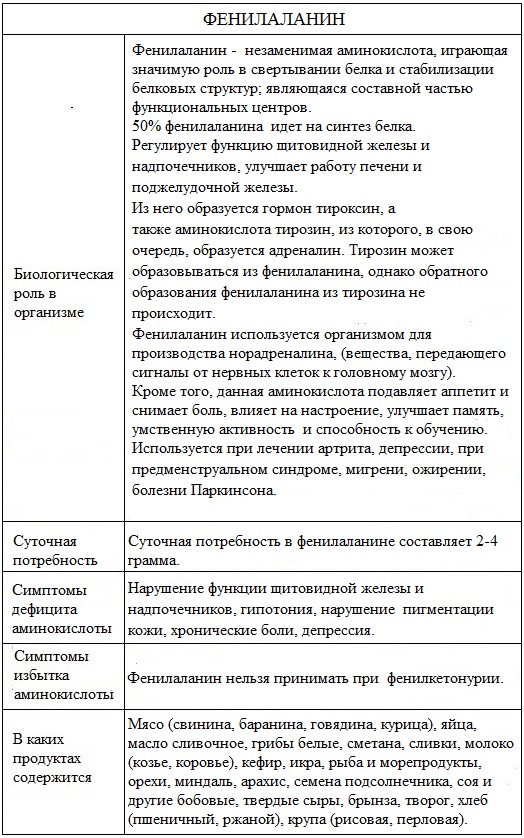
Фенилаланин – незаменимая ароматическая α–аминокислота.
Фенилаланин – это одна из основных 20 аминокислот, которая принимает участвие в биохимических процессах формирования протеинов и кодируется определенным геном ДНК.
Фенилаланин – 2-амино-З-фенилпропановая или α-амино-β-фенилпропионовая кислота.
Фенилаланин (Фен, Phe, F) относится к незаменимым аминокислотам, поскольку ткани животных не обладают способностью синтезировать его бензольное кольцо. Химическая формула C9H11NO2 (С6Н5СН2СН(NH2) COOH).
Фенилаланин впервые выделили из ростков люпина Э. Шульце и И. Барбиери в 1881.
Фенилаланин широко распространен в природе, встречается во всех организмах в составе молекул белков, в частности инсулина, яичного белка, гемоглобина, фибрине.
Суточная потребность в фенилаланине составляет 2-4 грамма.
Физические свойства
Фенилаланин представляет собой бесцветное кристаллическое вещество, разлагающееся при плавлении (283 0 C). Ограниченно растворяется в воде, малорастворим в этаноле.
Метаболизм фенилаланина в организме человека
В организме фенилаланин используется только в синтезе белков. Весь неиспользованный запас аминокислоты превращается в тирозин. Превращение фенилаланина в тирозин прежде всего необходимо для
удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток.
Образование тирозина не имеет большого значения, так как недостатка его в клетках практически не бывает. Тирозин полностью заменим при достаточном поступлении фенилаланина с пищей.
Фенилаланин непрерывно образуется в организме при распаде белков пищи и тканевых белков. Потребность в фенилаланине возрастает при отсутствии в пище аминокислоты тирозина.
Биологичекая роль фенилаланина для человека очень важна.
Фенилаланин является исходным сырьем синтеза другой аминокислоты – тирозина, который, в свою очередь, является предшественником адреналина, норадреналина и дофамина, а также пигмента кожи меланина.
Фенилаланин образуется в организме при распаде синтетического сахарозаменителя – аспартама, активно используемого в пищевой промышленности.
Фенилаланин обеспечивает мозг необходимым количеством вещества для биохимических процессов, которые запускаются в случае возрастания нагрузки. Происходит автоматическая стимуляция умственной деятельности, повышается обучаемость человека.
Фенилаланин связан с функцией щитовидной железы и надпочечников, участвует в образовании тироксина – основного гормона щитовидной железы. Этот гормон регулирует скорость обмена веществ, например, ускоряет «сжигание» питательных веществ, имеющихся в избытке. Фенилаланин нормализует работу щитовидной железы.
Фенилаланин играет значительную роль в синтезе таких белков, как инсулин, папаин и меланин, а также способствует выведению почками и печенью продуктов метаболизма.
Он способствует улучшению секреторной функции поджелудочной железы и печени.
Фенилаланин участвует в синтезе веществ, действие которых аналогично адреналину.
Фенилаланин входит в состав белков, выполняет функцию строительного блока белков и является важным «кирпичиком» в «строительстве» организма.
Фенилаланин входит в состав белков организма, которые составляют мышцы, сухожилия, связки и другие органы. Кроме того, он входит в состав жиросжигателей.
Это важно для тех, кто желает набрать мышечную массу. В первую очередь это касается бодибилдеров. При недостатке фенилаланина невозможно добиться хороших результатов в бодибилдинге.
Поэтому многие пищевые добавки в спортивном питании, созданные для увеличения интенсивности и максимального подъема энергии, содержат фенилаланин.
В организме фенилаланин может превращаться в другую аминокислоту – тирозин, из которого синтезируются два основных нейромедиатора: дофамин и норадреналин, которые непосредственно участвуют в передаче нервного импульса.
Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, усиливает половое влечение.
Фенилаланин стимулирует выработку меланина, поэтому принимает участие в регуляции цвета кожных покровов.
Нарушение нормального пути превращения фенилаланина приводит к развитию болезни фенилкетонурия.
Природные источники
Натуральными источниками фенилаланина являются мясо (свинина, баранина и говядина), куриное мясо и яйца, икра, рыба и морепродукты, орехи, миндаль, арахис, семена подсолнечника соя и другие бобовые, твердые сыры, брынза, творог, молоко и молочные продукты, в которых он содержится в больших количествах.
Усвоение фенилаланина повышают витамин C, B6, железо, медь и ниацин (никотиновая кислота, витамин В3, витамин РР).
Заболевания, связанные с нарушением метаболизма фенилаланина
Депрессия
Фенилаланин – важнейший «стройматериал» для нейромедиаторов, способствующих бодрости, хорошему настроению, позитивному мировосприятию и даже избавлению от боли, депрессии, апатии, вялости.
Фенилаланин является основой синтеза эндорфинов, которых называют «гормонами счастья».
Эти гормоны и нейромедиаторы вызывают положительную активацию психики, ясность и остроту мышления, приподнятое настроение, оптимистический взгляд на мир и собственную личность. Человек испытывает ощущение радости, благополучия и умиротворенности.
Более того, эндорфины облегчают хронические и острые боли, способствуют более скорому выздоровлению при различных заболеваниях.
Фенилаланин – единственное вещество, из которого может быть синтезирован фенилэтиламин, содержащийся в шоколаде и обладающий легким стимулирующим действием и одновременно оказывающим успокаивающее воздействие на психику.
Ежедневный прием фенилаланина в сочетании с витамином В6 приводил к быстрому улучшению состояния.
Хронические боли
Фенилаланина, обладает обезболивающим действием при артритах, болях в спине и болезненных менструациях.
Фенилаланин уменьшает воспаление и способен усиливать действие обезболивающих препаратов.
Витилиго
Фенилаланин способен содействовать восстановлению пигментации кожи и уменьшать обесцвеченные пятна при витилиго. При этом заболевании фенилаланин почти так же эффективен, как и тирозин.
Хорошо зарекомендовали себя кремы с фенилаланином, но для достижения лучшего результата необходимо использовать фенилалалин в сочетании с медью, необходимой организму для выработки меланина – естественного пигмента кожи.
Неврологические заболевания
Фенилаланин существенно уменьшает проявление ряда симптомов болезни Паркинсона (в частности, депрессии, расстройства речи, трудностей при ходьбе и ригидности конечностей).
Отвыкание от кофеина
Фенилаланин является хорошей заменой кофеину и помогает окончательно проснуться и стать бодрее.
Фенилкетонурия
Это распространенное наследственное заболевание, связанное с нарушением белкового обмена в организме человека.
Одно из наиболее тяжелых последствий фенилкетонурии это поражение головного мозга и сопутствующие ему нарушения психического и физического развития детей. При заболевании нарушаются обменные процессы, особенно важные для развивающегося мозга ребенка.
Общими нарушениями при наследственных дефектах обмена аминокислот являются выделение аминокислот с мочей и ацидоз тканей.
Дети, больные фенилкетонурией, нередко рождаются от здоровых родителей, которые являются носителями измененного (мутантного) гена.
При раннем выявлении болезни и правильном соблюдении диеты ребенок с фенилкетонурией может вырасти совершенно здоровым.
Фенилаланин вреден при фенилкетонурии.
Области применения
В отличие от искусственных стимуляторов (кофе, алкоголя), которые истощают запас энергии и, в последствии, приводят человека в состояние опустошенности и раздражения, эта аминокислота позволяет успешно справляться с раздражением и чувством тревоги.
Фенилаланин помогает человеку снять напряжение без применения алкоголя, тем самым делая человека менее зависимым от приема алкоголя и препаратов опия.
Фенилаланин способствует регуляции природного цвета кожи путем образования пигмента меланина. Он является необходимым при витилиго, когда происходит частичная потеря пигментации кожи. Фенилаланин помогает восстановить цвет кожи на месте бледных пятен.
Фенилаланин полезен при болезни Паркинсона (снижает тяжесть симптомов — депрессия, расстройства речи, ригидность конечностей).
Препараты, содержащие фенилаланин
L-Фенилаланин
Применяется при заболеваниях щитовидной железы, синдроме хронической усталости, депрессии, расстройстве внимания и/или гиперактивности, алкоголизме, ожирении, артрите, предменструальном синдроме, мигрени, хронических и острых болях (в том числе при онкологических заболеваниях), зависимости (от кофеина, алкоголя, наркотические), витилиго, болезни Паркинсона.
Он улучшает интеллектуальные способности, подавляет аппетит, восстанавливает пигментацию кожи.
Необходимыми для метаболизма фенилаланина веществами, стимулирующими его действие, являются витамин B6, витамин С, медь, железо и ниацин.
DL-фенилаланин
Действует как естественное болеутоляющее средство при некоторых повреждениях шейного отдела позвоночника (как от сотрясения при аварии), остеоартрите, ревматоидном артрите, болях в пояснице, мигрени, судорогах мышц рук и ног, болях после операции, невралгии.
Лабораторная работа №1
Лабораторная работа №1
ХИМИЯ ПРОСТЫХ БЕЛКОВ.
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белки представляют собой высокомолекулярные полимерные органические соединения, построенные из остатков различных α-аминокислот, соединенных ковалентной пептидной связью.
Присутствие белка в растворах можно обнаружить с помощью цветных реакций, обусловленных наличием в белке аминокислот, их специфических групп и пептидных связей. Существуют универсальные цветные реакции, т. е. на все белки (биуретовая и нингидриновая), и специфические, т. е. на определенные аминокислоты (ксантопротеиновая, Миллона, Фоля и др.).
На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот, которые широко используются в биохимических лабораториях.
Цель: Ознакомиться с универсальными цветными реакциями на белки и специфическими реакциями на отдельные аминокислоты, содержащиеся в белковых растворах.
Работа 1. Биуретовая реакция на пептидную связь (Пиотровского)
Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью комплексы фиолетового цвета с красным или синим оттенком. Группа, образующая пептидную связь, в щелочной среде присутствует в своей таутомерной енольной форме:
При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью. Возникает солеобразная связь. Кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их электронных пар. Возникающий таким образом комплекс очень стабилен. Интенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе.
Биуретовой реакцией обнаруживаются все без исключения белки, а также продукты их неполного гидролиза – пептоны и полипептиды. Для ди — и трипептидов биуретовая реакция ненадежна. Оттенок зависит от длины полипептидной цепочки. Пептоны при этой реакции дают розовое или красное окрашивание. Биуретовая реакция положительна и с веществами небелкового характера, имеющими в составе не менее двух – CO – NH2-групп, к ним относятся, например, оксамид – NH2 – CO – CO – NH2, биурет – N2H – CO – NH – CO – NH2.
Исследуемый материал: раствор яичного белка, раствор растительного белка, 1% раствор желатина.
Реактивы: 10% раствор NaOH, 1% раствор CuSO4.
Оборудование: пробирки, капельницы.
Ход работы. К 5 каплям водного раствора белка добавляют 5 капель 10% раствора NaOH и 2 капли 1% раствора CuSO4. Содержимое перемешивают. Оно приобретает сине-фиолетовый цвет. Нельзя добавлять избыток CuSO4, так как синий осадок маскирует характерное фиолетовое окрашивание биуретового комплекса.
Работа 2. Нингидриновая реакция на α-аминокислоты
Белки, полипептиды и свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя СО2, NH3 и соответствующий альдегид. Нингидрин, являясь сильным окислителем, вызывает окислительное дезаминирование α-аминокислоты, приводящее к образованию аммиака, двуокиси углерода, соответствующего альдегида и восстановленной формы нингидрина. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет.
http://himija-online.ru/organicheskaya-ximiya/aminokisloty/fenilalanin.html
http://pandia.ru/text/80/187/38426.php