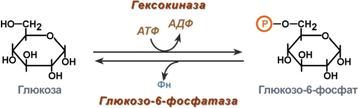
Гексокиназа — первый фермент метаболизма глюкозы
Наличие глюкозы в клетке обеспечивается, в первую очередь, облегченной диффузией ее из крови в цитозоль при участии специальных транспортных белков — глюкозных транспортеров (ГлюТ).
Активация глюкозы
После перемещения через мембраны глюкоза в цитозоле немедленно фосфорилируется ферментом гексокиназой , в связи с чем фермент образно называют «ловушка глюкозы«. Фосфорилирование глюкозы решает несколько задач:
- фосфатный эфир глюкозы не в состоянии выйти из клетки, так как молекула отрицательно заряжена и отталкивается от фосфолипидной поверхности мембраны,
- наличие заряженной группы обеспечивает правильную ориентацию молекулы в активном центре фермента,
- уменьшается концентрация свободной (нефосфорилированной) глюкозы в клетке, что способствует диффузии новых ее молекул из крови.
Дефосфорилирование глюкозы осуществляется глюкозо-6-фосфатазой . Этот фермент есть только в печени и почках. В эпителии канальцев почек работа фермента связана с реабсорбцией глюкозы. В гепатоцитах фермент необходим, когда печень поддерживает концентрацию глюкозы в крови при гипогликемии.
Реакции фосфорилирования и дефосфорилирования глюкозы
Кроме внешней среды (крови) источником глюкозы для клеток являются запасы гликогена, который используется как внутриклеточный резерв.
Вместе с этим, гепатоциты и канальцевый эпителий почек обладают способностью синтезировать глюкозу из неуглеводных компонентов (глюконеогенез). Но в данном случае глюкоза уходит из этих клеток в кровь и используется другими клетками.
Особенности глюкокиназы
Существуют принципиальные отличия метаболизма глюкозы в печени от других тканей. Это объясняется рядом причин и, в частности, наличием в тканях различных изоферментов гексокиназы. Для печени характерен особый изофермент гексокиназа IV, получивший собственное название – глюкокиназа . Отличиями этого фермента от гексокиназ других тканей являются:
- низкое сродство к глюкозе (в 1000 раз меньше), что ведет к захвату глюкозы печенью только при ее высокой концентрации в крови (после еды),
- продукт реакции глюкозо-6-фосфат не ингибирует фермент, в то время как в других тканях гексокиназа чувствительна к такому влиянию. Это позволяет гепатоциту в единицу времени захватывать и фосфорилировать глюкозы больше, чем он может сразу же утилизовать,
- чувствительность к действию инсулина – фермент активируется этим гормоном.
Благодаря таким отличиям гепатоцит может эффективно захватывать глюкозу после еды, накапливать и впоследствии метаболизировать ее в любом направлении:
- синтез гликогена (гликогеногенез),
- получение рибозо-5-фосфата (пентозофосфатный путь),
- окисление до ацетил-SКоА и синтез из него жирных кислот и холестерина.
Реакции фосфорилирования и дефосфорилирования глюкозы
Также почти все клетки имеют запасы гликогена, который используется как внутриклеточный резерв глюкозы. Печеночные клетки и почки обладают способностью синтезировать глюкозу из неуглеводных компонентов (глюконеогенез).
Судьба глюкозы
После активации (фосфорилирования) глюкоза в зависимости от условий и вида клетки превращается по различным направлениям:
· часть глюкозы обязательно используется в энергетическомобмене, она сгорает в реакциях катаболизма для синтеза АТФ,
· при достаточно большом количестве в клетке глюкоза запасается в виде гликогена, к синтезу гликогена способны большинство тканей,
· в гепатоцитах (при высокой концентрации) и в адипоцитах глюкоза перенаправляется на синтезтриацилглицеролови в печени на синтез холестерола,
· при определенных условиях часть глюкозы идет в реакции пентозофосфатного пути, в котором образуются рибозо-5-фосфат и НАДФН,
· некоторая доля глюкозы используется для синтеза гликозаминови далее структурных или иных гетерополисахаридов.
Реакции превращения глюкозы в клетке
Гликоген — это легкоиспользуемый резерв энергии
Метаболизм гликогена
Мобилизация гликогена (гликогенолиз)
Резервы гликогена используются по-разному в зависимости от функциональных особенностей клетки.
Гликоген печенирасщепляется при снижении концентрации глюкозы в крови, прежде всего между приемами пищи. Через 12-18 часов голодания запасы гликогена в печени полностью истощаются.
В мышцахколичество гликогена снижается обычно только во время физической нагрузки – длительной и/или напряженной. Гликоген здесь используется для обеспечения глюкозой работы самих миоцитов. Таким образом, мышцы, как впрочем и остальные органы, используют гликоген только для собственных нужд.
Мобилизация (распад) гликогена или гликогенолизактивируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа). При этом уровень глюкозы крови«целенаправленно» поддерживает только печень, в которой имеется глюкозо-6-фосфатаза, гидролизующая фосфатный эфир глюкозы. Образуемая в гепатоците свободная глюкоза выходит через плазматическую мембрану в кровь.
В гликогенолизе непосредственно участвуют три фермента:
1. Фосфорилаза гликогена (кофермент пиридоксальфосфат) – расщепляет α-1,4-гликозидные связи с образованием глюкозо-1-фосфата. Фермент работает до тех пор, пока до точки ветвления (α1,6-связи) не останется 4 остатка глюкозы.
2. α(1,4)-α(1,6)-Глюкантрансфераза – фермент, переносящий фрагмент из трех остатков глюкозы на другую цепь с образованием новой α1,4-гликозидной связи. При этом на прежнем месте остается один остаток глюкозы и «открытая» доступная α1,6-гликозидная связь.
3. Амило-α1,6-глюкозидаза, («деветвящий» фермент) – гидролизует α1,6-гликозидную связь с высвобождением свободной (нефосфорилированной) глюкозы. В результате образуется цепь без ветвлений, вновь служащая субстратом для фосфорилазы.
Роль ферментов в расщеплении гликогена
Синтез гликогена
Гликоген способен синтезироваться почти во всех тканях, но наибольшие запасы гликогена находятся в печени и скелетных мышцах.
Накопление гликогена в мышцахотмечается в период восстановления после работы, особенно при приеме богатой углеводами пищи.
В печенигликоген накапливается только после еды, при гипергликемии. Такие отличия печени и мышц обусловлены наличием различных изоферментовгексокиназы, фосфорилирующей глюкозу в глюкозо-6-фосфат. Для печенихарактерен изофермент (гексокиназа IV), получивший собственное название –глюкокиназа. Отличиями этого фермента от других гексокиназ являются:
· низкое сродство к глюкозе (в 1000 раз меньше), что ведет к захвату глюкозы печенью только при ее высокой концентрации в крови (после еды),
· продукт реакции (глюкозо-6-фосфат) не ингибирует фермент, в то время как в других тканях гексокиназа чувствительна к такому влиянию. Это позволяет гепатоциту в единицу времени захватывать глюкозы больше, чем он может сразу же утилизовать.
Благодаря особенностям глюкокиназы гепатоцит эффективно захватывает глюкозу после еды и впоследствии метаболизирует ее в любом направлении. При нормальных концентрациях глюкозы в крови ее захват печенью не производится.
Непосредственно синтез гликогена осуществляют следующие ферменты:
1. Фосфоглюкомутаза– превращает глюкозо-6-фосфат в глюкозо-1-фосфат;
2. Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата;
Разница между Фосфорилированием и Дефосфорилированием
Основное различие между Фосфорилированием и Дефосфорилирования заключается в том, что Фосфорилирование является добавлением фосфатной группы к молекуле с помощью протеинкиназы , тогда как Дефосфорилирование является удалением фосфатной группы из органического соединения путем гидролиза, главным образом в фосфатазе.
Фосфорилирование и дефосфорилирование являются двумя важнейшими биохимическими реакциями в живых организмах. Фосфорилирование и Дефосфорилирование белка очень важны для передачи сигналов, деления клеток, трансляции белка, метаболизма и выживания. В клетке, как правило, более 30% белков подвергаются фосфорилированию. Наиболее важно то, что фосфорилирование и дефосфорилирование имеют место во всех типах белковых субстратов, таких как структурные белки, ферменты, мембранные каналы и сигнальные молекулы. Регуляция реакций фосфорилирования и дефосфорилирования в совокупности называется Фосфатаза.
Содержание
- Обзор и основные отличия
- Что такое Фосфорилирование
- Что такое Дефосфорилирование
- Сходство между Фосфорилированием и Дефосфорилированием
- В чем разница между Фосфорилированием и Дефосфорилированием
- Заключение
Что такое Фосфорилирование?
Фосфорилирование — это добавление или перенос фосфатной группы в молекулу с помощью фермента, называемого протеинкиназой. Фосфорилирование является распространённым видом посттрансляционной модификации белка в живых клетках. Реакция фосфорилирования белка является процессом присоединения фосфатной группы с помощью фосфоэфирной связи от АТФ к гидроксильной группе боковой цепи остатка гидроксиаминокислоты, такой как серин и треонин, а также ароматической альфа-аминокислоты такой как тирозин.
Серин в аминокислотной цепи до и после фосфорилирования
Этот процесс обычно наблюдается во многих физиологических процессах, происходящих в живых организмах, особенно в регуляции функции белка, локализации, конформации, взаимодействия и клиренса. Кроме того, фосфорилирование имеет решающее значение для внеклеточной передачи сигналов. Нейромедиаторы, гормоны и цитокины производят своё влияние путём регулирования фосфорилирования в белках-мишенях.
В геноме человека существует более 200000 мест фосфорилирования. Более 500 различных киназ участвуют в механизмах фосфорилирования.
Что такое Дефосфорилирование?
Дефосфорилирование является противоположностью фосфорилирования. Дефосфорилирование относится к удалению фосфатной группы из органического соединения путем гидролиза. Гидролаза, а главным образом фосфатаза, является ферментом, катализирующим дефосфорилирование. Подобно фосфорилированию, дефосфорилирование происходит во многих клеточных процессах. Во время дефосфорилирования происходит процесс, при котором от молекулы АТФ отщепляется один остаток фосфорной кислоты. Удаление фосфорной кислоты происходит посредством реакции гидролиза путем добавления молекулы воды и регенерации гидроксильной группы. При этом высвобождается энергия и АТФ превращается в АДФ (АДФ, также называется аденозиндифосфорной кислотой)
Белки часто подвергаются дефосфорилированию. Дефосфорилирование белков является ключевым процессом в передаче сигналов клетки. Кроме того, дефосфорилирование играет большую роль в размножении с использованием с использованием рестрикционных ферментов. Дефосфорилирующие фосфатазы предотвращают повторное лигирование.
Сходство между Фосфорилированием и Дефосфорилированием?
- Дефосфорилирование и фосфорилирование это важнейшие биохимические реакции в живых организмах;
- В обоих процессах участвуют фосфатные группы;
- Кроме того, они являются реакциями, катализирующими ферменты;
- Обе реакции обратимы;
- Оба процесса могут быть использованы для активации или дезактивации белка;
- Это важные посттрансляционные модификации белка в живых клетках.
В чем разница между Фосфорилированием и Дефосфорилированием?
- Фосфорилирование представляет собой добавление фосфатной группы к молекуле с помощью протеинкиназы, тогда как дефосфорилирование представляет собой удаление фосфатной группы из молекулы с помощью фосфатазы;
- Кроме того, фосфорилирование катализируется протеинкиназами, в то время как дефосфорилирование катализируется фосфатазами.
Заключение — Фосфорилирование против Дефосфорилирования
Фосфорилирование и Дефосфорилирование являются двумя процессами, которые имеют решающее значение для всех типов физиологических процессов. При фосфорилировании происходит перенос фосфатной группы в органическое соединение. Противоположная реакция происходит при Дефосфорилировании, при которой фосфатная группа удаляется из органического соединения. Однако обе реакции являются обратимыми. Кроме того, для катализа обоих типов реакций необходимы ферменты. Протеинкиназы катализируют фосфорилирование, тогда как фосфатазы катализируют Дефосфорилирование.
http://megaobuchalka.ru/10/240.html
http://raznisa.ru/raznica-mezhdu-fosforilirovaniem-i-defosforilirovaniem/