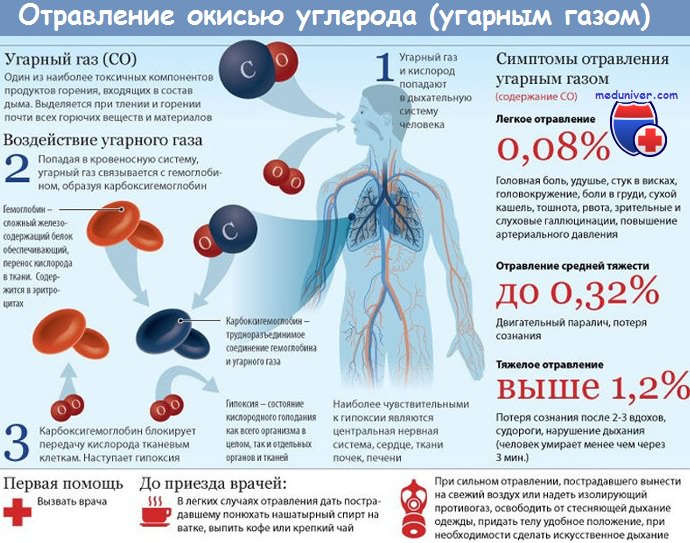
Уравнение реакции гемоглобина с угарным газом
Карбоксигемоглобин (HbCO) – это стабильный комплекс монооксида углерода, который образуется в эритроцитах при вдыхании монооксида углерода в результате метаболизма метиленхлорида в печени или в качестве побочного продукта в процессе деградации гемоглобина. Основным пусковым механизмом развития гипоксии при отравлении угарным газом (СО) является образование HbCO, который утрачивает способность переносить кислород. Образуется при действии на организм угарного газа (CO), а также при отравлении карбонилами металлов: никеля и железа. Постоянно находится в крови в небольшом количестве, но его концентрация может колебаться в зависимости от условий и образа жизни.
Побочные соединения гемоглобина.
Какой биоматериал можно использовать для исследования?
Общая информация об исследовании
Самым распространенным гемсодержащим белком и, следовательно, источником наиболее эндогенного CO является гемоглобин. В конце своей 120-дневной жизни эритроциты изолируются из кровообращения ретикулоэндотелиальной системой. В реакции, катализируемой ферментом, ограничивающим скорость оксигеназы гема, гем превращается в эквимолярные количества биливердина, железа и CO. Биливердин впоследствии превращается в желтый пигмент билирубин, который выводится печенью с желчью, а железо перерабатывается.
Карбоксигемоглобин (HbCO) – это стабильный комплекс монооксида углерода, который образуется в эритроцитах при вдыхании монооксида углерода в результате метаболизма метиленхлорида в печени или в качестве побочного продукта в процессе деградации гемоглобина (вариант нормы в определенных количествах). Из всех гемсодержащих белков Hb не только наиболее распространен, но и проявляет самое высокое сродство к окиси углерода, так что большая часть CO в крови связана с Hb. Обратимое связывание происходит с одним и тем же атомом железа на участке гема, где связывается кислород, продуктом этого связывания и является карбоксигемоглобин (COHb).
Эндогенно вырабатываемый монооксид углерода не просто потенциально токсичный отход метаболизма, он участвует во многих физиологических функциях, включая регуляцию дыхания, нейрональную передачу, регуляцию кровяного давления и сокращение матки во время беременности.
Обычно он составляет менее 1-2 % от общего гемоглобина, являясь продуктом реакции между монооксидом углерода и гемоглобином. Образуется, как указано выше, эндогенно, но также может быть распространенным загрязнителем окружающей среды; оба источника вносят свой вклад в количество COHb в крови. В оздух содержит СО, частично являющийся результатом естественных процессов, но в основном в результате неполного сгорания углеводородов. Наиболее значительным неестественным источником CO в окружающей среде служат выхлопные газы автомобилей. Совокупное воздействие эндогенного и экологического CO приводит к тому, что COHb составляет менее 3 % для большинства некурящих городских жителей и может составлять всего 1-2% для тех, кто живет в сельских районах, где воздух менее загрязнен CO.
Сигаретный дым содержит высокую концентрацию CO, и курильщики подвергаются воздействию примерно 400-500 ppm (parts per million — частей на миллион) CO во время курения и, следовательно, имеют гораздо более высокий COHb.
CO вытесняет кислород из гемоглобина, и, таким образом, COHb эффективно снижает способность переносить кислород дозозависимым образом. Кроме того, связывание СОHb в первом из четырех гем-сайтов оказывает влияние на его четвертичную структуру, что приводит к снижению сродства к кислороду в остальных трех сайтах. Этот эффект проявляется в сдвиге кривой диссоциации гемоглобина влево и приводит к снижению выделения кислорода из гемоглобина в тканях. Комбинированный эффект снижения способности переносить кислород и снижения высвобождения кислорода в ткани приводит к тому, что ткани испытывают кислородное голодание (гипоксия).
Такие органы, как мозг и сердце, чье нормальное потребление кислорода по сравнению с другими органами относительно высокое, особенно чувствительны к относительной аноксии, вызванной повышенным COHb.
Наиболее распространенные симптомы – головная боль, головокружение и спутанность сознания – отражают выраженную чувствительность мозга к относительной аноксии. Тошнота и рвота также распространены. Пострадавшие могут испытывать одышку, особенно при физической нагрузке, и иметь клинические признаки (тахикардия), указывающие на компенсацию дефицита кислорода. В более тяжелых случаях наблюдаются явные признаки и симптомы поражения сердца, включая учащенное сердцебиение, гипотензию, ишемическую боль в груди (стенокардию) и даже инфаркт миокарда. Судороги и кома возникают при тяжелой токсичности.
Для чего используется исследование?
- Подозрения на отравление угарным газом (головная боль, головокружение, боли в груди, шум в ушах, удушье, кашель, тошнота, рвота, повышение АД, галлюцинации, двигательный паралич, потеря сознания). При этом получение небольших доз токсичных воздействий может не сопровождаться симптомами, что затрудняет выявление хронической интоксикации.
- Мониторинг лечения отравления угарным газом.
- Оценка влияния хронической экспозиции СО на здоровье (на рабочих местах или дома при наличии источников СО (печи, уголь).
- Симптоматика центрального цианоза на фоне отсутствия респираторных нарушений и насосной функции сердца.
Что означают результаты?
Референсные значения: 0,5 — 1,5 %.
Отравление – при уровне > 20 %.
Летальный исход – 70 % от общего объема Hb.
Состояния, при которых возможно повышение уровня:
- курение – уровень HbCO у курильщиков может достигать 10 %;
- острое или хроническое отравление СО, основные источники СО – домашние отопительные системы, печи, применение угля в брикетах, подземные гаражи, туннели, городские автодороги;
- пассивное курение (места для курящих в офисах, ресторанах и т.д.);
- вдыхание паров дихлорметана (растворитель, широко использующийся в агентах, аэрозольных пропеллентах и др.).
При концентрации 0,05 % СО во вдыхаемом воздухе 50 % гемоглобина переходит в HbCO, а при образовании 70 % HbCO наступает летальный исход.
- 02-005 Клинический анализ крови (с лейкоцитарной формулой)
- 40-063 Клинический и биохимический анализы крови основные показатели 02-006 Общий анализ мочи с микроскопией
- 06-024 Лактат
- 06-442 Копропорфирины в моче
- 06-443 Аминолевулиновая кислота/порфобилиноген мочи
Уравнение реакции гемоглобина с угарным газом
Классическим примером повреждающего действия на кровь с нарушением ее дыхательной функции, обусловленным инактивацией кровяного пигмента — гемоглобина, служит образование карбоксигемоглобина (НbСО) под влиянием оксида углерода. Превращение гемоглобина в НbСО приводит к изменению спектральных характеристик крови, что легло в основу количественного определения его в крови. НbСО образуется в результате взаимодействия оксида углерода (СО) с железом гемоглобина, что лишает его способности к оксигенации, приводит к нарушению транспортной функции и как результат вызывает развитие гемической гипоксии. Появление НbСО служит следствием поступления СО в легкие с вдыхаемым воздухом. Образование НbСО начинается с периферии эритроцитов уже в легочных капиллярах. В дальнейшем с увеличением содержания СО во вдыхаемом воздухе НbСО образуется не только в периферических отделах эритроцита, но и в центральных его отделах. Причем скорость образования НbСО прямо пропорциональна величине концентрации СО во вдыхаемом воздухе, а максимум его в крови определяется временем контакта. Способность гемоглобина связывать 02 и СО одинакова при условии, что 1 г гемоглобина может связывать 1,33—1,34 мл 02.
Эта зависимость носит название константы Хюфнера. Вместе с тем сродство гемоглобина к СО в 250—300 раз больше, чем к 02. Примечательно, что оболочка эритроцитов служит своего рода защитным барьером при образовании НbСО, так как во взвеси эритроцитов этого деривата гемоглобина образуется на 20 % меньше, чем в растворе гемоглобина. Валентность железа в НbСО остается неизмененной, происходит лишь перестройка связей Fe2+. Все непарные электроны участвуют в образовании НbСО. Параллельно с образованием связей между СО и Fe2+ изменяется характер связи железа с глобином и порфирином. Она теряет свой ионный характер и превращается в ковалентную. Взаимодействие СО с Нb02 выражается взаимно сопряженными реакциями.
нbо2 + со -> нbсо + о2
НbСО + 02 -> Нb02 + СО
Скорость этих реакций и образование НЬСО определяются парциальным давлением СО и О2 в воздухе. При этом количество образовавшегося НbCO мо пропорционально давлению СО в окружающей среде и обратно пропорционально давлению 02. Несмотря на высокое, как указывалось выше, сродство СО к гемоглобину, ассоциация его с гемоглобином происходит в 10 раз медленнее, чем таковая с 02. Однако при этом диссоциация HbСО протекает в 3600 раз медленнее, чем диссоциация Нb02. По этой причине HbCO очень быстро накапливается в крови даже при сравнительно небольшом содержании СО во вдыхаемом воздухе. Таким образом, помимо выключения части гемоглобина из транспорта кислорода, еще одним патогенетически важным звеном в нарушении дыхательной функции крови на фоне карбоксигемоглобинемии служит замедление диссоциации оксигемоглобина под влиянием НЬСО, что известно под названием эффекта Холдена. Так в физиологических условиях повышение концентрации С02 в крови способствует ускоренному отщеплению 02 от НЬ02, при наличии НЬСО этот сбалансированный процесс нарушается.
Принято считать, что суть эффекта Холдена заключается в том, что при взаимодействии СО с гемоглобином поступивший в кровь СО соединяется только с 3 из 4 атомов железа в молекуле гемоглобина, тогда как с 4-м атомом железа соединяется 02, сродство которого к этому атому железа резко возрастает, что, естественно, затрудняет диссоциацию оксигемоглобина. Еще одним причинным фактором угнетения диссоциации Нb02 под влиянием СО служит снижение уровня промежуточного метаболита 2,3-дифосфоглицерата, который образуется в процессе реакции гликолиза. 2,3-Дифосфоглицерат обладает способностью усиливать процесс диссоциации НbСО за счет вызываемых им конформационных изменений гемоглобина, поэтому естественно, что дефицит этого метаболита косвенно тормозит высвобождение 02 из Нb02.
Гемоглобин
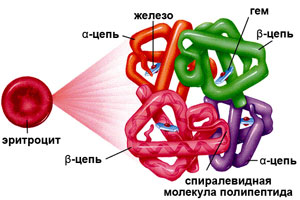
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA — взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) — гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
Как же это происходит? Почему в легких гемоглобин забирает, а в тканях отдает кислород?
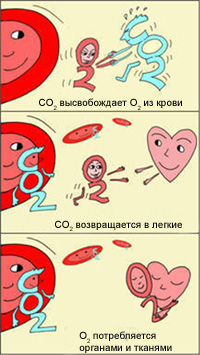
Эффект был описан датским физиологом Христианом Бором http://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Заболевания, связанные с изменением количества или структуры гемоглобина
- Повышение уровня гемоглобина наблюдается при эритроцитозах, обезвоживании.
- Снижение уровня гемоглобина наблюдается при различных анемиях.
- При отравлении угарным газом образуется карбгемоглобин (не путайте с карбоксигемоглобином!), который не может присоединять кислород.
- Под действием некоторых веществ образуется метгемоглобин.
- Изменение структуры гемоглобина называется гемоглобинопатией. Самые известные и частые заболевания этой группы – серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. См.гемоглобинопатии на сайте Всемирной организации здравоохранения http://www.who.int/mediacentre/factsheets/fs308/ru/index.html
Знаете ли Вы?
- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.

http://meduniver.com/Medical/Neotlogka/996.html
http://www.cirlab.ru/library/2/1763/