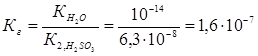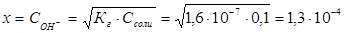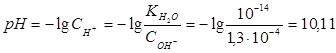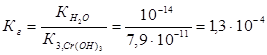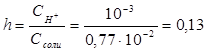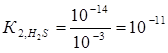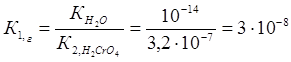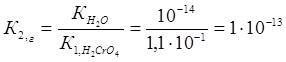Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
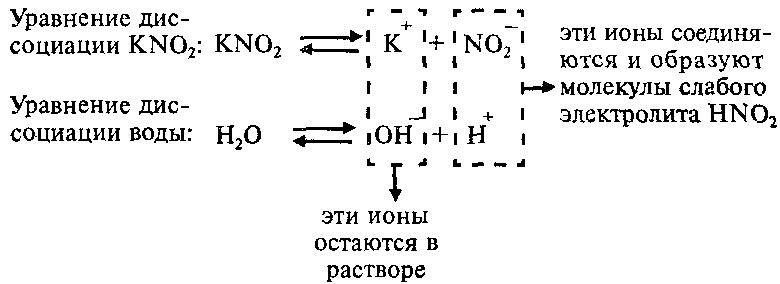
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
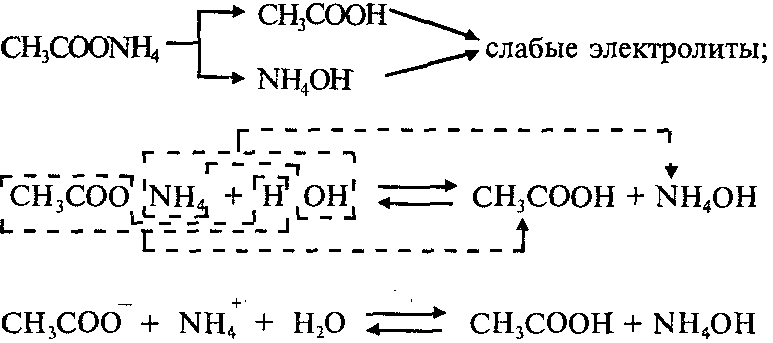
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
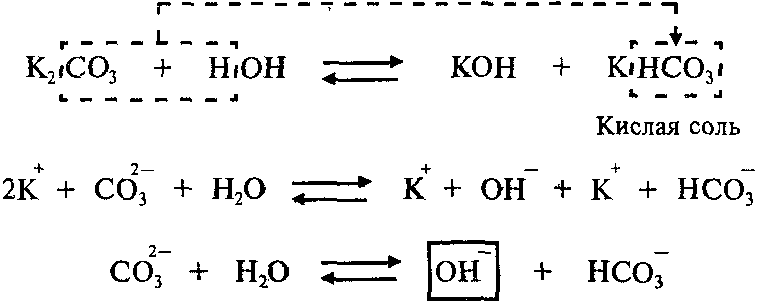
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e19d06408741fea • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Решение. 1. Хлорид калия KCl – соль, образованная сильным основанием KOH и сильной кислотой HCl .Такие соли гидролизу не подвергаются
1. Хлорид калия KCl – соль, образованная сильным основанием KOH и сильной кислотой HCl .Такие соли гидролизу не подвергаются, рН водного раствора =7.
2. Карбонат натрия Na2CO3 — соль, образованная сильным основанием NaOH и слабой кислотой H2CO3. Такие соли подвергаются гидролизу по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Поскольку при гидролизе в свободном виде образуются ионы гидроксила, водный раствор данной соли имеет щелочную среду (рН>7).
Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы Na + , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
В результате гидролиза образуется кислая соль NaНСО3.
3. Нитрат марганца Mn(NO3)2 — соль, образованная слабым основанием Mn(OH)2 и сильной кислотой HNO3. Такие соли подвергаются гидролизу по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Поскольку при гидролизе в свободном виде образуются ионы водорода, водный раствор данной соли имеет кислую среду (рН — , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
В результате гидролиза образуется основная соль MnOHNО3.
4. Ацетат аммония CH3COONH4 — соль, образованная слабым основанием NН4OH и слабой уксусной кислотой CH3COOH. Такие соли подвергаются гидролизу одновременно по катиону и по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Поскольку при гидролизе в свободном виде не образуются ни ионы водорода, ни ионы гидроксила водный раствор данной соли имеет близкую к нейтральной среду (рН≈7).
Уравнение гидролиза в молекулярной форме имеет вид:
Пример 2. Чему равна степень гидролиза h и значение рН сульфита натрия в растворе концентрации 0,1 моль/л?
Решение. Na2SО3 — соль, образованная сильным основанием NaOH и слабой кислотой H2SО3. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Константа гидролиза Кг рассчитывается с использованием справочных данных по формуле:
В соответствии с уравнением реакции 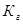
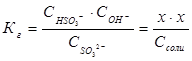
Степень гидролиза h показывает долю прогидролизовавшихся молекул и рассчитывается по формуле: 
Пример 3.Вычислите константу гидролиза и степeнь гидролиза раствора сульфата хрома Cr2(SO4)3, рН которого равен 3.
Решение. Cr2(SO4)3 — соль, образованная слабым основанием Cr(OH)3 и сильной кислотой H2SО4. Гидролиз протекает по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Константа гидролиза Кг рассчитывается с использованием справочных данных по формуле:
Вычислим концентрацию ионов водорода, исходя из значения рН = -lg 


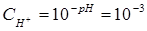
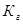
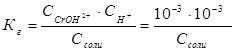

Пример 4.Вычислите константу диссоциации селенистоводородной кислоты Н2Se, если рН 0,05 М раствора Na2Se, равен 11,85.
Решение.Na2Sе — соль, образованная сильным основанием NaOH и слабой кислотой H2Sе. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Вычислим концентрацию ионов водорода, исходя из значения рН = -lg 


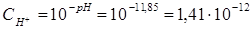
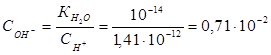
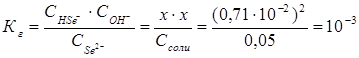
Константа гидролиза Кг рассчитывается по формуле: 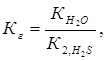
Пример 5.Вычислите константы гидролиза раствора хромата калия К2CrO4 и напишите уравнения гидролиза. По какой ступени гидролиз протекает в большей степени?
Решение.К2CrO4— соль, образованная сильным основанием КOH и слабой кислотой H2CrO4. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Константа гидролиза К1,г рассчитывается по формуле:
Константа гидролиза К2,г рассчитывается по формуле:
Так как К1,г˃ К2,г, то гидролиз по второй ступени практически не протекает.
12. ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции (ОВР) имеют большое значение в теории и практике. С ними связаны процессы: дыхание, обмен веществ, фотосинтез, гниение, горение, электролиз, коррозия металлов и др.
ОВР называются реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Степень окисления (зарядность, окислительное число) – это условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях.
Окислитель принимает электроны. Процесс приема электронов называется восстановлением, например:
Mn 6+ + 2e — ® Mn 4+ ,
Мn 6+ — окислитель, в процессе реакции восстанавливается до Mn 4+ .
Восстановитель отдает электроны. Процесс отдачи электронов называется окислением, например:
Zn 0 – 2e — ® Zn 2+ ,
Zn 0 – восстановитель, в процессе реакции окисляется до Zn 2+ .
Степень окисления может иметь нулевое, отрицательное, положительное значения.
При определении степени окисления следует знать несколько основных положений:
(-2) — степень окисления атома кислорода в соединениях:
H2 + O -2 , Cu +2 O -2 (исключение: пероксиды: H2 + O2 -1 , Na2O2 -1 , CaO2 -1 ; супероксиды (надперекиси): KO2 -1/2 , CsO2 -1/2 ; фторид кислорода O +2 F2 — ).
(-1) — степень окисления фтора в соединениях: H + F — , Са +2 F2 — .
( 0) — нулевую степень окисления имеют атомы в молекулах простых веществ и свободные металлы: H2 0 , O2 0 , Cl2 0 , Zn 0 , Cu 0 и др.
(+1) — степень окисления щелочных металлов (I А погруппа): Na + Cl — , K + Br — и др.
(+2) — степень окисления щелочноземельных металлов (II А подгруппа): Сa +2 Cl2 — , Ba +2 O -2 и др.
Используя эти данные, можно вычислять степени окисления других атомов в соединениях, зная, что алгебраическая сумма степеней окисления всех атомов, входящих в молекулу, равна нулю.
http://gomolog.ru/reshebniki/11-klass/gabrielyan-2019/13/3.html
http://lektsii.org/2-1073.html