Образование медной и железной солей глицина
В две пробирки помещают по 2 мл CuSO4 и затем в одну из них добавляют 1 мл 1%-ного раствора глицина. Затем приливают по 1 мл разбавленного раствора щелочи и наблюдают образование Cu(OH)2 в одной из пробирок.
В третью пробирку помещают 1 мл 5%-ого раствора глицина, добавляют несколько капель 3%-ного раствора FeCl3.
1) Cо свободным сульфатом меди реакция с глицином не пойдет. Нужно образовать гидроксид.
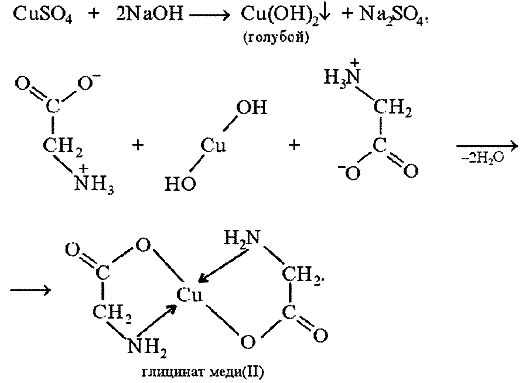 |
Аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Лиганд NH2CH2COO − (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем — через атом кислорода карбоксильной группы и через атом азота аминогруппы.
Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла, в связи с чем полученный комплекс отличается высокой устойчивостью. Константа образования диглицинатомеди(II) β2равна 1,8·10 15 .
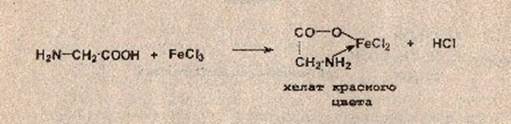 |
Реакция с хлоридом железа (III). От прибавления раствора хлорида железа (III) к аминокислоте жидкость приобретает сине-фиолетовую окраску. Состав и окраска комплексов, образующихся при взаимодействии аминокислоты с ионами железа, зависит от рН среды. При рН=1,8. 2,5 образуется моносалицилатный комплекс , имеющий сине-фиолетовую окраску. При рН = 4. 8 образуется дисалицилатный комплекс , имеющий красно-бурую окраску. Комплекс железа , имеющий желтую окраску, образуется при рН = 8. 11.
Мир науки
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Химия — рефераты, шпаргалки, семинары, конспекты, лекции
Качественные реакции на аминокислоты (альфа-аминокислоты)
Опыт 26. Определение реакции среды в водном растворе глицина
С помощью полоски универсальной индикаторной бумаги определяют рН 1% раствора глицина. Отсутствие кислой реакции раствора глицина объясняется образованием внутримолекулярной соли (цвитер-иона).
Опыт 27. Реакция глицина с меди (II) сульфатом
В пробирку вносят по 0,5 мл 2% раствора меди (II) сульфата и 1% раствора глицина. Образуется стойка внутримолекулярная комплексное соединение синего цвета:
Серная кислота, которая выделяется в процессе, не разрушает комплекс. При дальнейшем добавлении 5 — 10 капель 10% раствора гидроксида натрия к комплексу изменений не происходит, поскольку соль глицина устойчива как в кислой, так и в щелочной средах.
Опыт 28. Взаимодействие α-аминокислот с формальдегидом
В пробирку вносят 3 капли 40%-го водного раствора формальдегидные гиду и 1 каплю индикатора метилового красного. Наблюдают появление красной окраски раствора, свидетельствующее о наличии кислой среды.
Пипеткой в пробирку каплями добавляют 10%-й водный раствор на-тройника гидроксида до нейтральной реакции. Наблюдают появление желтой окраски раствора. Полученный нейтрализованный раствор формальдегида смешивают с 3 каплями 1%-ного водного раствора глицина и наблюдают появление красного цвета (кислая среда):
Качественная реакция основывается на блокировании формальдегидом аминогруппы кислоты.
Опыт 29. Взаимодействие α-аминокислот с нингидрином
В пробирку вносят 2 капли 0,1% раствора нингидрина и 4 капли 1%-го раствора α-аминокислоты. Смесь нагревают до кипения и наблюдают появление сине-фиолетовой окраски раствора:
Нингидринна реакция применяется для качественного определения α-аминокислот.
Практическая работа № 7. Амины. Аминокислоты. Белки
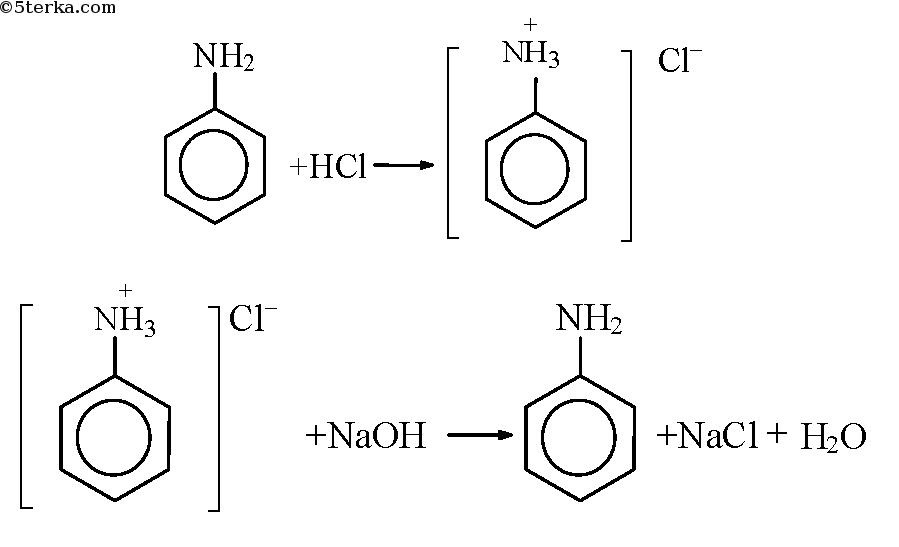
Опыт 1. Образование солей анилина
В пробирку налили чуть-чуть анилина и добавили немного воды, смесь размешали. Наблюдаем образование эмульсии. Добавили по каплям соляную кислоту до полного растворения анилина в воде. К раствору добавили немного раствора щелочи. Наблюдаем разделение раствора на две фазы.
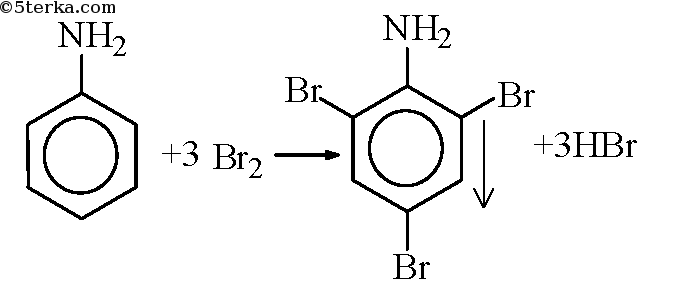
Опыт 2. Бромирование анилина
В пробирку налили чуть-чуть анилина и добавили воду. По каплям прибавляем бромную воду до выпадения белого осадка.
Опыт 3. Получение медной соли глицина
В пробирку налили 2 мл глицина и добавили немного порошка оксида меди (II). Пробирку нагрели. Наблюдаем голубое окрашивание раствора.
Опыт 4. Денатурация белка
Растворили белок куриного яйца в воде. В пробирку налили немного этого раствора и нагрели. Наблюдаем помутнение раствора — произошла денатурация. После охлаждения и разбавления раствор все равно остался мутным, т. к. денатурация — процесс необратимый.
Опыт 5. Осаждение белка солями тяжелых металлов
Опыт 6. Цветные реакции белков
а) Ксантопротеиновая реакция.
В пробирку налили немного раствора белка и прибавили несколько капель концентрированной азотной кислоты. Пробирку нагрели. Наблюдаем образование желтого осадка. Содержимое пробирки охладили и прилили раствор аммиака до щелочной реакции. Наблюдаем изменение цвета осадка на оранжевый.
б) Биуретовая реакция.
В пробирку налили немного раствора белка и добавили немного раствора гидроксида натрия и медного купороса. Наблюдаем окрашивание раствора в сине-фиолетовый цвет.

задача №7
к главе «Химический практикум».
http://worldofscience.ru/himija/8963-kachestvennye-reaktsii-na-aminokisloty-alfa-aminokisloty.html
http://5terka.com/node/10976