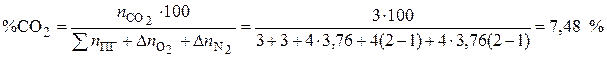Составьте уравнения реакций горения на воздухе ацетона (СН 3 ) 2 СО и эфира (С 2 Н 5 ) 2 А
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Решение. Сгорает индивидуальное химическое соединение в конденсированном состоянии
Сгорает индивидуальное химическое соединение в конденсированном состоянии.
1. Составляем уравнение реакции горения ацетона в воздухе:
2. Объём воздуха, необходимый для сгорания 1 кг ацетона, рассчитываем по формуле (7), учитывая при этом, что масса одного киломоля ацетона составляет 58 кг/кмоль:
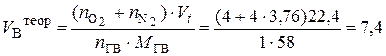
3. Действительный объём воздуха, пошедшего на сгорание 1 кг ацетона, рассчитывается с учётом коэффициента избытка воздуха a:

4. Избыток воздуха составит:
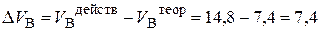
5. Теоретический объём продуктов горения рассчитываем по формуле (14):

6. Действительный объём продуктов горения составит:
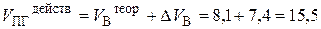
7. Объём воздуха, теоретически необходимого для сгорания 100 кг ацетона, составит соответственно 740 м 3 (7,4 × 100), при этом выделится 1 550 м 3 продуктов сгорания.
8. Процентное содержание углекислого газа рассчитывается по формуле, %
Ответ: При сгорании 100 кг ацетона объём воздуха при нормальных условиях составит 1480 м 3 , а объём продуктов горения – 1550 м 3 , процентное содержание углекислого газа в продуктах горения составило 7,48 %.
Примечание.Если в процессе горения были заданы условия, отличные от нормальных (Т¹273 К, Р¹101,3 кПа), то объём продуктов горения и воздуха рассчитывается с учётом объёма, который занимает один кмоль газа при заданной температуре:

где Р0 =101,3 кПа; Т0 = 273 К; Т и Р заданные температура и давление.
ПРИМЕР:Рассчитать количество толуола (С7Н8), которое сгорело в закрытом помещении объёмом 100 м 3 , если содержание кислорода в продуктах горения составило 12 %. Условия нормальные.
Уравнение горения ацетона?
Химия | 10 — 11 классы
Уравнение горения ацетона.
C3H6O + 4O2 — > ; 3CO2 + 3H2O.
Составьте реакцию горения ацетона и пропаналя?
Составьте реакцию горения ацетона и пропаналя.
Химическая формула ацетона С3Н6О?
Химическая формула ацетона С3Н6О.
а) из атомов каких элементов состоит ацетон
б) число атомов в составе его молекулы
в) молекулярную массу ацетона и массовую долю ацетона
Общее уравнение горения аренов?
Общее уравнение горения аренов.
Уравнение реакции горения гексана?
Уравнение реакции горения гексана?
Химическая формула ацетона С3Н6О укажитеа) из атомов каких элементов состоит ацетонб)число атомов в его составев)относительную молекулярную массу ацетона?
Химическая формула ацетона С3Н6О укажите
а) из атомов каких элементов состоит ацетон
б)число атомов в его составе
в)относительную молекулярную массу ацетона.
Уравнение горения циклобутана)))?
Уравнение горения циклобутана))).
Напишите уравнение — горение полипропилена?
Напишите уравнение — горение полипропилена.
Уравнение реакции горения серы?
Уравнение реакции горения серы.
Химическая формула ацетона C6H3O?
Химическая формула ацетона C6H3O.
Укажите : из атомов каких элементов состоит ацетон, число атомов в составе его молекулы, относительную молекулярную массу ацетона.
Пж помогите сотавить уравнения образования воды при горении водорода, метана CH4, сероводорода H2S и ацетона C3H6O?
Пж помогите сотавить уравнения образования воды при горении водорода, метана CH4, сероводорода H2S и ацетона C3H6O!
Вы перешли к вопросу Уравнение горения ацетона?. Он относится к категории Химия, для 10 — 11 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
K2O — оксид калия (основные оксиды) BaO — оксид бария (основные оксиды) Al2(SO4)3 — сульфат алюминия (средние соли) NaHCO3 — гидрокарбонат натрия (кислые соли).
4P + 5O₂ = 2P₂O₅ P⁰ — 5e = P⁺⁵ 4 фосфор восстановитель, процесс окисления O₂ + 4e = 2O⁻² 5 кислород окислитель, процесс восстановления P₂O₅ + 3H₂O = 2H₃PO₄ P₂O₅ + 3H₂O = 2H⁺ + 2H₂PO₄⁻ H₃PO₄ + 3NaOH = Na₃PO₄ + 3H₂O H⁺ + H₂PO₄⁻ + 3Na⁺ + 3OH⁻ = 3Na⁺ + P..
Fe(OH)3 + 3HCl = FeCl3 + 3H2O n(Fe(OH)3) = 21. 4 / 107 = 0. 2моль по уравнению реакции n(HCl) в 3 раза больше n(fe(oh)3) n(hcl) = 0, 6 моль m = n * M m(hcl) = 0. 6 * 36. 5 = 21. 9г W = m(в — ва) / m(р — ра) m(р — ра) = m(в — ва) / W m(hcl)(ра — ..
HCl + H2O = H3O( + ) + Cl ( — ).
А) по уравнению при восстановлении 1моль оксида выделяется 80кДж теплоты , значит при восстановлении 5 моль = 80 * 5 = 400кДж б)1, 6г это 1, 6 / 64 = 0, 025моль оксида , теплоты будет 80 * 0, 025 = 2кДж.
Mr(SO3) = 32 + 3 * 16 = 80 W(S) = 32 / 80 = 0. 4 = 40% Mr(SO2) = 32 + 2 * 16 = 64 W(S) = 32 / 64 = 0. 5 = 50% В 0, 8 раза.
M(CuSO4) = 64 + 32 + 4 * 16 = 160 г / моль n(CuSO4) = 1. 6 / 160 = 0. 01 моль.
http://mydocx.ru/4-90443.html
http://himia.my-dict.ru/q/1398962_uravnenie-gorenia-acetona/